Circulation 哥伦比亚大学程柯教授团队开发新型可吸入式外泌体疗法用于心脏修复
时间:2024-08-29 18:04:56 热度:37.1℃ 作者:网络
心肌梗死(心梗)是导致心力衰竭最常见和最重要的原因之一。心脏再生医学疗法最初是将具有分化能力的干细胞移植到患者的心脏,以修复受损的心脏细胞,从而增强和改善心脏功能。而随后的研究发现,干细胞的旁分泌效应和释放的外泌体在其中发挥了关键作用。近年来,越来越多的研究在动物模型中证实了外泌体治疗作为新一代疗法,在梗死后的心肌修复中存在巨大潜能。然而,在临床转化阶段,研究人员发现外泌体在体内的代谢较快,所需剂量较高。因此,如何安全、高效地实现外泌体递送成为其在心脏治疗中的关键。
2024年8月26日,美国哥伦比亚大学生物医学工程系的程柯教授带领团队在顶尖心血管领域杂志Circulation上发表题为“Inhalable Stem Cell Exosomes Promote Heart Repair after Myocardial Infarction”的研究论文。该研究阐述了一种名为SCENT (Stem Cell-derived Exosome Nebulization Therapy)的无创性外泌体递送方法。通过可重复的雾化吸入来治疗梗死后的心脏。SCENT疗法可通过调节miRNA介导的信号通路来调控心脏代谢,有效改善心脏功能,为心肌修复带来新的选择和希望。

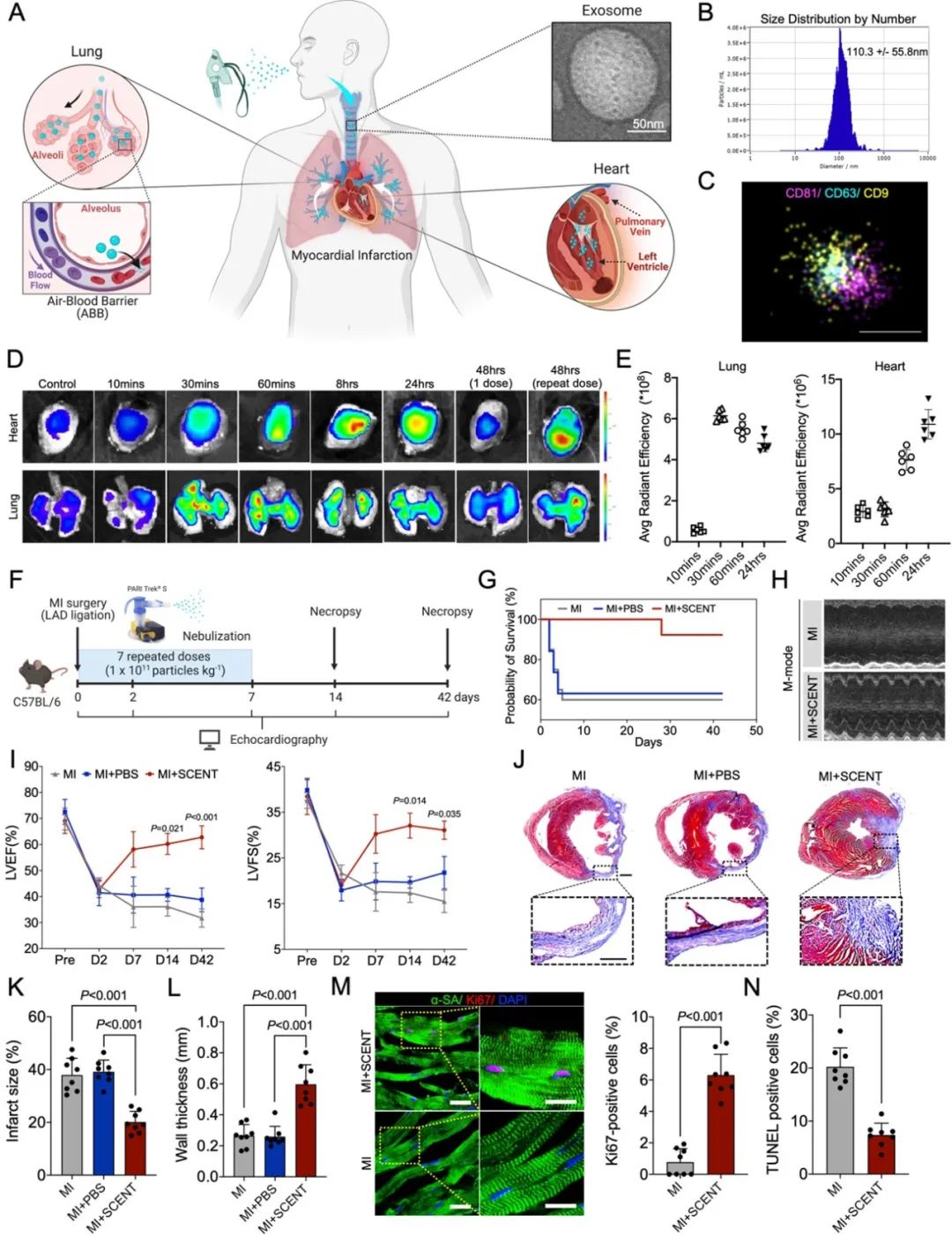
首先,研究者从干细胞中成功分离出外泌体并通过透射电镜等方法进行了分析表征。在小鼠体内,雾化吸入后的外泌体很快可以在心脏中被观察到。如果在24小时后进行重复给药,心脏中的外泌体则会进一步富集。在心肌梗死的小鼠模型中,左心室的射血功能在SCENT疗法后得到明显改善。组织学分析表明,小鼠心肌的梗死面积显著减小,且左心室壁的厚度增加。免疫荧光染色表明,心肌细胞在治疗后展现出了明显的增殖活动。这些结果都证实了SCENT疗法在小鼠心梗模型中的可行性和有效性。
随后,为了探究SCENT疗法的分子机制,研究者对治疗后的小鼠心脏与对照组心脏进行了单细胞RNA测序分析。测序结果不仅证实了小鼠的心脏重塑过程,更是揭示了治疗后受影响最显著的细胞类群为内皮细胞群。
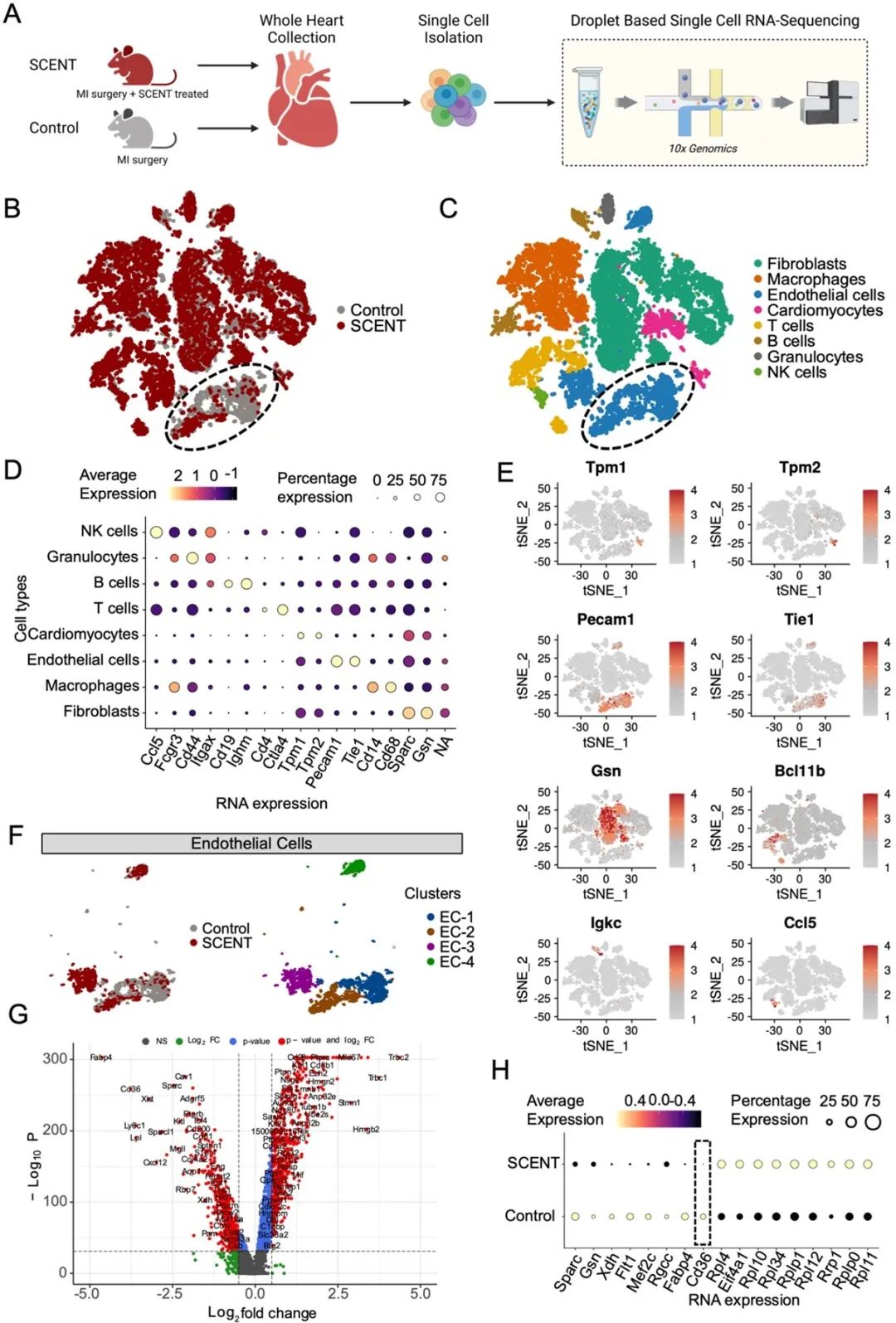
在接下来的实验中,研究者们为了进行更深层的探索,对内皮细胞群的基因表达进行了分析,并发现了CD36基因的表达在治疗后明显降低。通过更多的量化分析和免疫染色,该研究进一步证实了内皮细胞CD36的表达变化:即心梗后出现显著上升,治疗后恢复接近正常值。
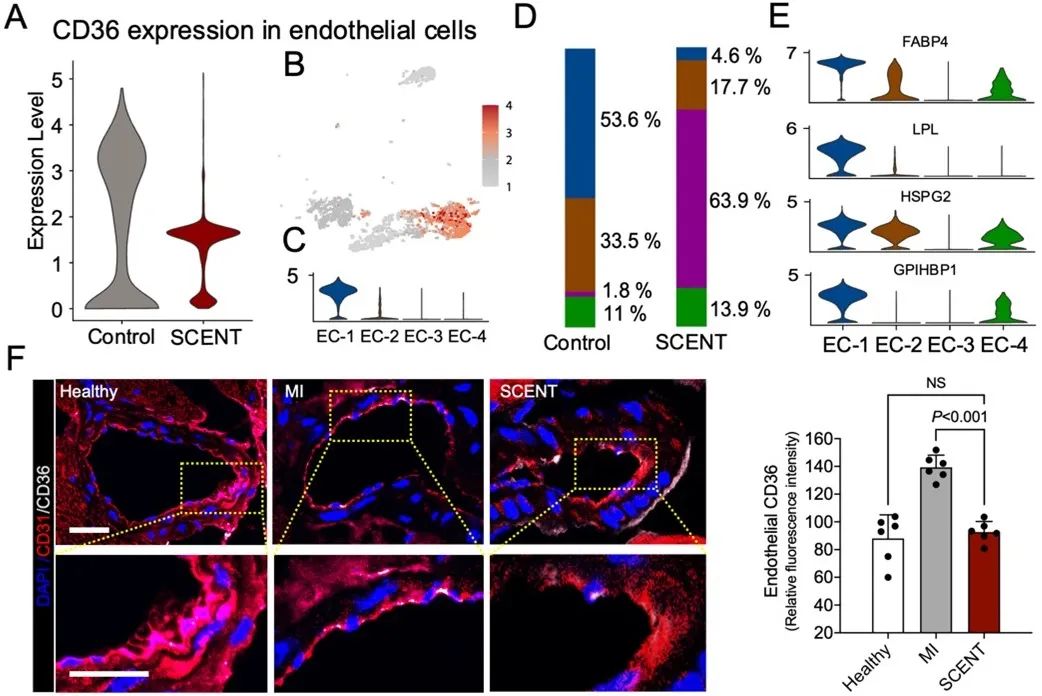
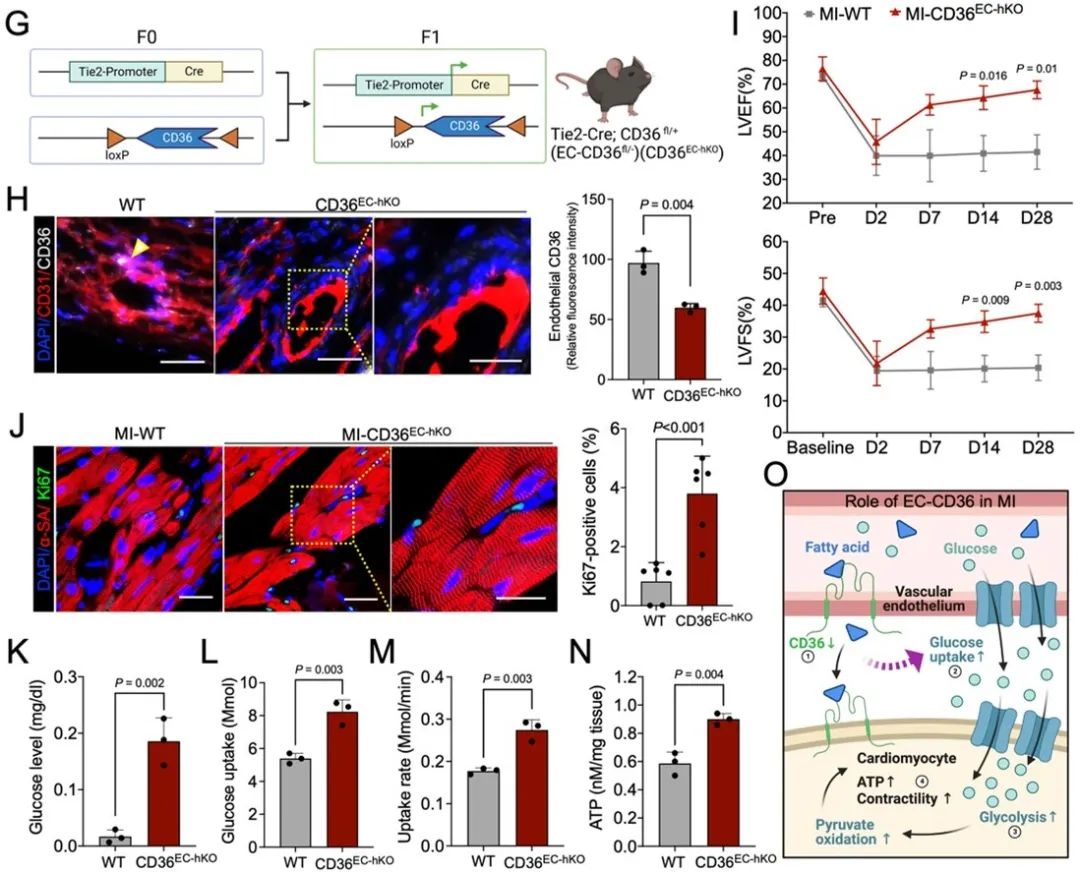
为了进一步阐释CD36在心肌保护中的原理,研究者构建了内皮细胞特异性CD36基因敲除小鼠模型,并观察到内皮细胞CD36的低表达可以有效保护心肌功能。因为CD36蛋白的主要功能是控制脂肪酸摄取,研究者随后对心脏代谢进行了一系列的量化分析。分析结果表明,内皮CD36的表达降低会导致心脏从血液中摄取脂肪酸的减少。这一变化又引起葡萄糖摄取的代偿性增加,并产生更多ATP,从而促进心肌恢复。
同时,研究者们还利用大动物模型和临床3D磁共振成像技术对SCENT疗法的转化潜力进行探索。在猪的心梗再灌注损伤模型中,接受外泌体雾化治疗的心脏在28天后梗死面积显著减小,左心室射血能力也有了明显的提高。研究者还对该疗法在动物体内的安全性进行了评估,以佐证其临床转化潜力。
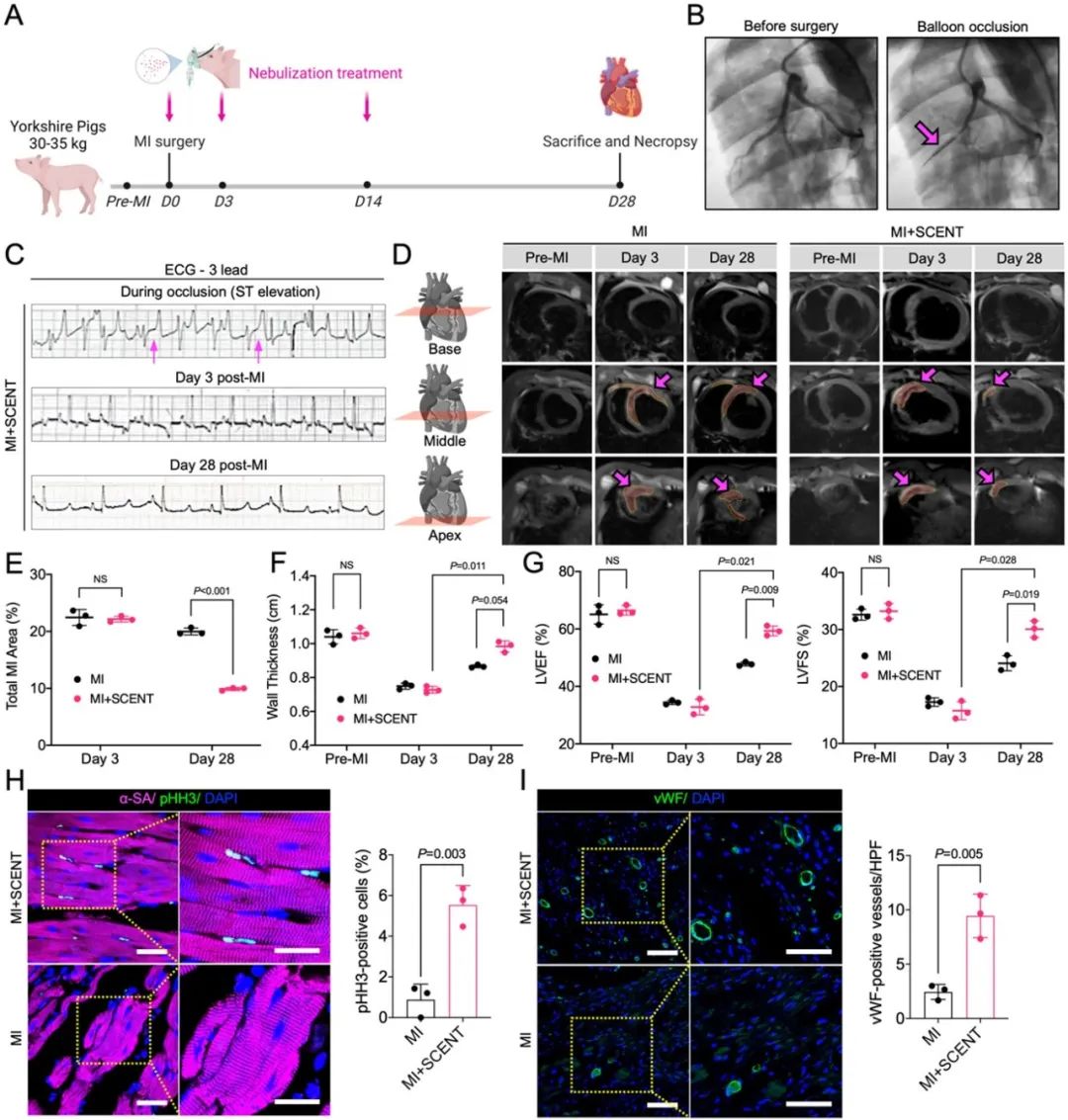
综上所述,SCENT作为首例运用外泌体吸入递送治疗心脏损伤的研究,在小鼠和猪模型中都表现出了稳定的可行性、有效性和安全性。结合单细胞RNA测序技术,研究者们揭示了外泌体治疗背后的新机制:即吸入后的外泌体通过血液循环从肺部进入心脏,进而被心脏里的血管内皮细胞摄取。摄取外泌体后的内皮细胞会出现CD36基因表达的降低,并因此减少心肌组织对脂肪酸的利用,进而引起葡萄糖的代偿性摄取及代谢。这种能量代谢的转换会直接促进梗死后的心肌重塑,改善心脏功能。此外,文章也对外泌体内的关键miRNA成分做出了探究和阐释。可吸入的外泌体疗法为心梗患者提供了一种无创且简便的给药途径,便于患者在缺血性损伤后更快、更方便的接受心肌保护,从而避免心脏的进一步衰竭。同时,CD36有望成为心脏缺血性损伤的新治疗靶点。
北卡大学教堂山分校生物医学工程系李俊朗博士和加州大学旧金山分校孙圣桓博士为本文共同第一作者;哥伦比亚大学程柯教授为本文的通讯作者。
原文链接:
https://doi.org/10.1161/CIRCULATIONAHA.123.065005


