论著|伴有焦虑症状双相抑郁患者认知功能损害与GRIN2B基因启动子区DNA甲基化相关性研究
时间:2024-09-01 06:01:46 热度:37.1℃ 作者:网络
摘 要
目的 探索伴有焦虑症状双相抑郁患者认知功能与N-甲基-D-天冬氨酸受体2B亚基(glutamate ionotropic receptor NMDA type subunit 2B,GRIN2B)基因启动子区各CpG位点甲基化水平的相关性。
方法 根据汉密尔顿焦虑量表(14-item Hamilton anxiety rating scale, HAMA)评分将31例双相抑郁患者分为焦虑组15例和非焦虑组16例,同期选取16名健康对照。采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)、数值广度测验(digital span test,DST)、连线测试A部分(trail making test A,TMT-A)、斯特鲁普色词测验(Stroop color and word test,SCWT)评估3组总体认知功能、注意力及执行控制、信息处理速度、执行功能等认知功能维度,采用Massarray质谱法检测所有受试者外周血GRIN2B基因启动子区各CpG位点的DNA甲基化水平。
结果 3组GRIN2B基因启动子区DNA甲基化水平差异性位点为CpG3、CpG5、CpG7、CpG10、CpG12(P<0.05),其中,焦虑组CpG12甲基化水平低于非焦虑组(36.23%±16.41% vs. 50.20%±19.79%,P<0.05)。偏相关分析显示,焦虑组患者中较差的命名能力与GRIN2B基因CpG4低甲基化水平相关(r=0.670,P=0.034),较差的执行功能与CpG6低甲基化水平相关(r=0.926,P<0.001),较差的注意力与GRIN2B基因CpG8高甲基化水平相关(r=-0.810,P=0.025),较差的言语记忆与CpG9高甲基化水平相关(r=-0.810,P<0.001),较差的抽象能力与CpG10高甲基化水平相关(r=-0.756,P=0.011)。
结论 GRIN2B基因启动子区DNA甲基化水平与伴有焦虑症状双相抑郁患者认知功能损害可能有关联,与双相抑郁患者焦虑症状的产生也可能有关联。
关键词 DNA甲基化;双相障碍;抑郁发作;认知功能;焦虑症状;N-甲基-D-天冬氨酸受体2B亚基
双相抑郁患者存在严重精神残疾和自杀风险[1]。认知功能损害作为双相障碍(bipolar disorder,BD)患者的核心特征之一,可削弱BD患者情绪控制能力,导致疾病反复发作并使预后不良[2-3]。在BD患者中,高达45%会共病焦虑障碍[4],而共病也可导致认知功能损害[5],并且增加物质依赖及自杀风险[6],同时损害BD患者的社会功能和生活质量[7]。此外,焦虑症状被认为是BD高危人群早期干预的有用靶点[8]。认知功能损害和共病焦虑障碍是BD发生发展的关键因素,其背后机制尚不明确。DNA甲基化作为最稳定的表观遗传方式,参与BD的病理生理及治疗机制[9-10]。有研究发现,N-甲基-D-天冬氨酸受体2B亚基(glutamate ionotropic receptor NMDA type subunit 2B,GRIN2B)基因甲基化介导产生认知功能损害及焦虑症状[11-12]。因此,本研究采用Massarray质谱法分析伴有焦虑症状双相抑郁患者外周血GRIN2B基因启动子区域CpG位点的甲基化水平与认知功能的关系,为临床诊疗提供理论基础并发掘潜在治疗靶点。
1 对象与方法
1.1 研究对象 本研究为病例对照研究。选取2022年12月至2023年12月就诊于新疆自治区人民医院门诊和住院的双相抑郁患者。纳入标准:①符合《精神障碍诊断与统计手册第五版》(Diagnostic and Statistical Manual of Mental Disorders,5th Edition,DSM-5)双相障碍的诊断标准;②由2位精神科副主任医师明确诊断;③年龄18~55岁,右利手,性别、民族不限;④24项汉密尔顿抑郁量表(24-item Hamilton depression scale 24,HAMD-24)总分>20分且杨氏躁狂量表(Young mania rating scale,YMRS)评分<7分[13];⑤具有初中及以上文化,能完成认知功能评估。排除标准:①有严重或慢性躯体疾病史;②有智力残疾;③患有其他精神障碍;④存在药物、酒精或者其他精神活性物质滥用、依赖者;⑤妊娠或哺乳期妇女;⑥过去6个月接受过电休克、精神科药物及系统心理治疗。共纳入31例双相抑郁患者。根据14项汉密尔顿焦虑量表(14-item Hamilton anxiety scale, HAMA)评分将其分为焦虑组(HAMA评分≥14分,n=15)和非焦虑组(HAMA评分<14分,n=16)[14]。
同期招募医院职工及新疆医科大学学生作为对照组。纳入标准:①由精神科副主任医师评估无精神疾病及家族史;②具有初中及以上文化,能完成认知功能评估;③年龄18~55岁,性别、民族不限。排除标准同患者组。共纳入健康对照16名。
本研究通过新疆维吾尔自治区人民医院伦理委员会审核批准(伦理批号:KY2023020968)。所有研究对象自愿参与本研究,本人或其法定监护人签署知情同意书。
1.2 研究方法
1.2.1 一般信息及临床资料收集 收集所有受试者的年龄、性别、民族、受教育年限、体质指数(body mass index,BMI),以及患者的发病年龄、病程、HAMD-24评分、YMRS评分。
1.2.2 认知功能评估 总体认知功能采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)[15]进行评估,该量表包括视空间与执行功能、命名、语言、抽象、记忆、注意、定向等认知功能维度,将各个维度的得分相加即为总分,总分30分。注意力及执行控制评估使用数值广度测验(digital span test,DST)[16],该测验分为顺背(DST-F)和倒背(DST-B)两部分,最后正确背出数字的分数相加即为得分。信息处理速度采用连线测试A部分(trail making test A,TMT-A)[17]进行评估,结果取总完成时间。执行功能采用斯特鲁普色词测验(Stroop color and word test,SCWT)[18]评估,该测验分为词语、颜色及色词三部分,分别记录这三部分正确读出的个数,其中较好代表执行功能的为色词部分。由经过统一培训的精神科医师在安静的心理测评室对所有受试对象进行以上认知功能评估。
1.2.3 DNA甲基化测定 采用Massarray飞行时间质谱法[19]检测GRIN2B基因启动子区CpG位点的甲基化水平。①抽取受试者外周静脉血5 mL左右放入EDTA抗凝管(BD公司,美国),使用溶液法DNA提取试剂盒(武汉君诺德生物技术有限公司)提取全基因组DNA,质检后置于-80 ℃保存备用。②采用Agena EpiDesigner程序(http://www.epidesigner.com)对靶向序列进行引物方案设计,由新疆欧意生物科技有限公司合成。正向引物序列5'-aggaagagag TTGATTTATGGAAAATATAGTAAGGGTT-3',反向引物序列3'-cagtaatacgactcactatagggagaaggct TCTAAATTTAAATCTCACACTCAAAAA-5'。引物序列PCR预实验的产物经电泳检测成功后行DNA甲基化测定。③用EZ DNA Methylation-GoldTM Kit试剂盒(Zymo Research,美国)对DNA进行亚硫酸氢钠修饰与纯化,行PCR反应富集扩增,然后进行虾碱性磷酸酶消化反应、转录酶切反应及树脂纯化,采用Agena NanodispenserRS1000点样仪(Axygen,美国)将树脂纯化后的产物移至384-well SpectroCHIP® bioarray (Axygen,美国)芯片上进行点样。点样后的SpectroCHIP芯片使用MassARRAY Analyzer 4.0质谱仪(Axygen,美国)进行基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)分析得出质谱图。通过Epityper1.2软件(Sequenom,美国)获得质谱甲基化水平。共检测GRIN2B基因启动子区位于1259~1755 bp长497 bp的12个CpG位点的甲基化水平。
1.3 统计学方法 使用SPSS 27.0对数据进行统计分析。年龄、受教育年限、发病年龄、症状量表评分、认知功能部分评分、CpG(3、6、7)甲基化水平不符合正态分布,采用M(QL,QU)描述,组间比较采用Mann-Whitney U或Kruskal-Wallis H检验(结果经过Bonferroni校正)。BMI、病程、SWCT颜色及色词、CpG(1、2、4、5、8、9、10、11、12)甲基化水平符合正态分布,采用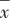 ±s描述,组间比较采用独立样本t检验或单因素方差分析(事后比较采用Bonferroni法或Tamhane’T2法)。性别、民族采用频数(构成比)描述,组间比较采用Fisher确切概率法。以年龄、性别、受教育年限、民族、BMI为协变量,采用偏相关分析伴有焦虑症状双相抑郁患者GRIN2B启动子区CpG位点甲基化水平与认知功能的相关性。检验水准α=0.05,双侧检验。
±s描述,组间比较采用独立样本t检验或单因素方差分析(事后比较采用Bonferroni法或Tamhane’T2法)。性别、民族采用频数(构成比)描述,组间比较采用Fisher确切概率法。以年龄、性别、受教育年限、民族、BMI为协变量,采用偏相关分析伴有焦虑症状双相抑郁患者GRIN2B启动子区CpG位点甲基化水平与认知功能的相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 一般信息及临床资料 3组间性别、年龄、受教育年限、BMI比较差异无统计学意义(P>0.05),焦虑组与非焦虑组发病年龄、病程、HAMD-24评分、YMRS评分比较差异无统计学意义(P>0.05)。见表1。
表1 3组间一般信息及临床资料比较Tab.1 Comparison of general and clinical data among the three groups
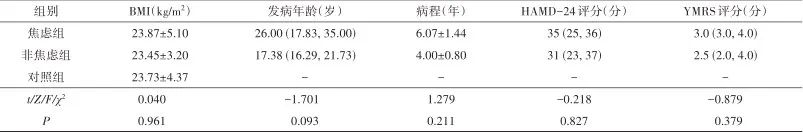
注:BMI,体质指数;HAMD-24,24项汉密尔顿抑郁量表;YMRS,杨氏躁狂量表。性别、民族采用频数(构成比)描述;年龄、受教育年限、发病年龄、HAMD-24、YMRS不符合正态分布,采用M(QL,QU)描述;BMI、病程符合正态分布,采用 ±s描述。
±s描述。
2.2 认知功能 3组间MoCA评分、DST评分、TMT-A时间、SWCT个数差异存在统计学意义(P<0.01)。两两比较显示:焦虑组和非焦虑组在MoCA总分及MoCA维度中视空间与执行功能、记忆、注意、语言、定向得分低于对照组(P<0.05),两组DST-F、TMT-A、SWCT得分低于对照组(P<0.05);焦虑组MoCA命名及抽象得分、DST-B结果低于对照组(P<0.01);焦虑组与非焦虑组间差异无统计学意义(P>0.05)。见表2。
表2 3组间认知功能比较Tab.2 Comparison of cognitive function among the three groups
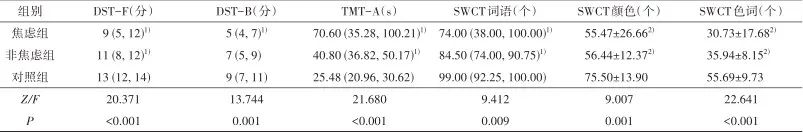
注:MoCA,蒙特利尔认知评估量表;DST-F,数值广度测验顺背;DST-B,数值广度测验倒背;TMT-A,连线测试A部分;SWCT,斯特鲁普色词测验。MoCA得分、DST得分、TMT时间、SWCT词语不符合正态分布,采用M(QL,QU)描述;SWCT颜色及色词符合正态分布,采用 ±s描述。1)与对照组比较,经Kruskal-Wallis H检验,两两比较Bonferroni校正,P<0.05;2)与对照组比较,经单因素方差分析,两两比较Tamhane’T2检验,P<0.05。
±s描述。1)与对照组比较,经Kruskal-Wallis H检验,两两比较Bonferroni校正,P<0.05;2)与对照组比较,经单因素方差分析,两两比较Tamhane’T2检验,P<0.05。
2.3 GRIN2B启动子区CpG位点甲基化率 3组间GRIN2B基因甲基化水平差异化CpG位点为CpG3、CpG5、CpG7、CpG10、CpG12(P<0.05)。两两比较显示:焦虑组与非焦虑组CpG10甲基化率高于对照组(P<0.01),CpG12甲基化率低于对照组(P<0.05);焦虑组CpG5甲基化率高于对照组(P<0.01),CpG7甲基化率低于对照组(P<0.01),且CpG12甲基化率低于非焦虑组(P<0.05);非焦虑组CpG3甲基化率高于对照组(P<0.05)。见表3。
表3 3组间GRIN2B基因启动子区DNA甲基化水平比较Tab.3 Comparison of DNA methylation levels in the promoter region of GRIN2B gene between the three groups
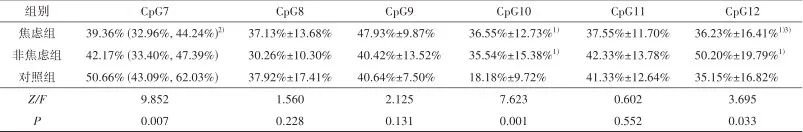
注:CpG(1、2、4、5、8、9、10、11、12)符合正态分布,采用 ±s描述;CpG(3、6、7)不符合正态分布,采用M(QL,QU)描述。1)与对照组比较,经单因素方差分析,两两比较Bonferroni检验,P<0.05;2)与对照组比较,经Kruskal-Wallis H检验,两两比较Bonferroni校正,P<0.05;3)与非焦虑组比较,经单因素方差分析,两两比较Bonferroni检验,P<0.05。
±s描述;CpG(3、6、7)不符合正态分布,采用M(QL,QU)描述。1)与对照组比较,经单因素方差分析,两两比较Bonferroni检验,P<0.05;2)与对照组比较,经Kruskal-Wallis H检验,两两比较Bonferroni校正,P<0.05;3)与非焦虑组比较,经单因素方差分析,两两比较Bonferroni检验,P<0.05。
2.4 焦虑组认知功能与GRIN2B基因CpG位点甲基化水平的相关性 控制年龄、性别、受教育年限、民族、BMI,偏相关分析显示,焦虑组MoCA命名分与GRIN2B基因CpG4甲基化水平呈正相关(r=0.670,P=0.034),SWCT色词个数与CpG6甲基化水平呈正相关(r=0.926,P<0.001),MoCA注意分与CpG8甲基化水平呈负相关(r=-0.810,P=0.025),MoCA语言分与CpG9甲基化水平呈负相关(r=-0.810,P<0.001),MoCA抽象分与CpG10甲基化水平呈负相关(r=-0.756,P=0.011)。
3 讨论
N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)对于突触可塑性和记忆形成至关重要,编码NMDAR 2B亚基的GRIN2B基因过表达可诱导长时程增强并使突触功效增强,从而与更好的认知功能有关[20-21]。近期研究表明[22],BD患者在背外侧前额叶、扣带前回和海马皮质的NMDAR活性降低,且主要致病基因为GRIN2B基因。
本研究发现伴不伴焦虑症状双相抑郁患者与健康对照GRIN2B基因启动子区差异化CpG位点为CpG3、CpG5、CpG7、CpG10、CpG12。既往一项动物实验表明海马的NR2B亚基的活性降低有助于诱导小鼠的躁狂样行为[23],本研究结果与其基本一致。其次,上述研究结果也印证了GRIN2B基因是研究BD发病的候选基因之一,与BD联系紧密[24-25]。YAN等[12]研究在高脂肪饮食的小鼠中观察到焦虑样行为及认知功能损害与Grin2b基因启动子区5个CpG位点的甲基化水平升高有关。本研究同样在焦虑组与非焦虑组双相抑郁患者发现了甲基化水平差异性GRIN2B基因启动子区位点CpG12。正如章帆[26]的研究,敲低大鼠海马及前额叶皮质Grin2b基因可诱导大鼠产生焦虑样行为。本研究也发现GRIN2B基因启动子区部分CpG位点甲基化水平与认知功能有关,例如位点CpG6与执行功能呈强正相关,这与在精神分裂症患者所观察到GRIN2B基因启动子区特定片段CpG4甲基化水平和智商之间存在正相关类似[27]。然而,本研究观察到GRIN2B基因部分CpG位点甲基化水平与认知功能呈负相关,主要表现在注意力、抽象及语言能力。这与先前研究并不矛盾。XU等[28]测定了接受实验性剖腹手术小鼠海马组织6号染色体Grin2b启动子周围的3个CpG岛共18个CpG位点,发现其均呈现不同程度DNA甲基化水平的升高,并与老年小鼠围手术期神经认知障碍有关,ENGDAHL等[29]也发现产前双酚F暴露儿童GRIN2B基因上游CpG岛甲基化水平与认知功能呈负相关。GRIN2B基因甲基化水平升高会直接阻碍转录过程,导致基因表达下降;而GRIN2B甲基化降低可使转录因子一般转录因子Ⅲ结合部分位点,发挥转录抑制因子活性作用,导致基因表达下调[27],这与所选基因序列有关。总之,双相抑郁患者由于环境因素刺激导致GRIN2B基因启动子区CpG位点甲基化水平异常变化,可能进一步介导焦虑症状及认知功能损害的产生。
本研究通过精准度较高的Massarray法首次探讨双相抑郁患者认知功能与GRIN2B基因启动子区DNA甲基化水平的相关性,发现潜在CpG位点。然而本研究仍有一定的局限性:首先,由于检测费用较高导致样本量较少,以及民族构成差异使结果可能存在偏倚;其次,DNA甲基化水平在中枢神经与外周组织分布不同,无法使用外周血完全代替脑组织;此外,本研究没有关于GRIN2B基因表达的数据来分析基因表达和DNA甲基化之间的可能相关性。未来研究可通过更大样本量,增加基因表达的检测,进一步深入探索。
参考文献:
1. BERK M, BERK L, DAVEY C G, et al. Treatment of bipolar depression[J]. Med J Aust, 2013, 199(S6): S32-S35.
2. LIMA I, PECKHAM A D, JOHNSON S L. Cognitive deficits in bipolar disorders: Implications for emotion[J]. Clin Psychol Rev, 2018, 59: 126-136.
3. RIBERA C, VIDAL-RUBIO S L, ROMEU-CLIMENT J E, et al. Cognitive impairment and consumption of mental healthcare resources in outpatients with bipolar disorder[J]. J Psychiatr Res, 2021, 138: 535-540.
4. PAVLOVA B, PERLIS R H, ALDA M, et al. Lifetime prevalence of anxiety disorders in people with bipolar disorder: A systematic review and meta-analysis[J]. Lancet Psychiatry, 2015, 2(8): 710-717.
5. HUANG C C, CHANG Y H, WANG T Y, et al. Effects of mood episodes and comorbid anxiety on neuropsychological impairment in patients with bipolar spectrum disorder[J]. Brain Behav, 2020, 10(11): e1813.
6. LOPES F L, ZHU K, PURVES K L, et al. Polygenic risk for anxiety influences anxiety comorbidity and suicidal behavior in bipolar disorder[J]. Transl Psychiatry, 2020, 10(1): 298.
7. GAMAGE N, SENANAYAKE S, KUMBUKAGE M, et al. The prevalence of anxiety and its association with the quality of life and illness severity among bipolar affective disorder patients in a developing country[J]. Asian J Psychiatr, 2020, 52: 102044.
8. BUCKLEY V, YOUNG A H, SMITH P. Child and adolescent anxiety as a risk factor for bipolar disorder: A systematic review of longitudinal studies[J]. Bipolar Disord, 2023, 25(4): 278-288.
9. NESTLER E J, PENA C J, KUNDAKOVIC M, et al. Epigenetic basis of mental illness[J]. Neuroscientist, 2016, 22(5): 447-463.
10. FRIES G R, LI Q, MCALPIN B, et al. The role of DNA methylation in the pathophysiology and treatment of bipolar disorder[J]. Neurosci Biobehav Rev, 2016, 68: 474-488.
11. 余浩, 邹韶红. N-甲基-D-天冬氨酸受体2B亚基基因遗传与认知功能损害关系的研究进展[J]. 神经疾病与精神卫生, 2023, 23(9): 676-680.
12. YAN Z, JIAO F, YAN X, et al. Maternal chronic folate supplementation ameliorates behavior disorders induced by prenatal high-fat diet through methylation alteration of BDNF and Grin2b in offspring hippocampus[J]. Mol Nutr Food Res, 2017,61(12): 1700461.
13. 魏艳艳, 尹璐, 徐海婷, 等. 中文版双相抑郁评估量表信效度及最佳界值[J]. 中国神经精神疾病杂志, 2021, 47(12): 710-715.
14. 王丞基, 曲源, 张丞, 等. 伴有焦虑症状青少年双相抑郁患者腹内侧前额叶氢质子磁共振波谱研究[J]. 中国神经精神疾病杂志, 2023, 49(10): 604-608.
15. ZHANG S F, CHEN H M, XIONG J N, et al. Comparison of cognitive impairments with lipid profiles and inflammatory biomarkers in unipolar and bipolar depression[J]. J Psychiatr Res, 2022, 150: 300-306.
16. LIU T, ZHONG S, WANG B, et al. Similar profiles of cognitive domain deficits between medication-naive patients with bipolar II depression and those with major depressive disorder[J]. J Affect Disord, 2019, 243: 55-61.
17. GUPTA R, SOOD M, SHARMA U, et al. Neurochemical correlates of cognitive functions in euthymic patients with bipolar disorder: 1H-MRS study[J]. Asian J Psychiatr, 2022, 78: 103273.
18. DALKNER N, BENGESSER S A, BIRNER A, et al. Metabolic syndrome impairs executive function in bipolar disorder[J]. Front Neurosci, 2021, 15: 717824.
19. XIU J, LI J, LIU Z, et al. Elevated BICD2 DNA methylation in blood of major depressive disorder patients and reduction of depressive-like behaviors in hippocampal Bicd2-knockdown mice[J]. Proc Natl Acad Sci U S A, 2022, 119(30): e2093000177.
20. TANG Y P, SHIMIZU E, DUBE G R, et al. Genetic enhancement of learning and memory in mice[J]. Nature, 1999, 401(6748): 63-69.
21. CAO X, CUI Z, FENG R, et al. Maintenance of superior learning and memory function in NR2B transgenic mice during ageing[J]. Eur J Neurosci, 2007, 25(6): 1815-1822.
22. WEISS F, CARUSO V, DE ROSA U, et al. The role of NMDA receptors in bipolar disorder: A systematic review[J]. Bipolar Disord, 2023, 25(8): 624-636.
23. WANG Q W, LU S Y, LIU Y N, et al. Synaptotagmin-7 deficiency induces mania-like behavioral abnormalities through attenuating GluN2B activity[J]. Proc Natl Acad Sci U S A, 2020, 117(49): 31438-31447.
24. ZHAO Q, CHE R, ZHANG Z, et al. Positive association between GRIN2B gene and bipolar disorder in the Chinese Han population[J]. Psychiatry Res, 2011, 185(1-2): 290-292.
25. AMOAH S K, RODRIGUEZ B A, LOGOTHETIS C N, et al. Exosomal secretion of a psychosis-altered miRNA that regulates glutamate receptor expression is affected by antipsychotics[J]. Neuropsychopharmacology, 2020, 45(4): 656-665.
26. 章帆. 前额叶皮层和海马NR2B对大鼠焦虑样行为的影响及其机制研究[D]. 宜昌: 三峡大学, 2023.
27. FACHIM H A, LOUREIRO C M, CORSI-ZUELLI F, et al. GRIN2B promoter methylation deficits in early-onset schizophrenia and its association with cognitive function[J]. Epigenomics, 2019, 11(4): 401-410.
28. XU F, CONG P, ZHANG B, et al. A decrease in NR2B expression mediated by DNA hypermethylation induces perioperative neurocognitive disorder in aged mice[J]. CNS Neurosci Ther, 2023, 29(5): 1229-1242.
29. ENGDAHL E, SVENSSON K, LIN P D, et al. DNA methylation at GRIN2B partially mediates the association between prenatal bisphenol F exposure and cognitive functions in 7-year-old children in the SELMA study[J]. Environ Int, 2021, 156: 106617.
【引用格式】余浩,王丞基,吴瑶,等. 伴有焦虑症状双相抑郁患者认知功能损害与GRIN2B基因启动子区DNA甲基化相关性研究[J]. 中国神经精神疾病杂志,2024,50(5):274-280.
【Cite this article】YU H,WANG C J,WU Y,et al. The correlation between cognitive impairment and DNA methylation in the GRIN2B gene promoter region in bipolar depression patients with anxiety symptom[J]. Chin J Nervous Mental Dis,2024,50(5):274-280.
DOI:10.3969/j.issn.1002-0152.2024.05.004


