【醉仁心胸】硬膜外麻醉镇痛对胸腔镜肺手术后慢性疼痛发生率的影响:回顾性队列研究
时间:2024-09-05 14:02:53 热度:37.1℃ 作者:网络
研究背景:
在胸腔镜手术(VATS)中,硬膜外阻滞常用于缓解围手术期疼痛。硬膜外麻醉对术后持续疼痛发展的影响尚不确定。本回顾性研究的目的是探讨硬膜外麻醉与接受VATS手术的患者术后慢性疼痛(CPSP)的发生之间的关系,最近,复旦大学附属中山医院麻醉科团队进行了一项回顾性队列行研究,探究硬膜外麻醉镇痛对胸腔镜肺手术手慢性疼痛发生率的影响,相关研究结果发表在《Heliyon》杂志。

研究方法:
患者群体:VATS患者894例。
测量值:术后慢性疼痛定义为术后3个月或6个月的疼痛数值评分量表(NRS)评分等于或超过1。
主要观察指标:与未接受胸椎硬膜外麻醉(TEA)的患者相比,硬膜外麻醉(EPI)组手术和住院时间较长,术中阿片类药物剂量较低。此外,与患者对照静脉镇痛(PCIA)组相比,EPI组术后急性疼痛的发生率及相关疼痛评分降低。在EPI组中,CPSP的发生率较低。
结论:
与未接受硬膜外麻醉并使用PCIA的患者相比,术中存在硬膜外麻醉和术后硬膜外自控疼痛对术后慢性疼痛的发生率有统计学意义。
镇痛方案
在本试验中,患者被分为两组。第一组称为PCIA组,术中接受静脉联合吸入麻醉,术后通过静脉自控疼痛进行疼痛管理。同时,第二组,称为硬膜外阻滞(EPI)组,在手术过程中接受静脉联合吸入麻醉,术后使用TEA和硬膜外镇痛联合控制疼痛。在PCIA组中,使用浓度为3-4μg/ml的异丙酚和持续输注2-3ng/ml的瑞芬太尼,同时使用0.6mg/kg剂量的罗库溴铵进行麻醉诱导。术中,受试者接受20-40μg舒芬太尼、1-2mg氢吗啡酮或0.5-1mg羟考酮和500mg对乙酰氨基酚治疗以维持镇痛作用。维持镇静作用包括给药浓度为0.8-1MAC的七氟醚或地氟醚。术后,使用PCIA给予舒芬太尼1μg/ml或氢吗啡酮0.04-0.05mg/ml,滴注速率为0.5-1ml/h,单次体积为3-4ml,每次剂量间隔8分钟。
在EPI组,麻醉诱导包括使用浓度为3-4μg/ml的异丙酚;持续输注2-3ng/ml的瑞芬太尼,以及0.6mg/kg的罗库溴铵。术中,参与者接受了20-40μg剂量的舒芬太尼注射。此外,为了维持镇痛效果,通过硬膜外导管以4-5ml/h的速度注射0.2%罗哌卡因。麻醉过程中由七氟醚或地氟醚维持,浓度为0.8-1MAC。术后,患者自控硬膜外镇痛泵(PCEA)中由舒芬太尼0.4 μg/ml或羟考酮8 μg/ml与罗哌卡因1.2 mg/mL混合,滴速为3 ml/h,单次剂量为3-4 ml,锁定间隔为10分钟。
实验者记录了患者术中用药情况、住院时间、取出引流管的时间。在病房,两组均采用标准化的镇痛方法,其中丙帕他莫统一静脉注射,剂量为1-2g。此外,如果患者的疼痛评分超过5,术中使用的药品、住院时间以及引流管拔除时间都已记录。在病房中,对两组患者采取了标准化的方法以确保镇痛,包括统一静脉注射丙帕卡莫尔剂量为1-2 g。此外,如果患者的(VAS)评分超过4,则给予口服氨基酚羟考酮5mg或静脉注射20毫克帕瑞昔布那20mg。
VATS分为单孔、双孔和三孔。外科医生根据特定的手术情况决定切口的大小和位置。术中信息和术后即刻疼痛数据也从手术记录中收集。
收集CPSP信息
为了收集有关患者术后疼痛的信息,我们使用电话问卷在术后3个月或6个月收集CPSP的信息,包括以下问题
1. 您目前是否有与胸部手术相关的疼痛吗?
2. 如果您对1的回答是肯定的,是否有其他潜在的原因导致你的疼痛?
3. 如果您对1的回答是肯定的,最严重的疼痛强度是多少?使用VAS评分(0 = 无痛;10 = 严重疼痛)。
在本研究中,术后3个月或6个月VAS得分≥1的患者被认为是有CPSP。
统计分析
在数据收集之前定义了主要结果变量和统计分析计划。研究的主要结果变量是术后3个月或6个月与胸部手术相关的慢性疼痛,基于以下问题:“您目前是否有与胸部手术相关的疼痛?将有胸部手术相关慢性疼痛的患者与没有此类疼痛的患者进行比较。根据Clopper和Pearson方法计算术后3个月和6个月与胸部手术相关的慢性疼痛的发生率的两侧95%可信区间(CI)。
连续数据的正态性采用夏皮罗-wilk检验和分位数-分位数图进行统计学检验。正态分布的连续变量以平均± SD表示,并采用双样本t检验进行单因素比较。当分布不正态时,给出中位数、第一(Q25)和第三四分位数(Q75),并使用Wilcoxon秩和检验对两组进行比较。分类数据以频率和百分比表示,并在适当时使用卡方检验或Fisher精确检验进行统计学检验。那些在3个月和6个月时对电话采访有任何反应的受试者被纳入分析。没有计算出缺失的数据点。重复测量的分析采用具有非结构化协方差结构的混合效应模型进行。单变量和多变量的统计分析采用最小绝对收缩和选择算子(套索)逻辑回归分析。将模型与套索方法进行了比较.
结果
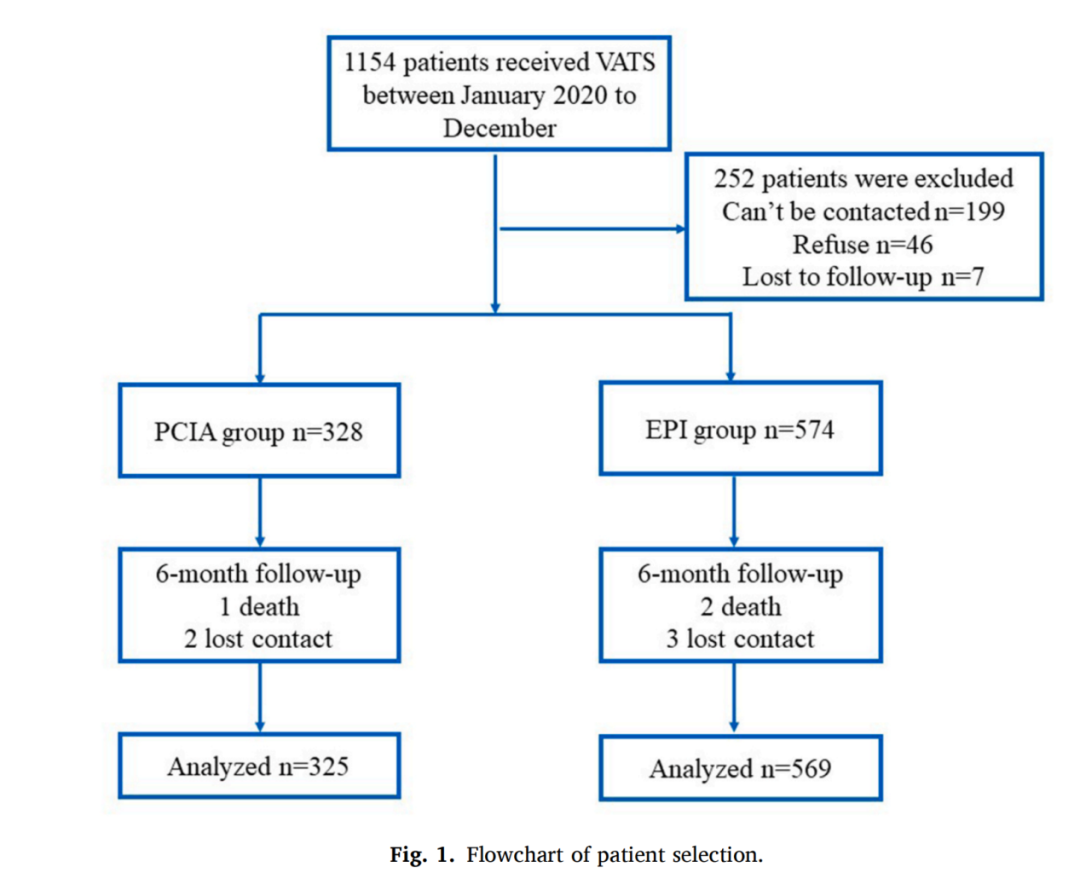
根据上述筛查标准,共对2020年1月至2022年2月在上海复旦大学中山医院接受VATS治疗的1154人进行了评估。其中,有203人无法进行随访,57人拒绝参与研究。最终,894例患者在3个月和6个月时完成了随访访谈,其中325例属于PCIA组,569例属于EPI组。
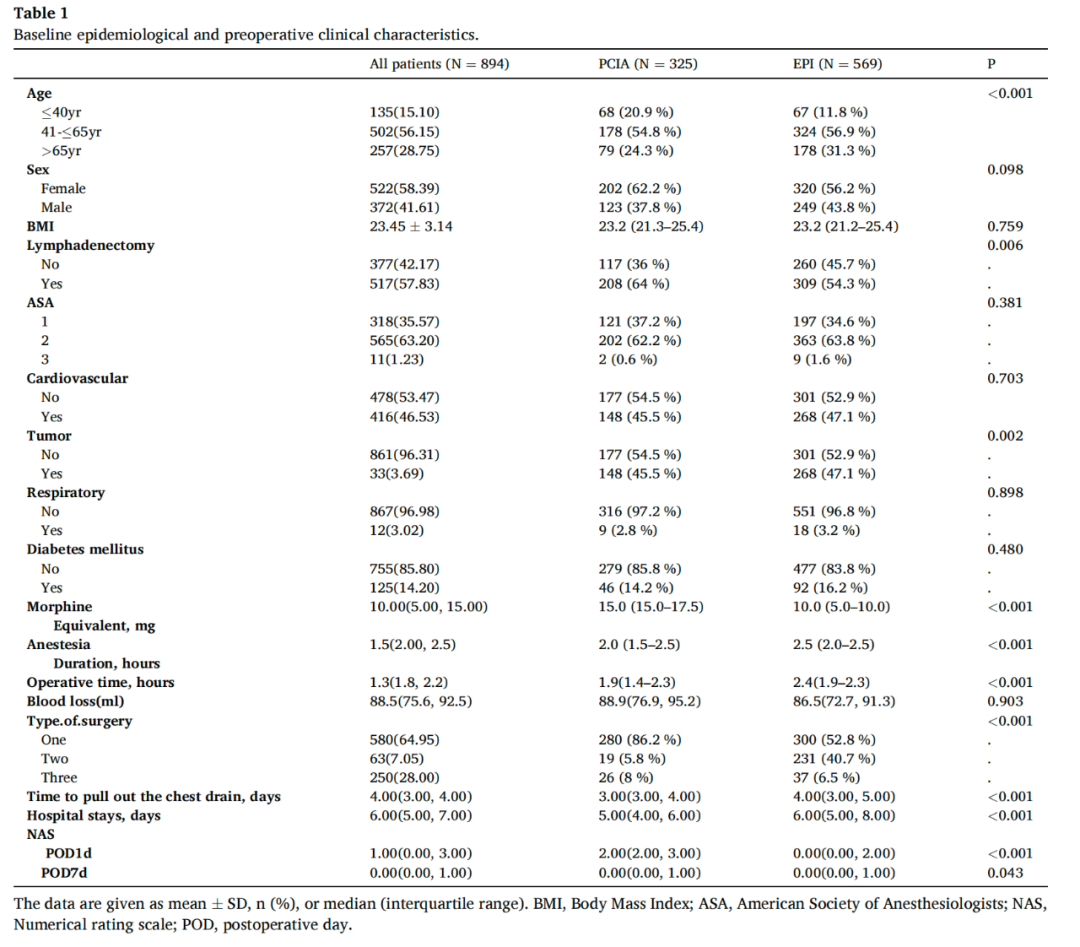
表1总结了患者的特点和围手术期参数。值得注意的是,与EPI组相比,PCIA组的年龄相对较年轻,女性患者比例更高,术中吗啡使用率更高,手术时间更短。在PCIA组中,更多的患者接受了单孔切口入路,住院时间更短,胸腔引流管留置时间更短。
急性和慢性疼痛-EPIvs PCIA
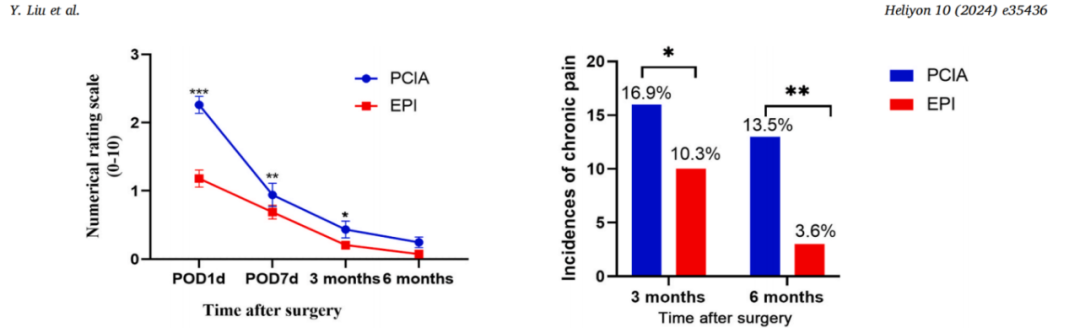
图2中绘制了所有患者在术后急性期和慢性期的总体(VAS)得分,从术后第一天到术后6个月,分别针对EPI和PCIA组。EPI组的平均VAS得分在术后第一天(POD 1)、POD 7和3个月时均低于PCIA组,而在6个月后两组之间没有显著差异。PCIA组在术后3个月和6个月的慢性疼痛发生率分别为16.9%(55/325,95% CI:9.3–32.7%)和13.5%(44/325,95% CI:8.7–33.4%)。EPI组在术后3个月和6个月的慢性疼痛发生率分别为10.3%(59/569,95% CI:8.1–30.5%)和3.6%(21/569,95% CI:3.5–21.5%)。EPI组的慢性疼痛发生率在3个月(P = 0.0048)和6个月(P < 0.005)时均显著低于PCIA组。
慢性疼痛相关VATS
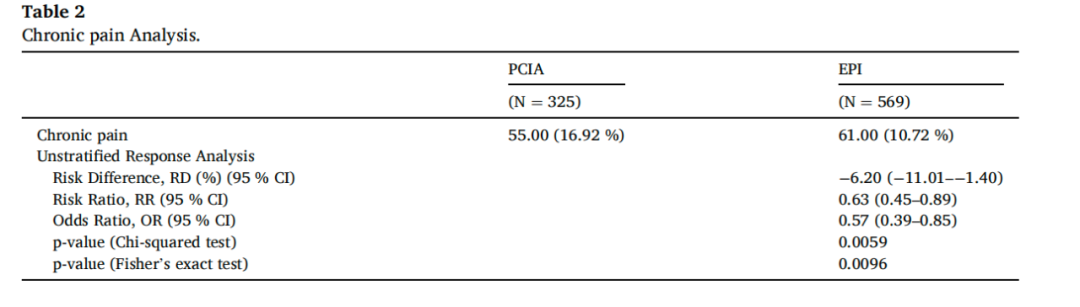
表二比较了PCIA组和EPI组之间的慢性疼痛发生率。在PCIA组的325例患者中,有55人(16.92%)报告了持续的疼痛在他们的手术疤痕周围(VAS得分≥1),占总组的16.92%。相比之下,在EPI组中,569人中有61人经历了慢性疼痛,占该组的10.72%。在进行未分层反应分析时,相对差异(RD)%计算为-6.20,相对风险(RR)为0.63,优势比(OR)为0.57。卡方检验得出的P值为0.0059,而Fisher确切检验得出的P值为0.0096。关于ASA评分和潜在疾病的存在,如心血管疾病、呼吸系统疾病和糖尿病,两组之间没有观察到统计学上的显著差异。
使用LASSO变量的逻辑回归分析进一步检查了CPSP的发生率(表3)
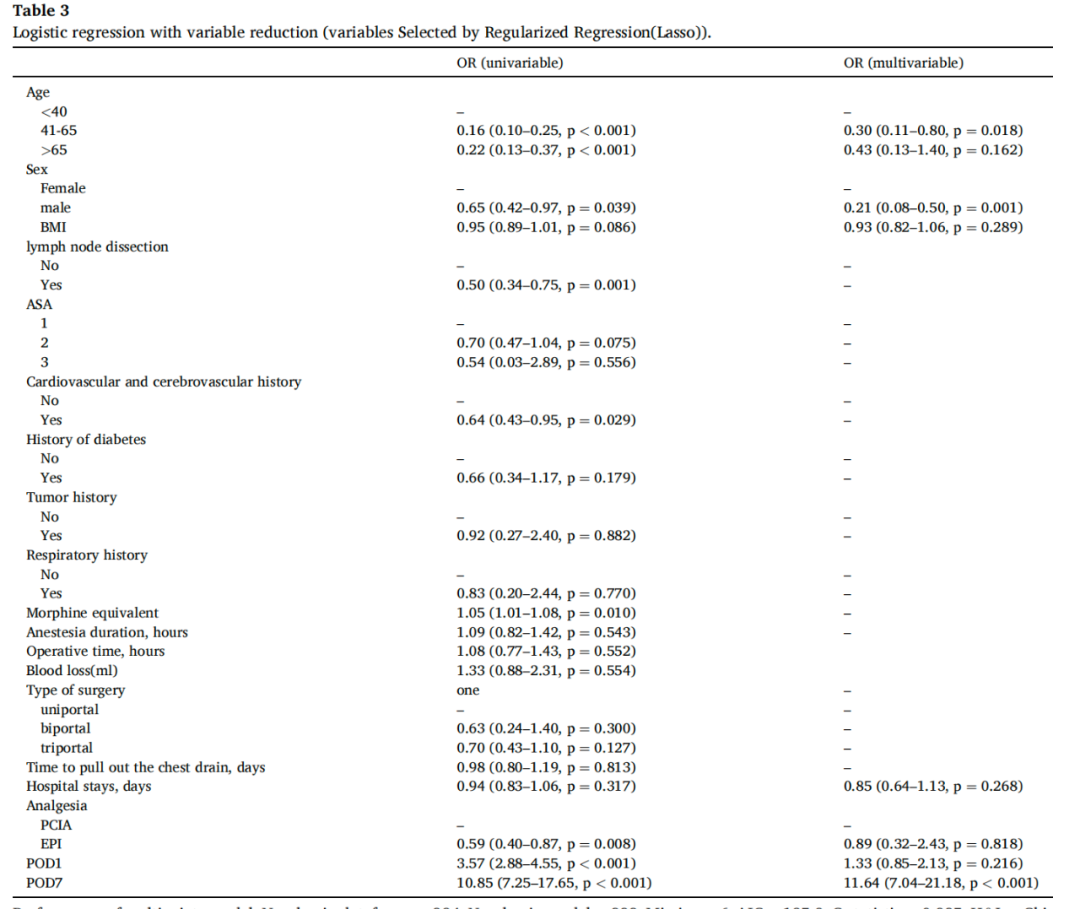
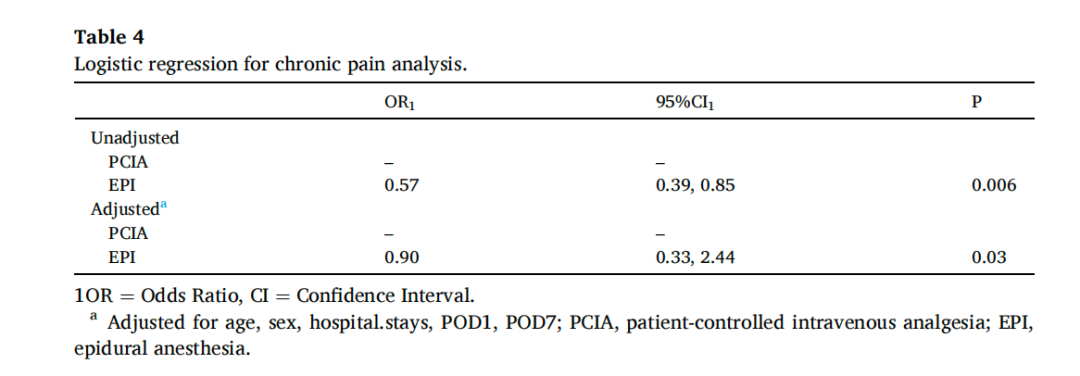
年龄、性别、体重指数(BMI)、住院时间、与术后急性疼痛,慢性疼痛有关。在调整了年龄、性别、BMI、住院时间、术后第一天的VAS(VAS1)和VAS3后,OR为0.90(95% CI:0.33–2.44;P = 0.03;表4)。
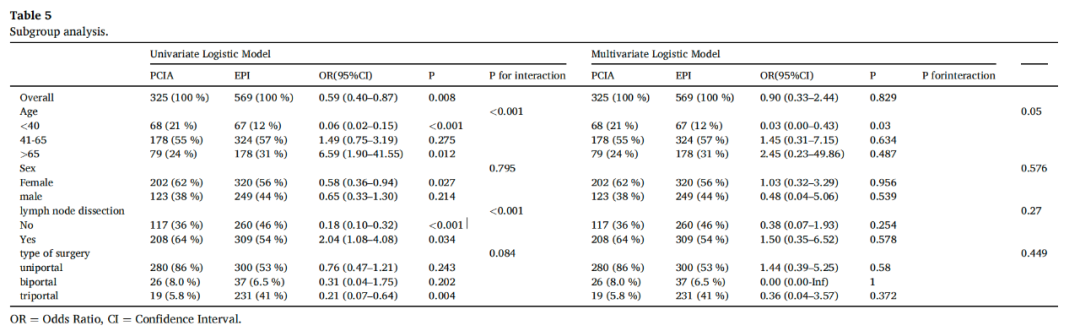
单变量分析显示年龄和淋巴结清扫与慢性疼痛有关,淋巴结清扫和年龄较大的患者慢性疼痛的发生率较高,而多变量分析结果表明慢性疼痛仅与PCIA和EPI组的年龄有关(表5)。为了更深入地了解这些因素在两组之间的变化,我们进行了亚组分析。亚组交互作用在年龄和淋巴结清扫方面具有统计学意义。然而,在调整了年龄、性别、BMI、住院时间、VAS1和VAS3后,没有亚组交互作用在统计学上显著。
讨论
CPSP在胸外科手术后很常见,可能会在术后长时间持续存在。即使采用创伤较小的VATS,CPSP的发生率仍然很高。考虑到术后疼痛的有效管理可以降低CPSP的发生率,以及TEA的优越镇痛效果,我们调查了TEA是否能降低VATS后CPSP的发生率。结果表明,与PCIA相比,TEA显著降低了VATS后CPSP的发生率。
术后急性疼痛是CPSP的一个风险因素,CPSP的发生率和严重程度与术后急性疼痛呈正相关。这也解释了为什么本研究中EPI组的整体CPSP发生率以及急性疼痛的发生率都低于PCIA组。然而,单变量分析显示VAS1和VAS3与3个月和6个月的慢性疼痛无关,表明单一的急性术后疼痛发作可能无法预测CPSP。先前研究[表明,CPSP的几个风险因素包括人口统计学特征、遗传易感性、并发症、与手术相关的疼痛和心理因素。然而,本研究的回顾性设计限制了对某些因素的分析,例如缺乏患者的心理因素。因此,我们将EPI组CPSP较低的发生率至少部分归因于TEA的非镇痛效应,包括减轻围手术期应激反应、抗缺血效应、对胃肠功能的影响,以及对凝血系统和术后炎症反应的相关影响。
根据先前的研究,CPSP被定义为患者在手术部位(VAS得分≥1)确定与手术相关的疼痛。在本研究中,没有患者在术后3个月和6个月报告记录到中度或重度疼痛(VAS得分≥4)。在术后3个月,PCIA组和EPI组分别有16.92%和10.72%的患者出现慢性疼痛,但整体CPSP的发生率低于先前研究的报告。这种差异可能归因于两组中大量的单孔VATS病例,尤其是PCIA组,因为临床医生更倾向于为接受单孔手术的患者使用全身麻醉。显然,与单孔方法相关的疼痛强度低于双孔和三孔方法。尽管EPI组中双孔和三孔病例的比例更高,但由于TEA的有效疼痛管理,EPI组的平均疼痛得分仍然低于PCIA组。
TEA在胸外科手术患者中的严重并发症包括硬膜外血肿(0.034%)和硬膜外脓肿(0.068%)。在VATS患者中,EPI组的恶心和呕吐发生率也据报道远高于对照组。TEA最常见的副作用是低血压、尿潴留和瘙痒,穿刺失败的发生率为7%。然而,在本回顾性研究的EPI组中,没有记录到硬膜外血肿或脓肿的病例,这可能归因于研究设计和本研究主要目的的限制。
神经阻滞镇痛技术已被推荐用于胸外科手术病例,如胸椎旁阻滞、筋膜平面阻滞、前锯肌阻滞和肋间神经阻滞。有报道称,连续胸椎旁阻滞(TPVB)技术在开胸手术患者中可以实现与连续TEA相似的急性疼痛缓解。一项研究表明,与静脉镇痛结合的单次TPVB相比,连续TEA在开胸手术后显著降低了3个月和12个月的CPSP发生率,并提供了更好的急性疼痛缓解。另一项随机研究表明,与连续TEA相比,至少有中等程度胸痛的患者数量在6个月时较低,但不确定性水平很高。与VATS相关的连续镇痛方法,胸椎旁间隙导管化不能取代连续硬膜外镇痛,在单次手动推注TPVB后,由于重力作用,大量的局部麻醉药可以缓慢地向头侧和尾侧扩散,而连续泵入局部麻醉药在胸椎旁间隙不能实现广泛阻滞,这可能与胸椎旁间隙宽且松散有关。与松散的胸椎旁空间不同,硬膜外空间相对精确且狭窄,大多数局部麻醉药都限制在这个空间内。它们的效果是准确的,并已在长期临床应用中得到证实。基于这些考虑,我们研究了VATS后连续TEA在降低CPSP发生率方面的有效性。
我们没有调查本研究中的神经病理性疼痛,因为据报道它不是VATS后慢性术后疼痛的主要组成部分。此外,单变量分析显示,接受淋巴结清扫和年龄较大的患者中慢性疼痛的发生率更高,这些可能被视为高风险病例。本研究有几个局限性。首先,目前用于评估慢性疼痛的方法并不精确。CPSP的发病机制涉及多种因素,仅依赖于主观评估,如疼痛的存在或不存在、VAS评分,可能无法全面评估CPSP。开发与疼痛具体相关的客观评估工具可能有助于标准化方法;此外,CPSP的疼痛管理主要由医院病房和门诊的胸外科医生执行。因此,很难确定疼痛的持续波动以及口服药物与CPSP之间的相关性。最后,由于回顾性研究的一般局限性,未来的前瞻性研究需要证实TEA对接受VATS患者的CPSP的影响。
综上所述,本研究结果表明,与PCIA相比,TEA显著降低了VATS术后CPSP的发生率。同样,这些结果可能证实了急性疼痛的有效管理可以降低慢性疼痛的发生率,而TEA作为区域镇痛的金标准,是VATS病例中可靠的考虑因素。
点评
尽管VATS术已普遍成熟开展,但在VATS术后仍然有很高比例的患者会经历急、慢性疼痛。作为多模式镇痛的重要基石,尽管TEA仍然是胸科手术的金标准,但已有指南推荐在VATS手术中椎旁神经阻滞、肌肉筋膜阻滞(如竖脊肌平面)作为区域阻滞的首选,本研究依然选择镇痛效果最为确切的TEA来观察其对VATS手术后慢性疼痛的影响,结果表明与PCIA相比,TEA显著降低了VATS术后慢性疼痛的发生率,为胸科麻醉实践增加了新的证据,然而该研究为回顾性研究,存在一定的数据偏倚,期待前瞻性随机对照研究来验证TEA在VATS中与慢性疼痛发生之间的关系,此外,椎旁神经阻滞、肌肉筋膜阻滞,以及目前已使用的长效局部麻醉药脂质体布比卡因应用于胸科的区域阻滞对术后慢急慢性疼痛的影响还不清楚,期待更多的研究来探索。
参考文献
Liu Y, Wang C, Ye Z, Jiang L, Miao C, Liang C. Effects of epidural anesthesia and analgesia on the incidence of chronic pain after thoracoscopic lung surgery: A retrospective cohort study. Heliyon. 2024 Jul 31;10(15):e35436. doi: 10.1016/j.heliyon.2024.e35436.
R.D. Treede, W. Rief, A. Barke, Q. Aziz, M.I. Bennett, R. Benoliel, M. Cohen, S. Evers, N.B. Finnerup, M.B. First, et al., Chronic pain as a symptom or a disease: the
IASP classification of chronic pain for the international classification of diseases (ICD-11), Pain 160 (1) (2019) 19–27.
[2] M.A. Kinney, W.M. Hooten, S.D. Cassivi, M.S. Allen, M.A. Passe, A.C. Hanson, D.R. Schroeder, C.B. Mantilla, Chronic postthoracotomy pain and health-related
quality of life, Ann. Thorac. Surg. 93 (4) (2012) 1242–1247.
[3] K. Marshall, K. McLaughlin, Pain management in thoracic surgery, Thorac. Surg. Clin. 30 (3) (2020) 339–346.
[4] S.R. Hazelrigg, I.B. Cetindag, J. Fullerton, Acute and chronic pain syndromes after thoracic surgery, Surg. Clin. 82 (4) (2002) 849–865.
[5] Z. Peng, H. Li, C. Zhang, X. Qian, Z. Feng, S. Zhu, A retrospective study of chronic post-surgical pain following thoracic surgery: prevalence, risk factors,
incidence of neuropathic component, and impact on qualify of life, PLoS One 9 (2) (2014) e90014.


