病例分享 | 伴有卵黄囊瘤样分化的SMARCB1(INI1)缺失的鼻腔鼻窦癌1例
时间:2024-09-19 23:02:25 热度:37.1℃ 作者:网络
病史介绍
女,61岁,患者因反复鼻腔出血1年,鼻塞3个月入院。
01 辅助检查
MRI及CT检查:左侧上颌窦、筛窦、鼻腔及双侧额窦占位性病变并积液,颅内未见病变累及,考虑恶性肿瘤。胸部及腹部CT检查未见明确转移灶。
患者血清学检查:甲胎蛋白1.60ng/mL(参考范围≤13.32ng/mL),绒毛膜促性腺激素0.54mIU/mL(参考范围≤3mIU/mL)。
02 大体检查
灰白色碎组织一堆,大小7cm×4cm×1cm。
03 镜下特征
低倍镜观察,肿瘤组织边界不清,浸润性生长,肿瘤细胞绝大部分呈弥漫实性片状排列,未见明确鳞状、腺样及其他分化特征,可见内陷的良性腺体(图1),局部侵犯骨质(图2),可见出血、坏死。在弥漫实性片状排列的肿瘤组织内,局部可见腺管状及筛状结构,周围间质黏液水肿状,呈卵黄囊瘤样形态(图3)。高倍镜观察,弥漫实性片状排列的肿瘤细胞形态单一,核质比增高,细胞核圆形或卵圆形,空泡状,核仁显著,胞质部分嗜酸性,部分透明(图4),肿瘤细胞核分裂象易见。卵黄囊瘤样区域的肿瘤细胞呈梭形或扁平立方状,未见核仁及核分裂象。
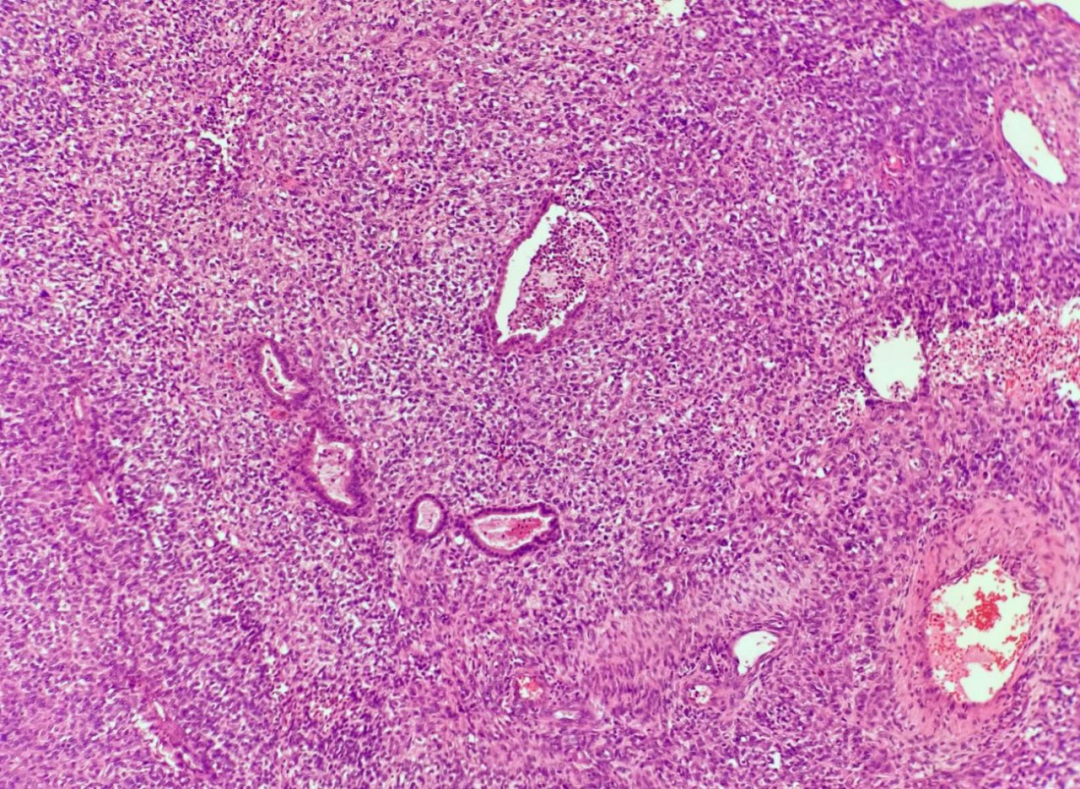
图1 肿瘤细胞绝大部分呈弥漫实性片状排列,可见内陷的良性腺体
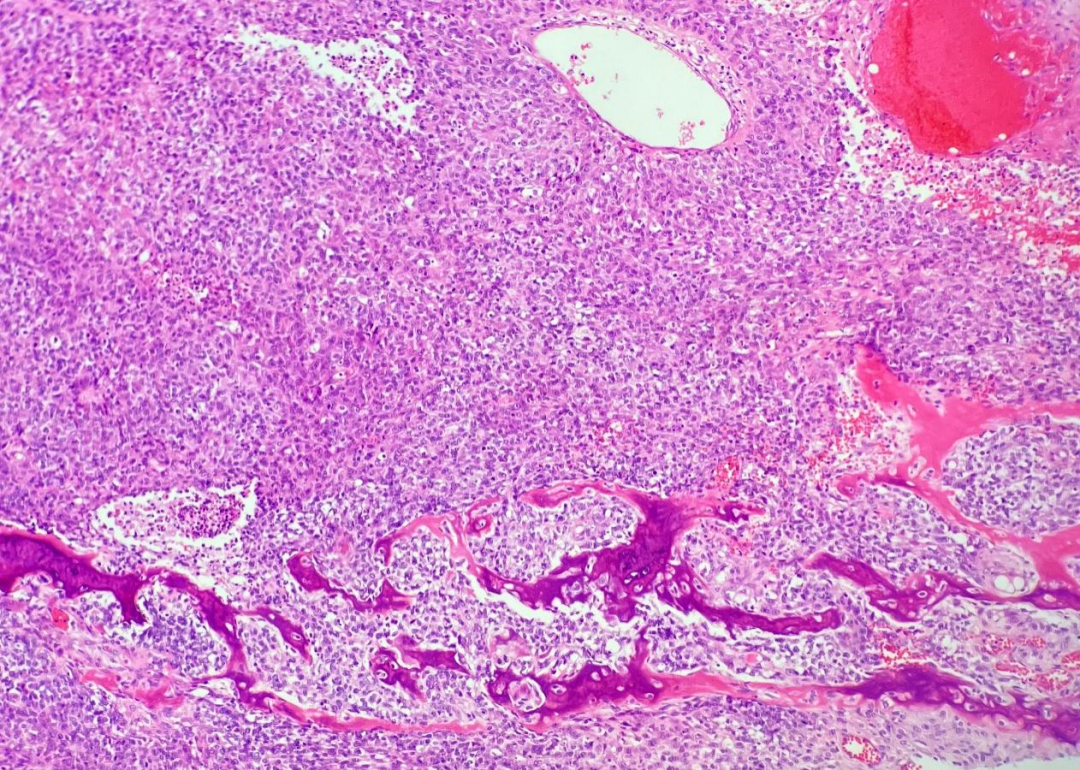
图2 肿瘤细胞局部侵犯骨质
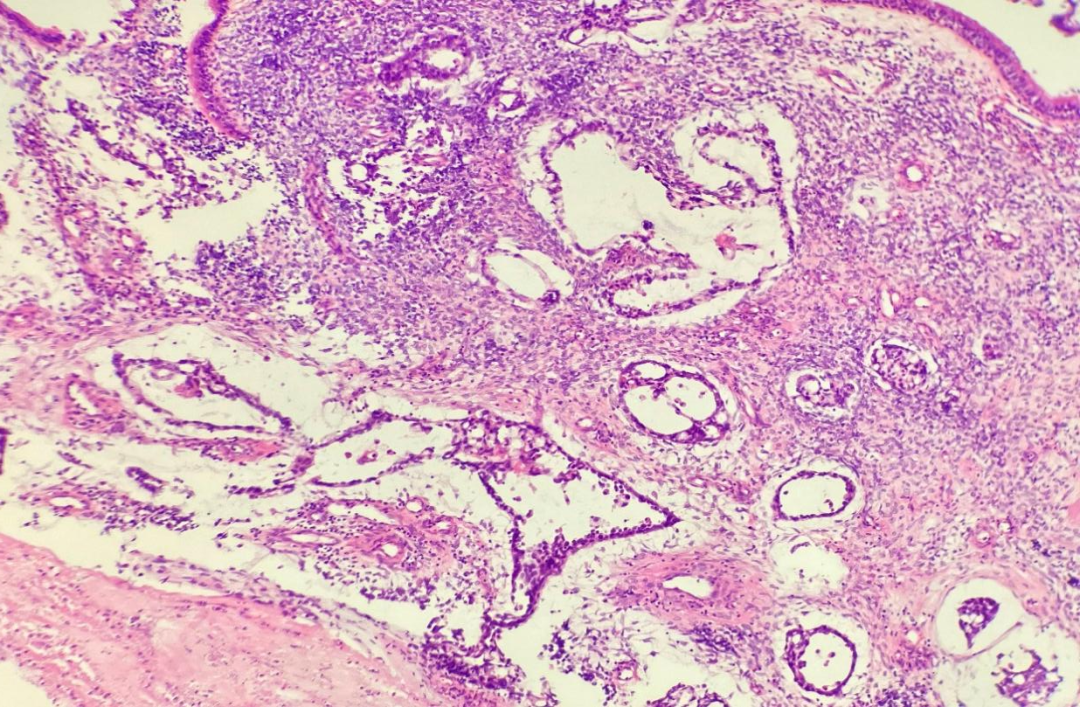
图3 在正常粘膜下,局部小灶(约4mm的区域)肿瘤组织可见腺管状及筛状结构,周围间质黏液水肿状,呈卵黄囊瘤样形态
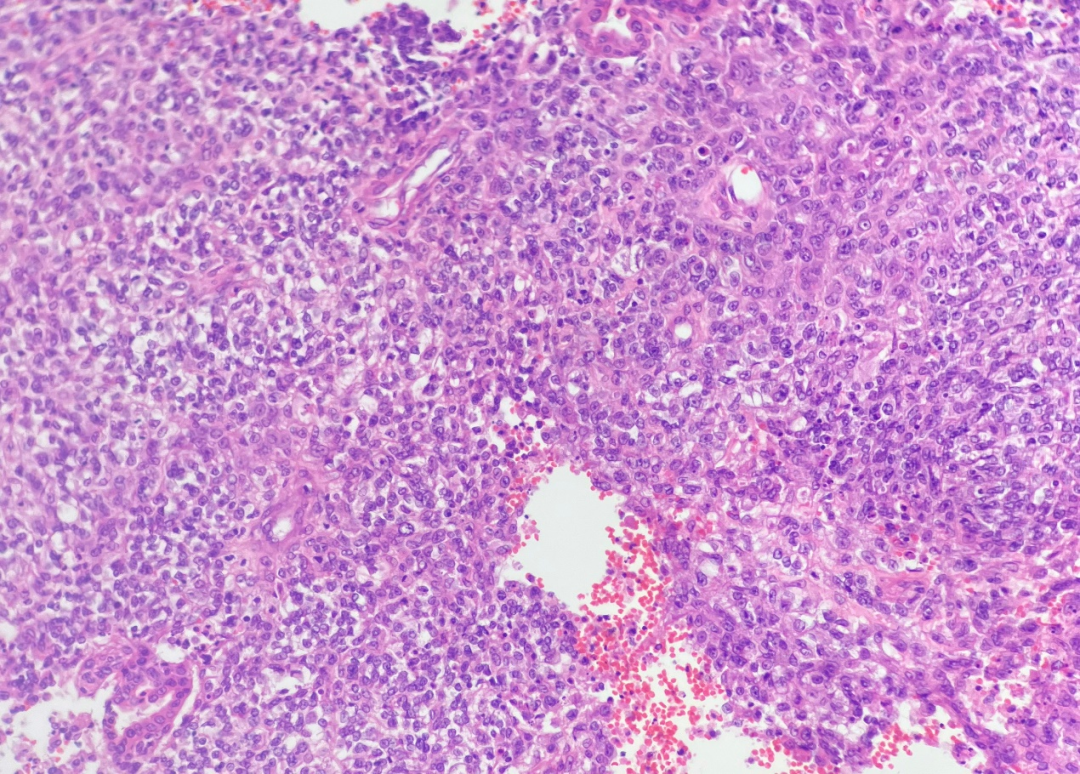
图4 肿瘤细胞形态单一,核质比增高,细胞核呈圆形或卵圆形,呈空泡状,核仁显著,胞质部分嗜酸性,部分透明
04 免疫组化结果
阳性标记:
弥漫实性片状区域:广谱角蛋白(CKpan)(图5)、CK8弥漫阳性,SALL4、突触素、CD56、Glypican-3局灶阳性;Ki67增殖指数约70%;
卵黄囊瘤样区域:甲胎蛋白、SALL4、Glypican-3、广谱角蛋白(CKpan)均阳性(图6、7),Ki67增殖指数约40%。两种区域SMARCA4均阳性。错配修复蛋白MLH1、PMS2、MSH2、MSH6均阳性,为pMMR状态。
阴性标记:胶质纤维酸性蛋白、CD30、OCT3/4、CD117、p40、S100、SOX10、HMB45及甲胎蛋白;两种区域SMARCB1(INI1)均缺失(图8、9)。PD-L1(克隆号:SP263)阴性。
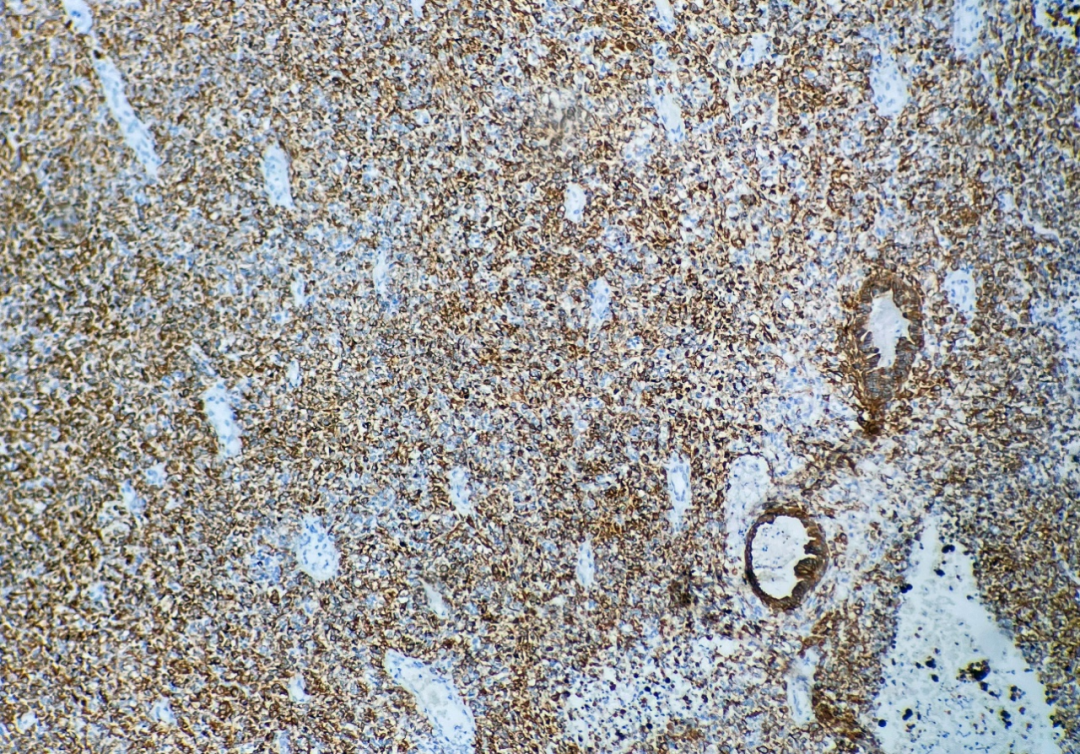
图5 肿瘤弥漫实性区广谱角蛋白(CKpan)阳性表达,EnVision法
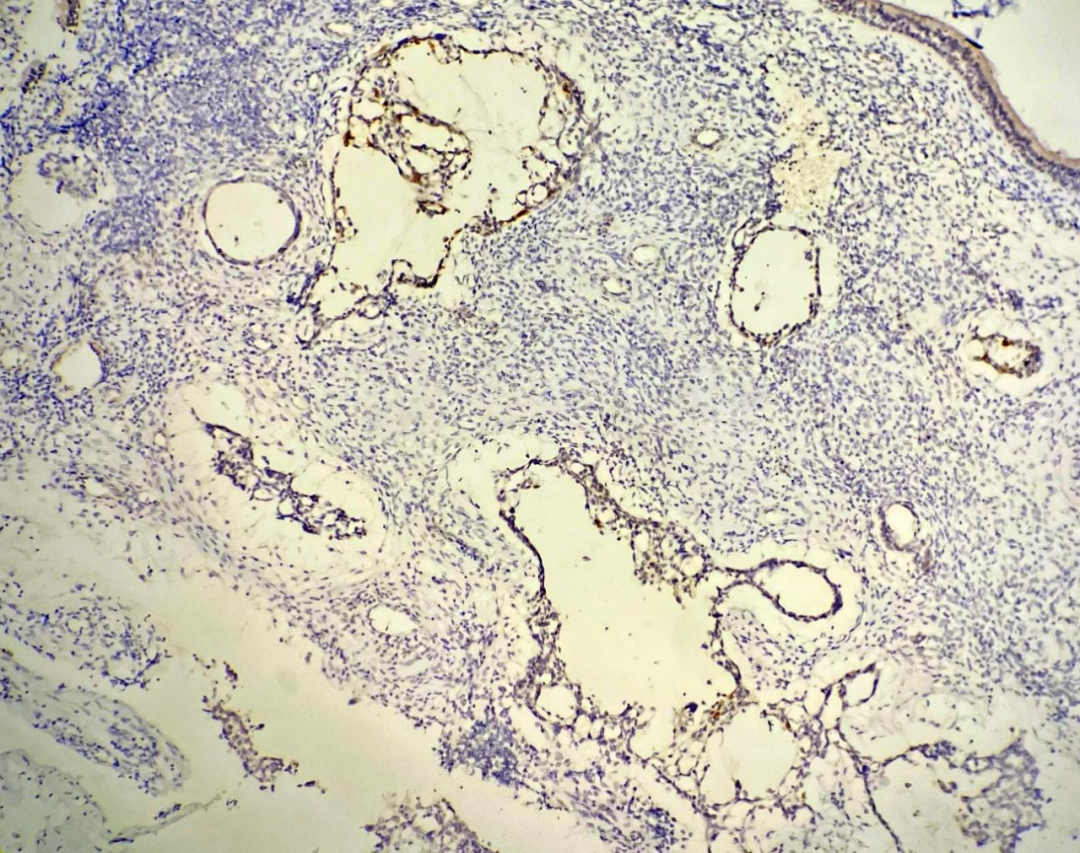
图6 肿瘤卵黄囊瘤样分化区甲胎蛋白阳性表达,EnVision法

图7 肿瘤卵黄囊瘤样分化区SALL4阳性表达,EnVision法
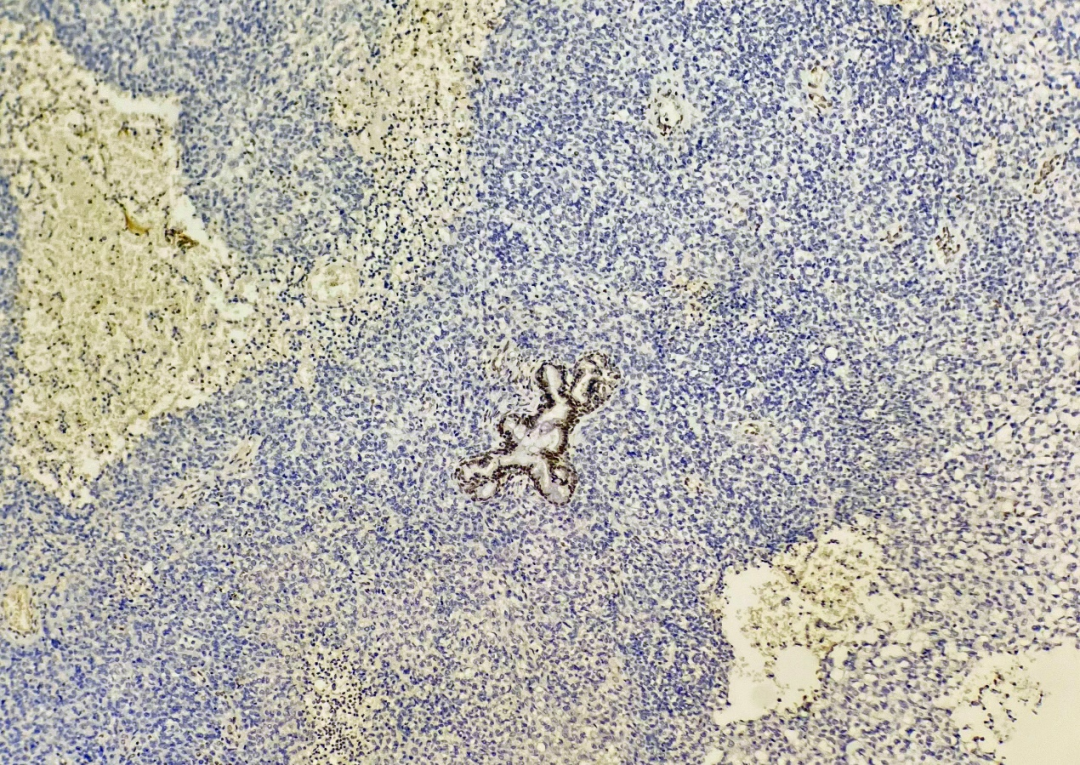
图8 肿瘤弥漫实性区SMARCB1(INI1)缺失表达,EnVision法
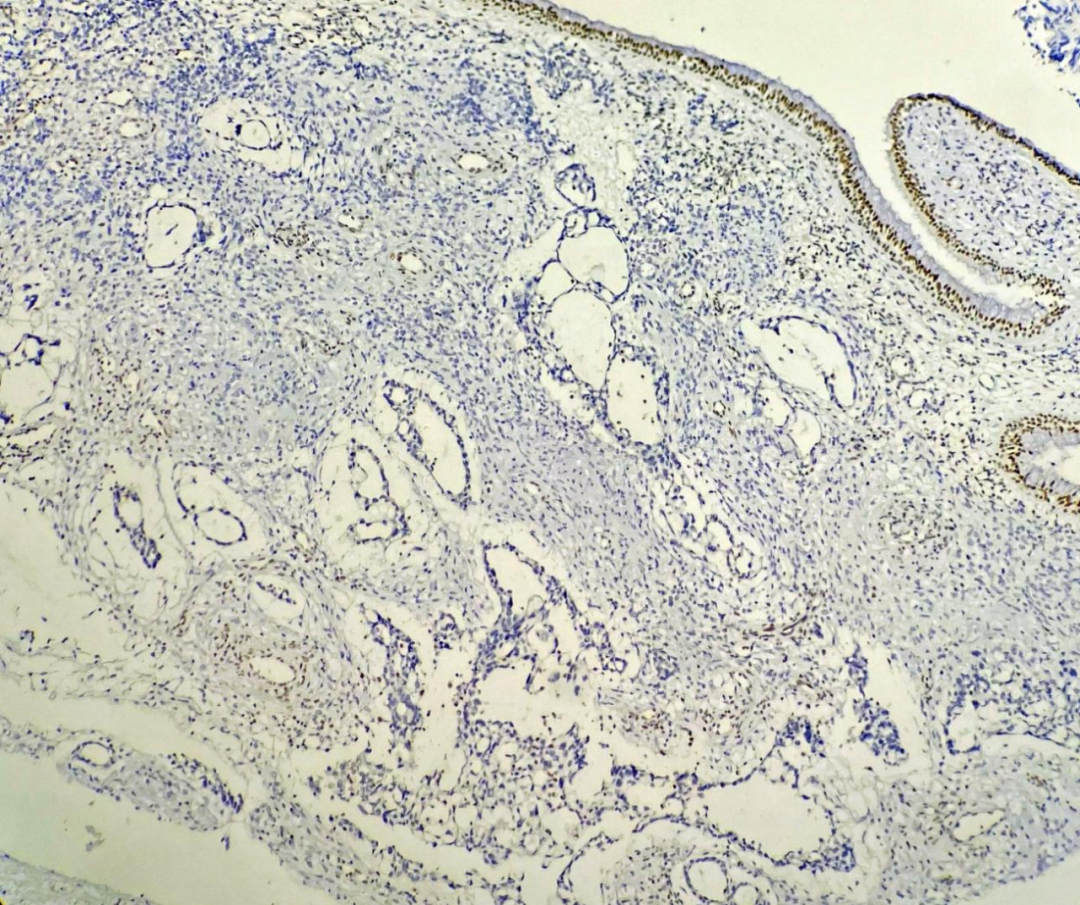
图9 肿瘤卵黄囊瘤样分化区SMARCB1(INI1)缺失表达,EnVision法
原位杂交结果:
EB病毒编码的RNA(EBER)原位杂交及HPV原位杂交均阴性。
05 病理诊断:
(鼻腔鼻窦)伴有卵黄囊瘤样分化的SMARCB1(INI1)缺失的鼻腔鼻窦癌(Sinonasal SMARCB1 (INI1) Deficient Carcinoma With Yolk Sac Tumor Differentiation,SDC-YST)。
讨 论
01 定义:
鼻腔鼻窦SMARCB1(INI1)缺失的癌(SMARCB1-deficient carcinomas,SDC)是一种缺乏SWI/SNF复合物亚基SMARCB1(INI1)的未分化上皮恶性肿瘤,没有其他类型鼻腔鼻窦癌的组织学特征可归类。SDC-YST是SDC新近报道的罕见亚型,最早由Zamecnik等于2018年首次报导。
ICD-O编码:8020/3
02 临床特征:
SDC通常发生在成年人。大多数患者表现为局部晚期(T4期),包括眼眶和颅底受累。无特异性症状(鼻塞、鼻窦炎、鼻出血和头痛),常伴有眼眶并发症。
03 大体表现:
SDC表现为弥漫浸润性生长。肿物柔软、脆弱,伴有息肉样形态,伴广泛溃疡和坏死。
04 组织学表现:
组织学上,肿瘤组织具有相对广泛的形态学谱系,最常见的组织学形态为基底细胞样和横纹肌样或浆细胞样。近年来罕见的组织学亚型被相继报道,包括腺样、乳头状、肉瘤样。SDC-YST的组织学形态多表现为未分化癌伴卵黄囊瘤样分化,也可以表现为腺癌伴卵黄囊瘤样分化,罕见情况下可表现为纯的卵黄囊瘤形态。
05 免疫表型及原位杂交:
SDC-YST的肿瘤组织SMARCB1表达缺失,表达广谱角蛋白(CKpan)等上皮标记,卵黄囊瘤样分化区域表达甲胎蛋白、SALL4及Glypican-3。有个别的研究报道这三个标记物在非卵黄囊瘤分化区域也有少量的表达。SDC-YST的EB病毒编码的RNA(EBER)原位杂交及HPV原位杂交均阴性。
06 SDC-YST中卵黄囊瘤样成分的起源问题:
关于SDC-YST中卵黄囊瘤样成分的起源问题,少数学者进行了研究,认为卵黄囊瘤样分化代表了体细胞起源性癌症的继发性“生殖细胞表型”分化。同样的结论在女性外阴伴有卵黄囊瘤样分化的SMARCB1(INI1)缺失的上皮样肉瘤中也得到了证实。目前已经报道的SDC-YST病例数较少,关于卵黄囊瘤样成分的起源问题需要收集更多的病例做进一步的研究。
07 鉴别诊断:
(1)鼻腔鼻窦原发的卵黄囊瘤:该肿瘤是一种起源于生殖细胞的恶性肿瘤,多发生于儿童,很少发生在生殖腺以外的部位,形态学上肿瘤细胞呈腺管状、微囊状及筛网状排列,一般不出现大片的未分化癌样形态,且文献报道卵黄囊瘤表达SMARCB1(INI1),可鉴别;
(2)SMARCA4缺失的畸胎癌肉瘤:在该肿瘤中,原始未分化的神经上皮成分占优势,且具有鳞状及腺样的上皮成分,SMARCA4缺失表达,本例虽然有显著内陷的鳞状上皮及腺体,但无神经上皮成分,胶质纤维酸性蛋白阴性,SMARCB1缺失表达,SMARCA4表达,可鉴别;
(3)恶性黑色素瘤:肿瘤细胞常呈弥漫片状排列,细胞形态学特征多样,可呈未分化、上皮样、梭形、浆细胞样和横纹肌样,部分病例胞质内可见黑色素,表达S100、SOX10及色素标志物,SMARCB1不缺失表达,本例免疫组化染色不表达S100、SOX10及色素标志物, SMARCB1表达缺失,可鉴别。
08 预后:
绝大部分SDC病人预后较差,文献报道约半数的病人在确诊1-102月内死于该肿瘤。SDC中卵黄囊瘤样分化成分是否影响SDC的临床病程尚不清楚。本例患者术后给与免疫治疗1周期(替雷利珠)联合化疗2周期(白蛋白结合型紫杉醇及顺铂)及放疗1周期,目前未见复发及转移。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] Thompson LDR, Franchi A. New tumor entities in the 4th edition of the World Health Organization classification of head and neck tumors: nasal cavity, paranasal sinuses and skull base[J]. Virchows Arch. 2018,472(3):315-330.
[2] Bishop JA, Antonescu CR, Westra WH. SMARCB1 (INI-1)-deficient carcinomas of the sinonasal tract[J]. Am J Surg Pathol. 2014,38(9):1282-1289.
[3] Agaimy A, Hartmann A, Antonescu CR, et al. SMARCB1 (INI-1)-deficient sinonasal carcinoma: a series of 39 cases expanding the morphologic and clinicopathologic spectrum of a recently described entity[J]. Am J Surg Pathol. 2017,41(4):458-471.
[4] 汤申隽,翟长文,袁存存,等. SMARCB1(INI1)缺失的鼻腔鼻窦癌六例临床病理学特征[J]. 中华病理学杂志,2020,49(1):47-51.
[5] Gomez-Acevedo H, Patterson JD, Sardar S, et al. SMARCB1 deficient sinonasal carcinoma metastasis to the brain with next generation sequencing data: a case report of perineural invasion progressing to leptomeningeal invasion[J]. BMC Cancer. 2019,19(1):827.
[6] Huang SC, Zhang L, Sung YS, et al. Secondary EWSR1 gene abnormalities in SMARCB1-deficient tumors with 22q11-12 regional deletions: potential pitfalls in interpreting EWSR1 FISH results[J]. Genes Chromosomes Cancer. 2016,55(10):767-776.
[7] Zamecnik M, Rychnovsky J, Syrovatka J. Sinonasal SMARCB1 (INI1) deficient carcinoma with yolk sac tumor differentiation: Report of a case and comparison with INI1 expression in gonadal germ cell tumors[J]. Int J Surg Pathol. 2018,26(3):245-249.
[8] Lee VH, Tsang RK, Lo AWI,et al.SMARCB1 (INI-1)-deficient sinonasal carcinoma: a systematic review and pooled analysis of treatment outcomes[J]. Cancers (Basel). 2022,5;14(13):3285.
[9] Li CY, Han YM, Xu K,et al. Case Report: SMARCB1 (INI-1)-deficient carcinoma of the nasal cavity with pure yolk sac tumor differentiation and elevated serum AFP levels[J]. Onco Targets Ther. 2021,29;14:2227-2233.
[10] Skálová A, Taheri T, Bradová M,et al. SMARCB1-deficient sinonasal adenocarcinoma: a rare variant of SWI/SNF-deficient malignancy often misclassified as high-grade non-intestinal-type sinonasal adenocarcinoma or myoepithelial carcinoma[J]. Virchows Arch. 2023,12.
[11] Hazir B, Şímșek B, Erdemír A,et al. Sinonasal SMARCB1 (INI1) deficient carcinoma with yolk sac tumor differentiation: a case report and treatment options[J]. Head Neck Pathol. 2022,16(2):596-601.
[12] He T, Wang Z, Su H, Li S, He Z. A novel successful case of nasal and sinus yolk sac tumor with SMARCB1 (INI-1) deficiency: a case report[J]. Cureus. 2022,10;14(11):e31320.
[13] Shah AA, Jain D, Ababneh E, et al. SMARCB1 (INI-1)-deficient adenocarcinoma of the sinonasal tract: a potentially under-recognized form of sinonasal adenocarcinoma with occasional yolk sac tumor-like features[J]. Head Neck Pathol. 2020,14(2):465-472.
[14] Hammer PM, Kolin DL, Charville GW,et al. A Subset of SMARCB1 (INI-1)-deficient vulvar neoplasms express germ cell markers[J]. Histopathology. 2022,81(3):342-351.


