KRAS G12C突变非小细胞肺癌患者的临床、病理和分子特征
时间:2024-09-21 06:00:21 热度:37.1℃ 作者:网络
KRAS G12C是非小细胞肺癌(NSCLC)中最常见的KRAS突变,近年来已开发出靶向治疗方法。从2021年7月至2023年5月在利物浦医院解剖病理科接受二代测序(NGS)的732例NSCLC病例中,研究者检索到83例(11%)连续的KRAS G12C突变NSCLC病例,并分析了其临床、病理和分子特征。
在83例KRAS G12C突变NSCLC患者中,男性46例(55%),女性37例(45%),平均年龄为72岁。在有已知临床信息的49例患者中,94%为当前吸烟者或曾经吸烟者,49%在诊断时为IV期,中位生存期为12个月。63%为组织学病例,其余为细胞学病例。82%为非黏液腺癌,常规组织学类型包括贴壁型、腺泡型、实性型、单细胞型和微乳头型,62%为低分化腺癌。黏液腺癌5例(6%),多形性癌1例,高级别胎儿腺癌1例。大多数(89%)病例的TTF1呈阳性。19例(23%)存在TP53共突变,这些病例有PD-L1高表达、低分化、临床分期为IV期的趋势,但差异无统计学意义。
KRAS G12C突变的NSCLC几乎只发生在吸烟者中,并且大多数是非粘液腺癌,具有常规的组织学模式,从分化良好到分化不良不等。大约四分之一的患者有TP53共突变,其组织学影响和免疫特征需要在更大的研究中进行评估。
研究背景
KRAS是一种膜相关鸟苷三磷酸酶,是非小细胞肺癌(NSCLC)中最常突变的致癌基因,占西方人群病例的20%。KRAS突变往往是发生在密码子12(G12)、13(G13)和61(Q61)的点突变,其频率在不同类型的人类癌症中不同。在NSCLC中,KRAS G12C(密码子12的甘氨酸被半胱氨酸取代)是最常见的突变类型,占病例的14%。
尽管NSCLC的靶向治疗在过去十年取得了进展,但KRAS突变仍被认为是“不可用药”的,由于它们对三磷酸鸟苷(GTP)的皮摩尔亲和力和细胞内GTP的丰度。与KRAS G12D和G12V不同,KRAS G12C维持非活性鸟苷二磷酸(GDP)结合形式和活性GTP结合形式之间的循环。最近,KRAS G12C的不可逆共价抑制剂,包括AMG-210(sotorasib,索托雷塞)和MRTX849(adagasib,阿达格拉西布),已被开发出来,它们与半胱氨酸12的巯基结合,并将KRAS G12C“锁定”在非活性的GDP结合状态。在2期CodeBreaK100试验中,在接受索托雷塞治疗的124例KRAS G12C突变NSCLC患者中,其中大多数既往接受过化疗和/或免疫治疗,研究者观察到46例(37.1%)达到客观缓解。100例患者(80.6%)达到了疾病控制,中位缓解持续时间为11.1个月。在3期CodeBreaK200随机对照试验中,在既往接受过治疗的晚期KRAS G12C突变NSCLC患者中,索托雷塞与标准治疗的多西他赛相比显著改善了无进展生存期(5.6个月 vs. 4.5个月)。在2期KRYSTAL-1试验中,116例既往接受过治疗的KRAS G12C突变NSCLC患者接受了阿达格拉西布治疗,客观缓解率为42.9%,中位缓解持续时间为8.5个月。FDA分别于2021年5月28日和2022年12月12日批准索托雷塞和阿达格拉西布用于治疗KRAS G12C突变NSCLC。
在本研究中,研究者分析了83例在该机构接受了二代测序(NGS)的KRAS G12C突变NSCLC患者的临床、组织学和分子特征。
研究结果
732例FFPE组织学或细胞学细胞块样本进行了NGS。其中129例(18%)有EGFR突变,包括45例(6%)L858R突变和58例(8%)外显子19缺失。有214例(29%)KRAS突变病例,其中G12C突变83例(11%),G12D突变35例(5%),G12V突变48例(7%),G12A突变13例(2%),Q61H突变12例(2%)。其他突变包括32例(4%)BRAF突变(包括13例BRAF V600E)、20例(3%)ERBB2突变和14例(2%)MET外显子14跳跃突变(图1A、B)。
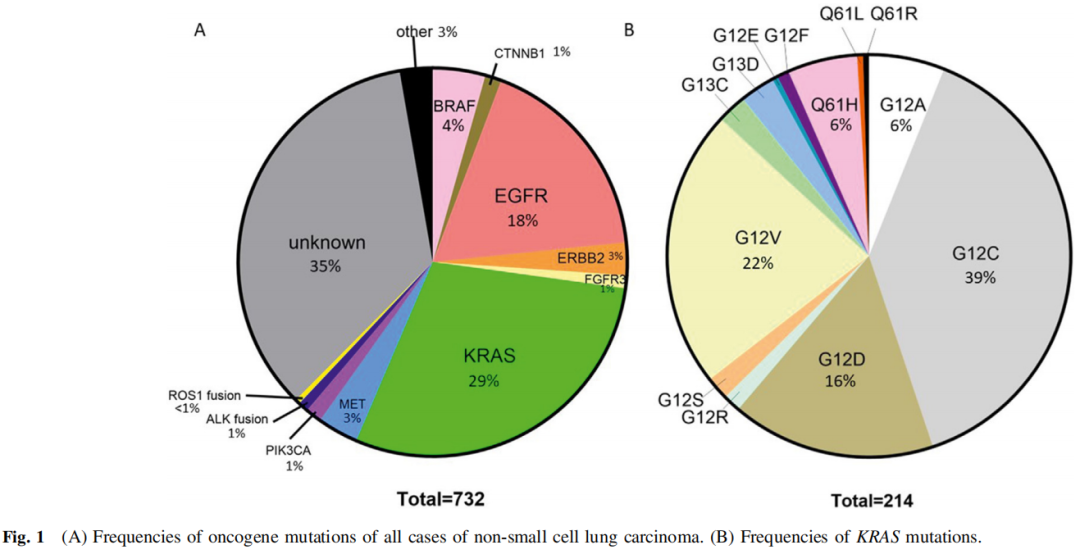
图1
临床特征(表2):
在83例KRAS G12C突变的NSCLC患者中,男性46例(55%),女性37例(45%)。平均年龄72岁。只有49例患者的完整临床细节(包括吸烟状况、分期、治疗和进展)已知,其余为外部转诊。在已知临床细节的49例患者中,16例(33%)在诊断时为I期,6例(12%)为II期,3例(6%)为III期,24例(49%)为IV期。在已知吸烟状况的47例患者中,44例(94%)为当前吸烟者或戒烟者,3例(6%)为非吸烟者。
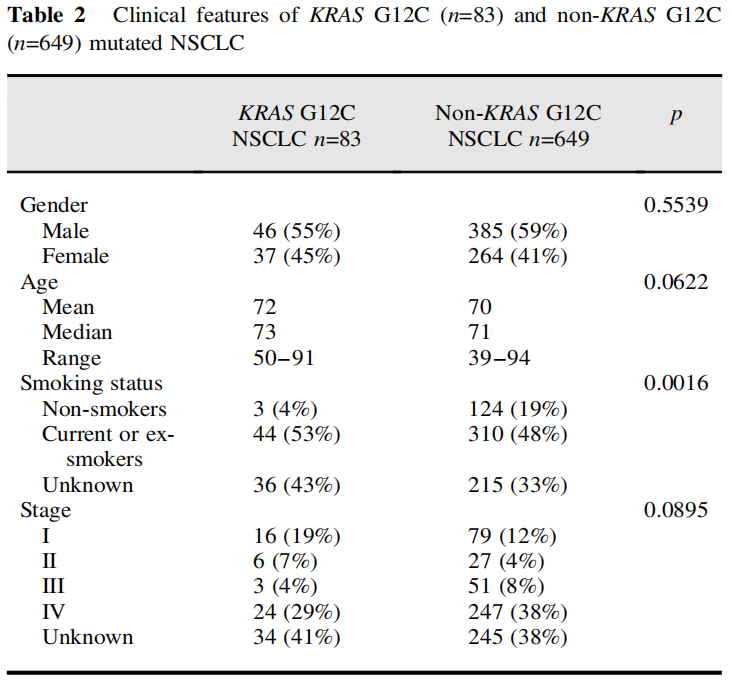
表2
与649例未携带KRAS G12C突变的NSCLC患者相比,携带KRAS G12C突变的患者更多为吸烟者(94% vs 71%,p=0.0016)。
治疗和随访:
已知48例(58%)患者的治疗和随访信息。中位随访时间为13个月。
15例I期患者中,手术切除9例,放疗5例,化疗、放疗和免疫治疗1例。9例存活无病,4例存活病情稳定,1例死于无关疾病,以及1例术后6个月发生转移,接受化疗,存活病情稳定。
在6例II期病例中,4例手术切除,1例手术加辅助化疗和免疫治疗,1例放疗。4例无病存活,1例病情稳定存活,以及1例术后6个月发生转移,经化疗和免疫治疗存活,病情稳定。
3例III期患者中,1例经新辅助化疗和手术后存活无病,1例经放疗后存活病情稳定,1例在治疗前死亡。
24例IV期患者的中位随访时间15个月。4例患者仅接受免疫治疗。1例患者接受了免疫治疗,并在13个月时疾病进展后进入MK-1084(早期KRAS G12C指导的临床试验)。3例接受了化疗和免疫治疗,5例接受了放疗、化疗和免疫治疗,3例仅接受了放疗,2例接受了放疗和免疫治疗,1例接受了放疗和化疗,1例接受了化疗和索托雷塞治疗,1例仅接受了脑转移灶减灭术,3例未接受积极治疗。13例死亡,9例带瘤生存。
IV期患者的中位生存期为12个月,而I、II和III期患者的中位生存期未达到(图2)。
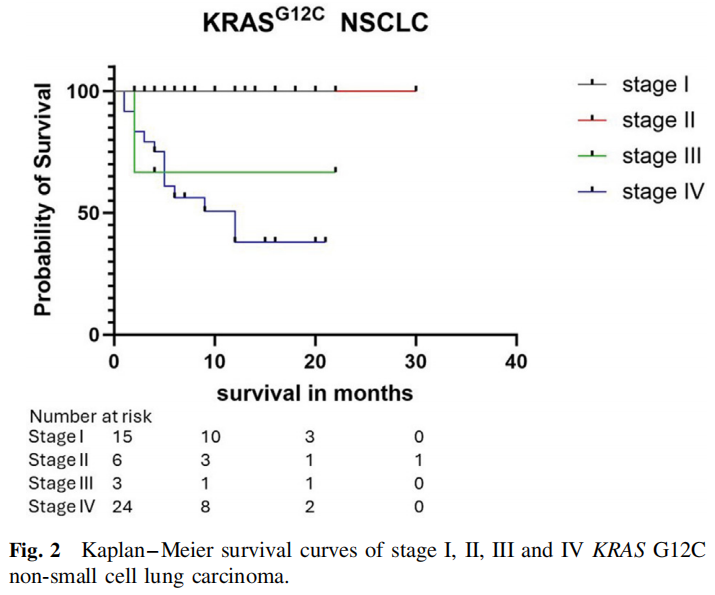
图2
组织病理学(表3、图3和4):
649例非KRAS G12C型NSCLC患者中,494例(76%)接受组织学检查,155例(24%)接受细胞学检查。其中腺癌533例(82%),黏液腺癌22例(3%),鳞状细胞癌18例(3%),腺鳞癌12例(2%),非小细胞肺癌NOS 34例(5%),多形性癌18例(3%)。
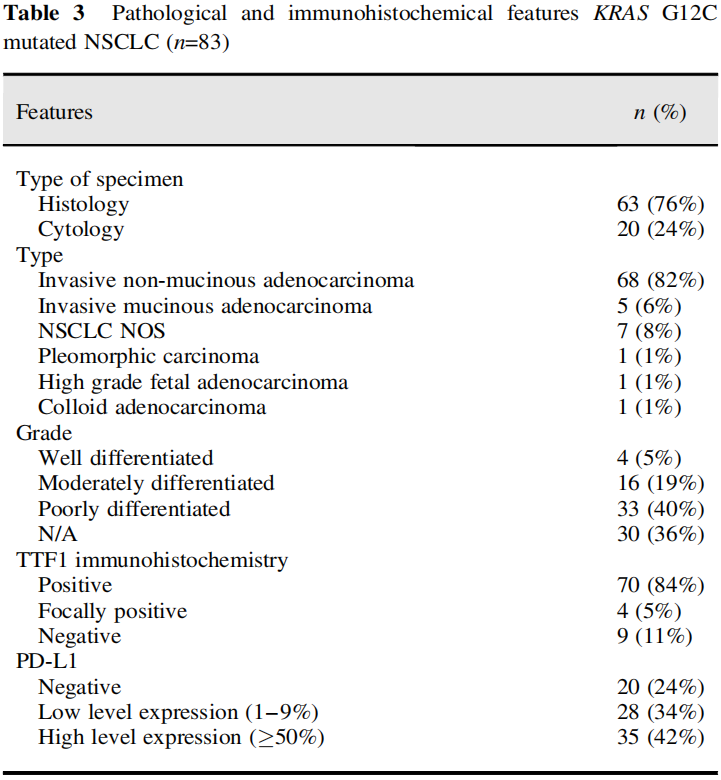
表3
在83例KRAS G12C NSCLC中,包括手术切除和活检的组织学病例63例(76%),细胞学病例20例(24%)。活检包括肺活检,以及转移部位的活检,如淋巴结、椎骨和脑。细胞学样本包括细针抽吸的纵隔淋巴结在支气管超声(EBUS)中获得,以及胸膜和心包液。
在83例病例中,68例(82%)被诊断为浸润性非黏液腺癌,5例(6%)被诊断为浸润性黏液腺癌,7例(8%)被诊断为NSCLC NOS。胶质腺癌、多形性癌、高级别胎儿腺癌各1例(图3)。多形性癌由20%的恶性梭形细胞组成,细胞角蛋白、TTF1阴性,80%的传统腺癌为细胞角蛋白、TTF1阳性(图3C)。这例高级别胎儿腺癌包含背对背复杂的腺体,内衬透明细胞质的柱状上皮细胞,核上和核下空泡,类似于分泌型子宫内膜(图3A)。肿瘤细胞TTF1阳性。
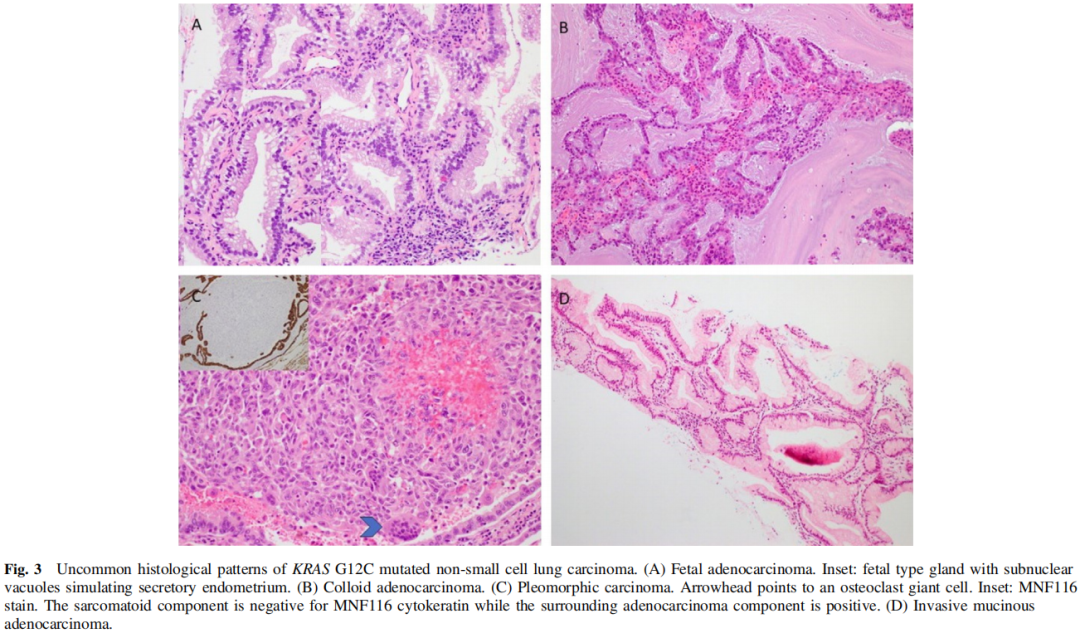
图3
53例浸润性非黏液腺癌和NSCLC NOS的组织学样本中,高分化4例(8%),中分化16例(30%),低分化33例(62%)。高分化肿瘤包括贴壁型,中分化肿瘤包括腺泡型和贴壁型,低分化肿瘤包括实性、单细胞、印戒细胞、微乳头和形态不良的腺体(图4)。
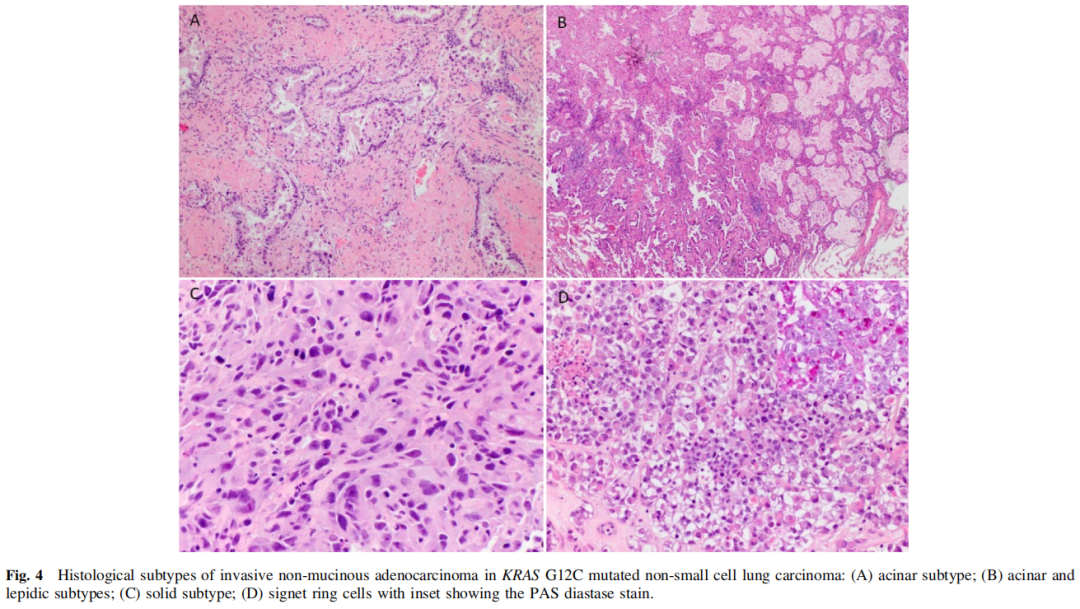
图4
免疫组化(表3):
83例患者中,TTF1阳性70例(84%),局灶阳性4例(5%),阴性9例(11%)。83例患者中,PD-L1阴性20例(24%),低表达28例(34%),高表达35例(42%)。所有病例ALK和ROS1均阴性。
分子结果:
59例仅携带KRAS G12C突变。19例携带2种突变,4例携带3种突变,1例携带4种突变。19例(23%)同时存在TP53突变。2例患者除TP53突变外,还存在PIK3CA突变。GNAS R201C突变2例。IDH1 R132C、IDH2 R172S、MET R988C、KRAS G12V、KRAS G12D和MTOR V2006L突变各1例。
有和无TP53突变的病例(表4、图5):
KRAS G12C和TP53突变的NSCLC患者共19例,其中男性8例,女性11例,平均年龄69岁。6例已知吸烟情况,均为吸烟者。1例多形性癌有TP53突变。5例浸润性黏液腺癌均无TP53突变。TP53突变的病例有更大比例的低分化组织学(75% vs 60%),更大比例的病例显示高水平的PD-L1表达(58% vs 38%),更大比例的病例表现为IV期疾病(71% vs 45%),但结果无显著性(分别为p=0.5943、0.3063和0.5713)。无TP53突变的IV期患者中位生存期为9个月,而有TP53突变的IV期患者中位生存期未达到。时序检验无显著性(p=0.2314),因为TP53突变组病例数少和删失病例数多(图5)。
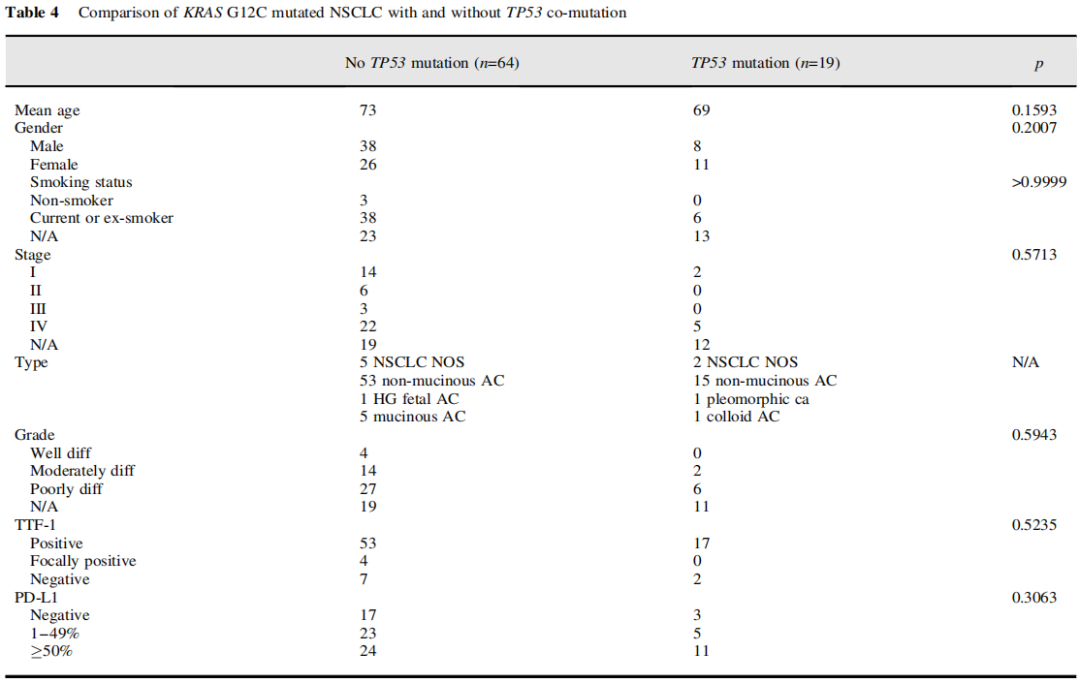
表4
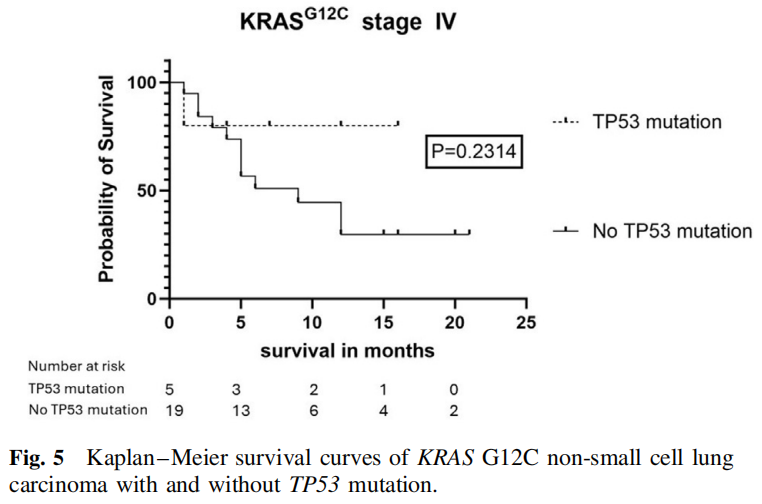
图5
讨 论
本研究中KRAS G12C突变的肺腺癌多具有传统的非黏液腺癌形态,并由贴壁型、腺泡型、实性型、微乳头型、单细胞型和复合腺等一种或几种亚型组成。仅6%为浸润性黏液腺癌。约60%的浸润性肺黏液腺癌携带KRAS突变。然而,与最常见G12C突变的非黏液腺癌不同,G12D(42%)和G12V(31%)在肺黏液腺癌中更常见,这一突变谱更接近于结直肠癌和胰胆管腺癌。TP53突变罕见,而且肿瘤突变负荷往往较低。这可以解释在本研究的病例中,黏液腺癌的发病率较低,且无TP53突变。
1例多形性癌同时存在KRAS G12C和TP53突变。多形性癌的EGFR和KRAS突变频率与传统腺癌相似,并且常见染色体异常和TP53突变。
值得注意的是,在本病例系列中有1例KRAS G12C突变的高级别胎儿腺癌。胎儿腺癌是一种独特但罕见的肺腺癌类型,其组织学与假腺期的胎儿肺(妊娠8~16周)相似。低级别和高级别胎儿腺癌具有不同的临床病理特征。低级别胎儿腺癌发生于患早期疾病的年轻女性,具有小泡形成的低级别细胞核,以纯模式发生,并且有导致β-catenin核表达的β-catenin突变。高级别胎儿腺癌发生于重度吸烟的老年男性,发病时处于晚期,具有高级别细胞核,无β-catenin突变,并且通常与传统腺癌的其他类型混合。由于高级别胎儿腺癌的罕见性,其突变谱尚未得到充分证实,但它们很少有EGFR或KRAS突变。高级别胎儿腺癌是具有独特分子特征的独特腺癌,还是更好地将其视为传统腺癌的形态亚型,目前仍有待观察。
本研究发现KRAS突变是NSCLC中最常见的突变类型,其中KRAS G12C突变的发生率最高(在本研究中为11%)。这与西方国家的流行情况一致,在西方国家,40%的NSCLC发生KRAS突变,其中KRAS G12C占总病例的10-13%。然而,存在显著的地理差异,在亚洲国家,KRAS G12C的发生率可能低至1.4-4.3% ,这可能是由于在这些国家中,从不吸烟者中EGFR突变腺癌的百分比较高。
在本研究中,几乎所有KRAS G12C患者都是当前或既往吸烟者,这与全球经验一致,在全球经验中,KRAS G12C NSCLC患者的吸烟率从西方国家的92.9-98.6%到亚洲的64.0-86.8%。人们认为香烟烟雾中的多环芳烃有利于导致KRAS G12C的G>T转换,而不是在从不吸烟者中导致KRAS G12D的G>A转换。
本研究IV期患者的中位总生存期(mOS)为12个月。这与一项纳入1,194例KRAS突变NSCLC(包括64%的复发或转移性疾病)的回顾性研究相当,其中KRAS G12C病例的mOS为13.4个月,与KRAS非G12C病例的mOS相似(13.1个月,p=0.96)。
在本研究中,24%的病例PD-L1呈阴性,34%的病例PD-L1低表达(1-49%),42%的病例PD-L1高表达(≥50%)。同样,这与文献中报道的KRAS G12C突变NSCLC的PD-L1表达比例相当(分别为6.3-41.7%,18.0-54.2%和33.3-56.0%)。值得注意的是,与KRAS非G12C病例相比,KRAS G12C NSCLC患者的高水平PD-L1表达比例略高(36% vs 27% p=0.03),PD-L1表达中位数较高(5% vs 1% p=0.04),肿瘤突变负荷较高(中位数8.8 vs 7.0 mut/Mb, p=0.006)。然而,两组在免疫检查点抑制剂治疗的缓解率、无进展生存期和总生存期方面无差异。KRAS G12C是否本质上表现出更高的PD-L1表达和/或肿瘤突变负荷,以及这是否与共突变的存在相关,仍有待观察。
KRAS G12C突变通常与TP53、STK11和KEAP1突变相关,突变发生率分别为17.8-50.0%、10.3-28.0%和6.3-23.0%。在本研究中,研究者发现在23%的病例中,KRAS G12C与TP53共突变。关于TP53共突变对KRAS突变NSCLC的影响,目前有相互矛盾的报道,一项研究发现它是一个不良预后因素,而其他研究发现它没有预后影响。本研究没有统计学功效来评估其预后影响。KRAS突变型NSCLC的TP53突变与DNA修复缺陷和基因组不稳定相关,从而导致高突变的基因组表型,包括PD-L1表达较高、CD8 T细胞浸润、适应性免疫逃逸,以及对PD-L1抑制剂治疗的应答较大和生存优势。在本研究中,KRAS与TP53共突变的NSCLC分化程度更低,PD-L1表达更高,但由于病例数较少,结果无统计学意义。在NSCLC中,STK11和KEAP1也常与KRAS共突变,两者分别是与免疫检查点抑制剂耐药和化疗耐药相关的不良预后指标。本研究的测序panel不包括这两个基因。虽然具有里程碑意义的CodeBreaK100和KRYSTAL-1试验未明确确定KRAS G12C抑制剂治疗的任何预测性生物标志物,但最近对接受索托雷塞或阿达格拉西布治疗的424例KRAS G12C NSCLC患者开展的一项回顾性研究发现,KEAP1、SMARCA4和CDKN2A突变是KRAS G12C抑制剂单药治疗后结局较差的预测因素。需要更大的测序panel和更多病例来阐明共突变对KRAS G12C突变NSCLC的病理和预后影响。需要进一步的前瞻性试验来确定这些共突变是否可以作为预测生物标志物来确定对KRAS G12C抑制剂的应答。
与大量记录KRAS G12C NSCLC临床、分子和预后特征的研究相比,只有一项研究详细研究了KRAS G12C肺腺癌的组织病理学特征。该研究显示组织学表现无特异性,腺泡型(29.7%)、NOS(24.8%)和实性型(17.8%)最常见。与本研究一样,大多数患者为TTF1阳性(78.7%)。与本病例系列的76%相比,该研究的PD-L1阳性率较低,为44.1%(PD-L1表达≥1%)。在他们的研究中没有分期或分级的记录,因此尚不清楚这种差异是否可以用本研究中更多的IV期和低分化病例来解释,因为已知PD-L1表达与这些因素有关。
本研究有几个缺点。首先,病例数量少限制了发现显著关系的统计学功效。其次,使用WHO分类和分级系统对原发切除和转移性癌进行了组织学亚型和分级,该系统为早期I期切除的肺腺癌开发,这可能导致低分化病例的比例较高。第三,随访时间较短,I-III期患者无有意义的生存数据。
总之,本研究评估了83例KRAS G12C突变的NSCLC的临床特征,组织学,免疫组织化学和分子谱。研究者发现它们绝大多数与吸烟有关。多数为非黏液腺癌,形态不典型,TTF1阳性。约1/4的患者有TP53共突变,需要在更大规模的研究中评估其影响。
参考文献:
Li JJ, Wu XJ, Farzin M, et al. The histopathological spectrum and molecular changes associated with KRAS G12C mutation in non-small cell lung carcinoma. Pathology. 2024;56(6):786-794. doi:10.1016/j.pathol.2024.04.002



