【醉仁心胸】心脏手术中异体血小板输注对医源性感染的影响:一项单中心大数据队列研究
时间:2024-09-26 23:03:40 热度:37.1℃ 作者:网络
接受心脏手术的患者由于手术的侵入性操作、大剂量抗凝药物的使用以及体外循环故而有高风险出现大出血。血小板减少和血小板功能障碍是已知的与心脏手术围手术期出血相关的疾病。涉及的机制包括血液稀释、血小板活化或消耗、以及心脏手术患者频繁使用抗血小板药物等。然而,血小板输注已被发现与心脏手术后和危重患者医院获得性感染 (HAI)的增加有关,输注诱导的免疫调节被认为是一个主要的病理生理机制。我们分享的文献聚焦于心脏手术中输注异体血小板与术后医源性感染发生率的影响。

摘要
目的:尽管患者的血液管理有显著改善,但心脏手术仍是一类高出血风险的手术。血小板输注通常用于治疗围术期血小板减少相关出血,但异体血小板输注可能会诱导输注相关的免疫调节。然而,它与术后医源性感染的关系目前仍是一个有争议的话题。本研究目的是评估心脏手术中输注异体血小板与术后医源性感染发生率的影响。
设计:回顾性队列研究
单位:三级转诊医学中心
参与者:2012-2018年接受心脏手术的患者
干预措施:没有
测量和主要结果:在因果模型中,定义术中血小板输注为暴露。主要结局是医源性感染的发生率,包括血流感染、医院获得性肺炎和手术部位感染。在纳入的7662例患者中,528例(6.8%)患者在术中输注了血小板,329例(4.3%)患者发生了454例术后感染。血流感染106例(1.4%),医院获得性肺炎174例(2.3%),手术部位感染148例(1.9%)。经多变量逻辑回归校正后,术中输注血小板与血流感染风险增加相关(比值比[OR] 2.85;95% CI 1.40-5.8;P = 0.004;n = 7662),倾向评分匹配(OR 3.95;95% CI 1.57-12.0), p = 0.007;n = 766),倾向得分重叠加权(OR 3.04;95% CI 1.51 ~ 6.1, p = 0.002;N = 7,762)。手术部位感染和医院获得性肺炎与血小板输注无显著相关性。
结论:这些结果提示术中异体血小板输注是心脏手术后血流感染的危险因素。这些结果支持了旨在减少心脏手术围手术期血小板输注的患者血液管理策略的发展。
血小板是凝血和纤维蛋白凝块形成的关键组成部分,血小板输注通常用于治疗血小板减少症或血小板功能障碍相关出血。血小板现在被认为是先天和获得性免疫反应的关键因素。此外,异体血小板储存与血小板活化、血小板细胞外囊泡和可溶性因子(如可溶性p -选择素、可溶性cd40 -配体和血小板因子4)的积累有关,这可能会改变输血后的免疫反应。可溶性CD40L似乎在血小板输注诱导的输血相关急性肺损伤的发病机制中起关键作用。除了同种异体血小板介导的作用外,非白细胞减少的血小板浓缩物的白细胞含量可能增加血小板输注诱导的免疫调节。白细胞减少,这是现在在法国制备血小板浓缩物所需要的,可能减弱血小板输注引起的免疫调节。最近的一项荟萃分析对6项主要报道输注白细胞减少的浓缩血小板的研究进行了分析,但并未发现输注血小板与心脏手术后感染之间存在任何关联。相比之下,在内科外科重症患者(包括心血管患者)中,尽管使用了白细胞减少的血液制品,但仍观察到HAI与血小板输注之间的关联。不幸的是,这些研究并不只关注术后感染,并且存在一些局限性,包括术后感染的定义不一致,缺乏按感染类型进行亚组分析,以及统计方法问题。
因此,作者研究的主要目的是确定在一大批心脏手术患者中,术中输注白细胞减少的血小板浓缩物是否与术后医源性感染相关。作者假设血小板本身的免疫调节特性可以改变免疫反应,促进医源性感染的发生。
对象与方法
研究设计
作为持续质量改进计划的一部分,本研究采用了在作者中心接受心脏手术患者的所有持续性前瞻性数据。数据由研究助理收集,从手术之日起随访至死亡或出院,随访至1年的生存状况。数据包括患者特征和合并症、手术和麻醉管理、术后重症监护病房(ICU)管理、并发症和转归。对于本研究,作者分析了从2012年1月1日至2018年12月31日,至少住院2日,并且有医源性感染数据的所有连续成人患者。本研究获得雷恩大学医院伦理委员会批准(2022年6月4日,n˚22.109)。根据法国法律,由于本研究为观察性研究,书面同意被豁免。该分析遵循了《加强流行病学观察性研究报告》指南(补充表S1)。
患者管理
患者在一所拥有1,500张床位的大学附属三级医院的心胸科接受治疗,该医院包括心胸外科和重症监护病房。医院卫生标准方案遵循法国医院卫生协会关于预防和治疗HAI的建议。此外,所有患者在手术前5天接受鼻用莫匹罗星去菌落治疗,并在手术过程中给予第二代头孢菌素作为抗菌预防注射。
术前使用P2Y12抑制剂的抗血小板治疗在择期和半紧急手术前停止(氯吡格雷和替卡格雷停用5天,普拉格雷停用7天),如术前使用阿司匹林则在围手术期可继续使用。尽管当时还没有正式的血小板输注方案,但根据麻醉医师和外科医生的一致意见,术中异体血小板输注主要适用于与血小板减少症或已知血小板功能紊乱相关的使用鱼精蛋白后大出血的病例。此外,在此期间,没有即时血小板功能或粘弹性测试。所有的血小板浓缩物都是用全血来源的淡色涂层(混合血小板)或单采(单一供者血小板)制备的,并减少白细胞。自2017年以来,减少血小板浓缩物中的病原体都采用阿莫托萨伦和UVA (Cerus拦截血液系统)。
结果和变量
作者观察的主要结局是HAI的发生率。根据之前的文献报道,大多数HAI是由医院获得性血流感染(BSI)、医院获得性肺炎(HAP)和手术部位感染(SSI)引起的,并且由于其他HAI(如尿路感染)与死亡率增加无关,因此本研究仅纳入BSI、HAP和SSI。次要结果是BSI、HAP和SSI的发生率以及与HAI相关的微生物分布。根据美国疾病控制和预防中心的指南,HAI被定义为入院后48小时以上诊断出的术后感染,且入院时未处于潜伏期。BSI定义要求至少一种阳性血培养,但常见的皮肤污染物(凝固酶阴性葡萄球菌属、棒杆菌属、痤疮丙酸杆菌属和微球菌属)除外,这些污染物需要2种不同的阳性血培养。HAP的定义包括通气和非通气患者,并基于临床症状(发烧)、影像学表现(胸部x线或计算机断层扫描上的新浸润)、白细胞增多和气管内吸出(≥106菌落形成单位/mL)或支气管肺泡灌洗(≥104菌落形成单位/mL)的微生物培养阳性。最后,SSI仅包括胸部伤口感染,由发热、伤口感染的临床或放射学证据以及手术取出的深部软组织微生物培养阳性来定义。HAI的诊断由主治医生做出,并由2名审查了相关的影像学、微生物学数据和医疗记录的ICU医生独立确认。
此外,本研究还包括以下变量:患者特征和合并症(年龄、性别、体重指数、糖尿病、中风、慢性肾衰竭、慢性呼吸衰竭和肝硬化)、术前特征(EuroSCORE预测死亡率、血红蛋白水平、抗血小板药物使用、休克和循环支持)、手术和麻醉管理变量(手术年份、手术类型、心内膜炎、急诊手术、循环骤停、体外循环时间、红细胞、血小板、以及新鲜冷冻血浆和输血)、术后ICU管理并发症和结局(术后循环支持、多巴酚丁胺和去甲肾上腺素的使用、出血导致再手术、通气时间>48小时、术后卒中、HAI、BSI、HAP、SSI、住院、90天和1年生存期)。
统计分析
患者特征用数量(比例)或分类变量表示,连续变量用中位数(IQR [范围])表示。对于血小板输注与非血小板输注患者的比较,分类变量采用x2检验或Fisher精确检验,连续变量采用Wilcoxon秩和检验。在访问数据之前制定了统计分析计划。未进行先验统计功率计算。以下多变量分析仅包括术前变量、麻醉相关变量和手术相关变量,以防止竞争风险偏倚。所有分析均针对完整病例进行。
除了血小板输注与医源性感染之间的单变量逻辑回归外,作者还使用了多变量逻辑回归模型作为主要的统计分析。作者使用DAGitty软件,使用有向无环图描述术中血小板输注(暴露变量)、患者相关混杂因素、麻醉、手术相关混杂因素和医源性感染之间的因果关系模型(补充图S1)。未分析任何变量作为影响因子。足以进行调整的潜在混杂因素包括:年龄、性别、体重指数、糖尿病、肝硬化、慢性肾衰竭、术前血红蛋白、术前抗血小板药物使用、术前休克、术前循环支持、手术年份、手术类型、急诊手术、停循环、体外循环时间、术中红细胞输注、术中浓缩血小板输注、术中新鲜冰冻血浆输注。然后使用多元逻辑回归模型估计术中血小板输注(暴露变量)与HAI、BSI、HAP和SSI之间的比值比。检验了连续自变量和对数比值是否存在多重共线性和线性。使用有向无环图先验地定义进入模型的混杂因素。治疗效果用比值比(OR)表示,相应的置信区间为95%。
使用匹配和重叠加权开发了另外两个基于倾向的模型作为敏感性分析。倾向评分使用无偏多变量逻辑回归估计的,包括所有可用的术前、麻醉和手术相关变量。采用1:1最近邻匹配进行匹配,不进行替换匹配。通过使用重叠人群的平均处理效果作为目标估计,进行重叠加权。在匹配和加权后,使用标准化平均差来评估协变量平衡质量,并使用Love图进行报告。剩余不平衡定义为大于0.10的标准化平均差值。采用单变量logistic回归估计匹配后的治疗效果。采用单变量加权logistic回归估计重叠加权后的治疗效果。
结果
研究人群
在2012年1月1日至2018年12月31日期间接受心脏手术的8969名患者中,48名患者年龄小于18岁,40名患者缺少术后医源性感染相关数据,76名患者住院时间少于2天,所以本研究共纳入8805名患者(图1)。并对7662名患者进行了完整的病例分析。8805名纳入患者的缺失数据特征和分布见补充表S2。
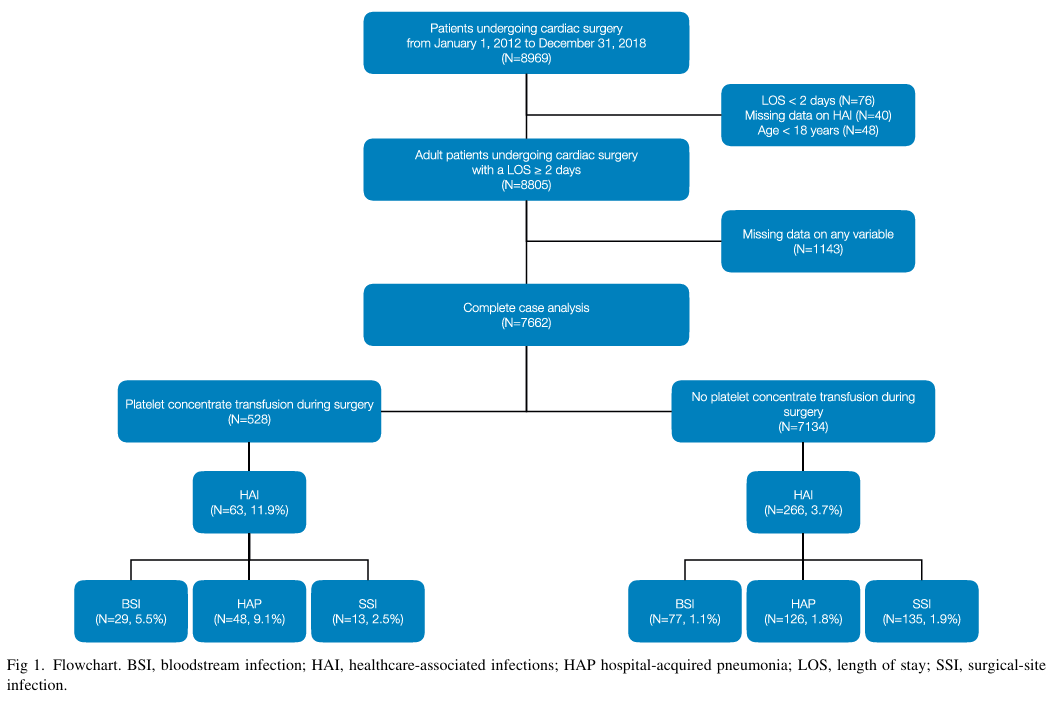
在完整病例人群中,中位年龄为69岁(61-77岁[18-90]),73%为男性,中位体重指数为26.3 kg/m2(23.7-29.3[14.4-49.1])(表1)。38%的患者在手术前使用抗血小板药物。根据EuroSCORE,预测死亡率为1.2%(0.7-2.7[0.5-61.3])。手术主要为择期手术(87%),中位体外循环时间为77分钟(58-108[20-468])。术中输注红细胞的患者人数占20%,输注新鲜冷冻血浆的占9.6%。出院时生存率为98%,1年生存率为96%。
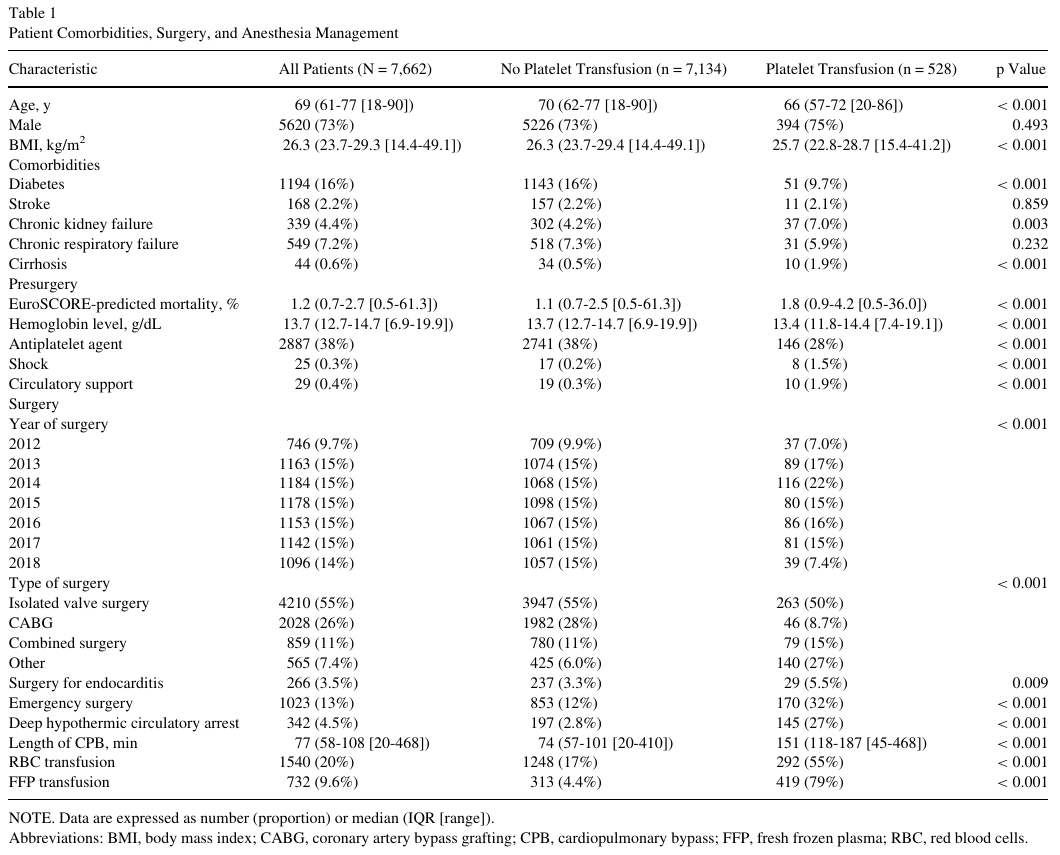
术中输注血小板
528例(6.8%)患者接受了术中浓缩血小板输注。在未经校正的比较中,根据术中血小板输注状态不同,患者合并症、手术和麻醉处理显著不同(表1)。接受术中血小板输注的患者更有可能需要进行紧急手术(32% v 12%, p < 0.001)和复杂手术,伴有较高的EuroScore预测死亡率(1.8% v 1.1%, p < 0.001)、术前循环支持(1.9% v 0.3%, p < 0.001)和心内膜炎(5.5% v 3.3%, p = 0.009),更频繁地需要深低温停循环(27% v 2.8%, p < 0.001)和更长的体外循环时间(151分钟v 74分钟,p < 0.001)。他们还更频繁地同时接受术中红细胞输注(RBC) (55% vs 17%, p < 0.001)和新鲜冷冻血浆输注(FFP) (79% vs 4.4%, p < 0.001)。同样,在未经调整的比较中,术中血小板输注状态不同,术后结果也有显著差异(表2)。输注血小板的患者更有可能接受术后循环支持(25% vs 4%, p < 0.001),使用多巴酚丁胺(41% vs 18%, p < 0.001),与去甲肾上腺素(45% v 34%, p < 0.001)和出现更差的预后,包括中风(3.2% vs 1%, p < 0.001),因出血而再次手术(6.2% vs 1.5%, p < 0.001),延长机械通气时间(6.2% vs 1.5%, p < 0.001),HAI(12% vs 3.7%, p < 0.001),和1年生存率(87% vs 97%, p < 0.001)。
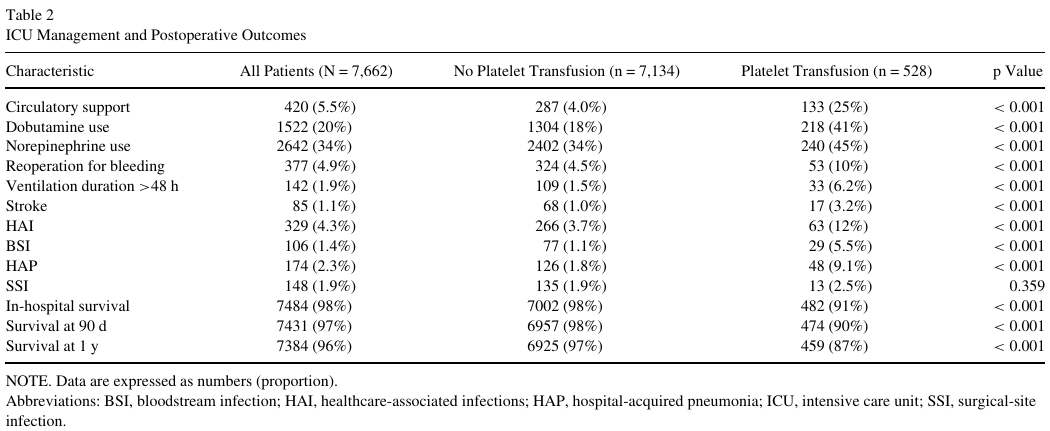
HAI
在纳入分析的7,662例患者中,329例(4.3%)发生454例HAIs: 106例(1.4%)至少发生一次BSI(122例),174例(2.3%)至少发生一次HAP(184例),148例(1.9%)发生SSI(148例)(表2)。在多因素logistic回归中纳入的混杂因素中,与总体HAI发生独立相关的因素有体重指数(以每kg/m2计算,OR [95% CI] 1.05 [1.02- 1.07], p = 0.001)、糖尿病(1.40 [1.03-1.88],p = 0.028)、慢性肾衰竭(1.87 [1.22-2.80],p = 0.003)、术前循环支持(12.3 [5.2-30.8],p < 0.001)、手术类型(冠状动脉旁路移植术1.59 [1.15-2.20],p = 0.005);联合手术(1.65 [1.14-2.36],p = 0.007);其他手术(2.52 [1.70-3.70],p < 0.001)、急诊手术(1.67 [1.23-2.26],p = 0.001) 、以及体外循环时间(每分钟1.01 [1.00-1.01],p< 0.001)。2017年(0.48 [0.295-0.77],p = 0.003)和2018年(0.50 [0.308-0.80], p = 0.004)与总体HAI发病率的降低独立相关(补充表S3)。
术中输血小板对HAI的影响
单变量分析显示,血小板输注与较高的HAI (12% v 3.7%, p < 0.001)、BSI (5.5% v 1.1%, p < 0.001)和HAP (9.1% v 1.8%, p < 0.001)发生率相关,但与SSI (2.5% v 1.9%, p = 0.359)无关(表2)。在主要的多因素logistic回归中(1.36 [0.87-2.13],p = 0.176)和基于倾向的敏感性分析中,无论是采用匹配(1.30 [0.81-2.10],p = 0.280)还是重叠加权(1.37 [0.90-2.08],p = 0.139),术中血小板输注与总体HAI发生率均无独立相关性(表3)。
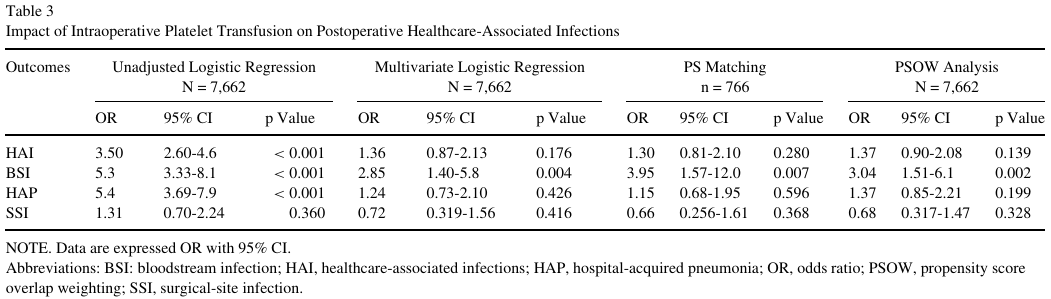
与HAP和SSI相比,在主要的多变量logistic回归(2.85 [1.40-5.8],p = 0.004)和基于倾向的敏感性分析中,无论是采用匹配(3.95 [1.57-12.0],p = 0.007)还是重叠加权(3.04 [1.51-6.1],p = 0.002)中,术中血小板输注始终与BSI的发生独立相关(表3)。HAI、BSI、SSI和HAP的完整逻辑回归模型见补充表S3-S6。
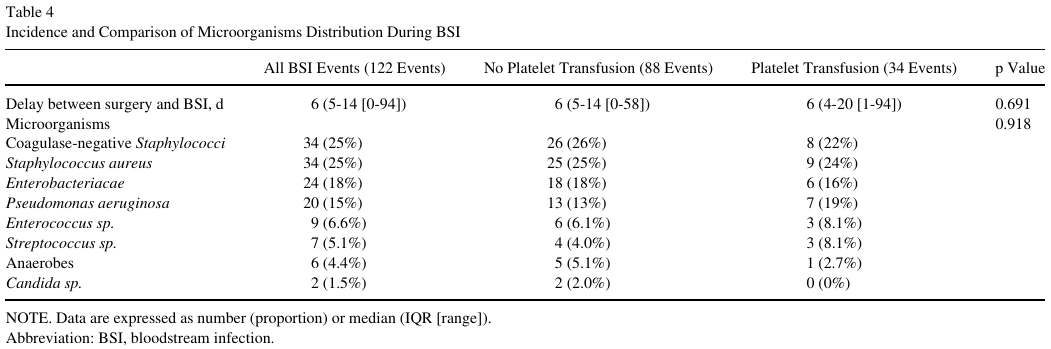
基于倾向的分析的协变量平衡和处理效果报告于补充表S7和S8以及补充图S2和S3。与血小板输注相关的手术与BSI发生之间的中位延迟时间无差异(6[4-20(1-94)]天vs 6[5-14(0-58)]天,p = 0.691)(表4)。同样,微生物的分布不受血小板输注的影响,主要由葡萄球菌(凝固酶阴性和金黄色葡萄球菌)、肠杆菌科和铜绿假单胞菌引起的(表4)。
讨论
作者对大量心脏手术患者采用稳健统计学方法,报道了术中血小板输注对术后医疗保健相关感染(HAI)的影响。本研究的主要结果如下:(1)术中血小板输注的比例为6.8%;(2)术中血小板输注未发现与术后HAP或SSI独立相关;(3)术中血小板输注与术后BSI独立相关。
尽管目前的指南,异体血小板输注实践在心脏手术中差异很大。在这种情况下,围术期血小板输注的总发生率在8%-39%之间,术中血小板浓缩使用在7.6%-13.3%之间。在本研究中,6.8%的患者进行了术中血小板输注,这低于大多数已发表的数据。与此同时,术中红细胞和FFP输注的发生率与以前发表的研究一致。HAI,特别是BSI,HAP和SSI,与心脏手术后的发病率和死亡率都相关。在本研究中,HAI的发病率和分布与以往对心脏手术的研究一致。
虽然红细胞输注对HAI的影响已得到一致的证实,包括在心脏手术中,但关于异体血小板输注对心脏手术术后HAI的影响,已有相互矛盾的结果报道。事实上,最近的一项荟萃分析并没有发现感染的风险有所增加。然而,正如本荟萃分析中明确强调的那样,所纳入的研究存在严重的局限性。事实上,许多研究报告了它与所有HAI的关联,但没有对单独的感染类型进行具体分析,包括BSI、HAP和SSI。此外,他们中的大多数并不只关注术后HAI,而是关注术后的整体结果。这经常导致异构的定义,从而导致HAI识别不准确,也可能导致次优的统计建模。事实上,基于临床判断,在心脏手术中输注血小板的决定会受到患者的合并症和治疗情况、手术复杂性、中心实践和对患者血液管理的依从性的影响。血小板输注也与决定输注RBC和FFP有关。因此,输血患者和非输血患者在合并症、手术风险、麻醉和输血管理方面可以观察到很大的差异,这也在作者的队列研究中得到了证实。因此,血小板输注在心脏手术中与HAI有共同的危险因素。在这种情况下,由于不可控的混淆因素存在很高的偏倚风险,这可能部分解释了先前发表的关于心脏手术中血小板输注对HAI影响的研究之间的差异。因此,需要一种稳健的统计方法来尽量减少混杂偏差。为此,作者(1)使用基于因果关系的变量选择进行多元逻辑回归,(2)非简约倾向得分匹配,以及(3)倾向得分重叠加权,以帮助控制极端倾向得分的影响。
本研究表明,与整体HAI、SSI和HAP不同,在多元逻辑回归和基于倾向的分析中,术中血小板输注始终与BSI的发生独立相关。据作者所知,这是调查心脏手术后异体血小板输注与BSI之间特异性关联的最大的研究。研究结果与最近发表的内科-外科危重症患者的数据一致。血小板浓缩物的直接细菌污染似乎不太可能导致这些结果,因为其报告的发生率较低,而且手术和BSI之间的中位延迟超过24小时。BSI的发病机制包括不同的感染源引起的复杂的病理生理途径。这通常涉及到组织侵袭(定植或感染)的一个阶段,然后通过上皮屏障扩散,最后,在血流中进入一个生存阶段。血小板输注可诱导内皮细胞的改变,并触发输血诱导的免疫调节。这些机制可能缓解细菌通过受损内皮,提高它们在血液中的生存能力,可能解释了本研究中血小板输注相关BSI风险的增加,而不伴随HAP或SSI风险的增加。首先,血小板输注可能通过其MHC抗原的表达引起输血诱导的免疫调节。第二,血小板浓缩物的制备和储存与血小板的结构和生化变化以及多种生物反应调节因子有关,包括细胞因子、血小板受体、生长因子和微粒。同样,血小板浓缩物的洗涤可能与减少血小板输注的不良反应有关。特别是,血小板浓缩物的储存与可溶性CD40L水平的升高有关,这可能在输血相关的急性肺损伤的发病机制中发挥作用。CD40L/CD40相互作用与涉及血小板、白细胞和内皮的许多促炎途径相关。此外,它还与内皮功能障碍和血管通透性增加有关。总之,这些机制可能参与了由手术和体外循环引发的2次打击炎症模型中心脏手术后血流感染的发生。
与之前发表的观察性数据相比,本研究具有以下优势。首先,使用与微生物学数据相关的前瞻性数据库、明确的HAI定义和对疑似HAI的独立确认有助于减少潜在的信息偏差。事实上,HAI的发病率和分布与以往的心脏手术研究一致。其次,异体输血实践和临床结果都符合目前心脏手术患者围术期管理的当前数据和指南,从而确保了作者研究结果的普遍性。第三,在这个大队列中,同时使用基于因果关系的多元回归和倾向得分匹配和重叠加权,确保了更好地控制潜在的混杂因素。同样,与这些不同的统计模型结果的一致性加强了对作者的结果的信心。
这项研究有一些局限性。首先,该研究的观察性设计排除了任何关于因果关系的明确结论。其次,尽管应用了稳健统计学方法,但不能排除未测量因素造成的残余混杂。特别是,除了单中心外,作者的数据库缺乏术前血小板计数、决定血小板输注时的血小板计数、术后输血等信息。第三,作为一项依赖于患者医疗记录的观察性研究,本研究可能存在信息偏差。第四,虽然HAI诊断由2名ICU医生独立确诊,但初步诊断由治疗医生作出。这可能构成了一个限制,特别是对于HAP的诊断,它是使用一套临床标准,而SSI和BSI的诊断则依赖于有记录的培养数据。第五,作者的数据库中未记录输注血小板浓缩物的数量、储存时间、生产方法(合并或单采)。最后,由于所有输注的血小板浓缩物都是白细胞介导的,作者的结果不能推广到非白细胞介导的血小板输注。
结论
在一项大型单中心观察性研究中,术中异体血小板输注与心脏手术后术后血流感染的显著增加相关。血小板输注并未显著增加手术部位感染和医院获得性肺炎。这些结果支持了患者血液管理策略的发展,旨在减少心脏手术围术期血小板输注。未来的转化研究应着眼于了解和调节血小板活化对围术期炎症反应的影响。
醉仁心胸 点评
这篇论文评估了心脏手术中异体血小板输血对术后医院相关感染(HAI)发生率的影响。通过回顾性2012年至2018年间在单一中心进行的心脏手术患者,发现术中血小板输血与术后血流感染(BSI)风险增加显著相关,但与手术部位感染(SSI)和医院获得性肺炎(HAP)无显著关联。作者建议在心脏手术中尽量减少围手术期血小板输血,以降低术后血流感染风险。心脏手术后感染对患者的康复有显著影响,延长患者的康复过程,导致严重的并发症,如肺炎或感染性心内膜炎等。同时,感染会加重心脏的负担,特别是对于那些术前心功能较差的患者。感染也会导致患者的生活质量下降,增加疼痛和不适感,影响日常活动。围术期通过多学科协作达到精准输血,从而有效减少术中和术后的输血需求,提高患者的预后和生存率。


