【神麻人智】乳酸/白蛋白比值与急性呼吸窘迫综合征患者短期死亡率之间的相关性
时间:2024-10-11 23:02:28 热度:37.1℃ 作者:网络

急性呼吸窘迫综合征(ARDS)是一种危及生命的疾病,其主要特点是由于肺泡-毛细血管渗透性增加,导致低氧血症和双侧肺水肿。在住院患者中,ARDS的死亡率约为30-40%。该病可能由多种因素引起,包括直接肺损伤(如肺炎和误吸)和间接肺损伤(如脓毒症、创伤和烧伤)。尽管如此,ARDS的病理机制仍不清楚,且目前缺乏有效治疗手段。因此,尽早识别与预后相关的生物标志物,并及时进行治疗,显得非常重要。
在许多严重的疾病中,组织低灌注和细胞缺氧导致血乳酸水平显著升高。此外,血乳酸水平还受到多种因素的影响,比如肝功能障碍、糖酵解加速以及某些药物的作用(如沙丁胺醇和二甲双胍)。尽管研究已经证实血乳酸水平与危重病患者的死亡率密切相关,但为了避免误诊,我们必须考虑所有可能导致乳酸升高的原因,这大大限制了乳酸作为生物标志物的临床应用。
另一方面,白蛋白能够抑制促炎物质的产生,改善ARDS患者的氧合情况。同时,它与危重病患者的死亡风险降低有关。然而,在评估患者预后时,血清白蛋白的效果也受到多种因素的影响,如慢性疾病、营养不良和白蛋白输注等。最新研究表明,乳酸与白蛋白的比值(LAR)是脓毒症、心跳骤停、呼吸衰竭和急性胰腺炎等多种疾病的预后标志物。然而,LAR与ARDS患者死亡率之间的关系尚不明确。在本研究中,我们利用Mart for Intensive Care IV(MIMIC-IV)数据库的数据,探讨了LAR与ARDS患者28天全因死亡率之间的相关性。
1.材料和方法
1.1研究设计
本研究对MIMIC-IV数据库中的769名ARDS患者进行了回顾性队列研究。该数据库由波士顿麻省理工学院和哈佛医学院共同维护,包含了2008年至2019年期间在波士顿贝斯以色列女子医院ICU入院的73,181名患者的所有信息,包括生命体征、实验室检查结果和其他临床数据。
1.2患者选择
纳入标准为:(1)年龄超过18岁;(2)在ICU中住院时间超过24小时;(3)根据柏林标准在入ICU时被诊断为ARDS;(4)入院后24小时内进行过血浆乳酸和血清白蛋白的检测。根据28天生存状态,将患者分为生存组和死亡组。
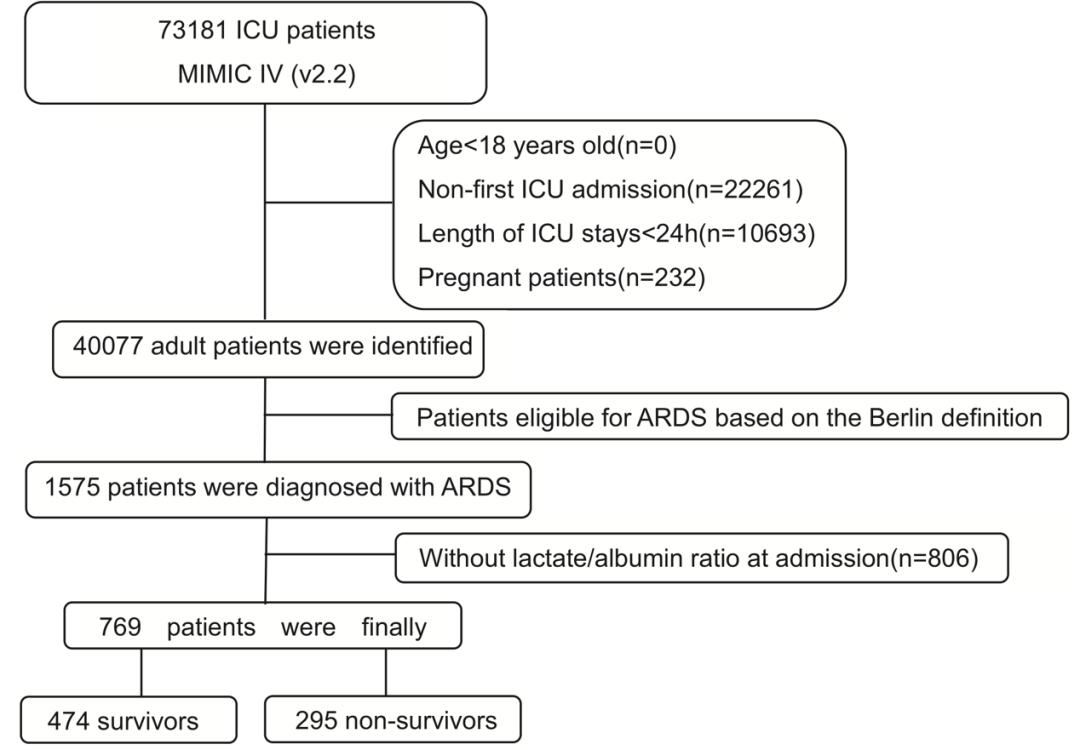
1.3数据提取
我们利用Navicat Premium提取以下变量:基线特征(如年龄、性别、种族、吸烟史、入院类型和ICU类别)、ARDS的危险因素(包括肺炎、创伤、非肺源性脓毒症及其他非肺源性因素)、合并症(如慢性阻塞性肺病、高血压、糖尿病、肾衰竭和恶性肿瘤)、疾病严重程度评估评分(如SAPSII、OASIS、LODS和SOFA)、患者入ICU 24小时内的生命体征(心率、平均动脉压、呼吸频率、SpO2)、PaO2/FiO2和PEEP、入院24小时内的血乳酸和血白蛋白水平,以及接受的治疗(如机械通气、肾替代疗法、升压药、皮质类固醇和抗生素)。
1.4统计分析
本研究将使用R软件和STATA软件进行统计分析。首先,通过偏度和峰度检验对连续性变量进行正态性分析。对于正态分布的连续变量,我们将采用t检验;对于非正态分布或非连续性变量,则使用Mann-Whitney U检验;而分类变量之间的差异则通过卡方检验或费舍尔精确检验来比较。接下来,我们将进行单因素Cox回归分析,以识别潜在的危险因素。对于P值小于0.1的变量,将纳入多因素Cox回归分析,以确定独立风险因素。此外,我们还会进行ROC分析,比较LAR、乳酸、白蛋白和SAPSII对ARDS患者28天死亡率的预测能力,并计算这些指标的灵敏度和特异度(AUC)。最后,根据Youden指数确定LAR的最佳截断值,并根据该值将患者分为高LAR组和低LAR组。我们将绘制Kaplan-Meier生存曲线,并利用对数秩检验比较这两组之间的生存差异。
2.结果
2.1人口统计学和临床特征
该研究共纳入769名ARDS患者,其中474名为28天内生存者,295名为死亡者。与以往研究一致,ARDS患者在28天内的全因死亡率为38%。死亡者的平均年龄显著高于存活者(P < 0.001)。两组患者在种族和ICU入住类型方面也存在显著差异(P < 0.05)。死亡组患者更易患有非肺源性脓毒症和肾衰竭,且其疾病严重程度评分(如SAPSII、OASIS、LODS和SOFA)和呼吸频率均较高(P < 0.001)。此外,死亡组的平均动脉压(MAP)和PaO2/FiO2值低于生存组(P < 0.001),这表明他们更可能出现血流动力学不稳定和肺损伤。研究结果还显示,死亡组入院时的乳酸水平显著高于生存组(1.15 [0.63, 2.04] vs 0.62 [0.42, 1.00],P < 0.001),而血白蛋白水平则明显较低(P < 0.001)。在死亡组中,有88.14%的患者使用了升压药,30.17%使用了肾替代疗法(RRT),29.46%使用了皮质类固醇,这些比例均高于生存组(P < 0.001)。呼吸机的使用比例在死亡组和生存组分别为98.31%和95.57%(P < 0.05)。最后,我们根据Youden指数确定LAR的最佳截断值,并根据该值将患者分为高LAR组和低LAR组。我们将分别绘制两组患者Kaplan-Meier生存曲线,并利用对数秩检验比较这两组之间的生存差异。
2.2LAR是ARDS患者28天死亡率的独立风险因素
生存组和死亡组在年龄、种族、ICU类别、非肺源性脓毒症的患病情况、合并肾衰竭、LAR、乳酸水平、白蛋白水平、疾病严重程度评分以及相关治疗等方面存在显著性差异(P < 0.05)。我们将这些变量纳入单因素Cox回归分析,结果显示,除ICU类别、创伤和机械通气治疗外,大多数变量均具有显著差异。在多因素Cox回归分析的模型I中,我们考虑了LAR以及年龄、性别、种族和吸烟情况等基本信息,分析结果表明LAR与28天全因死亡率显著相关(HR = 1.13;95% CI,1.10–1.17;P < 0.001)。在模型II中,LAR仍然被确认是一个独立的危险因素(HR = 1.11,95% CI = 1.06-1.16,P < 0.001)。此外,年龄、合并肾衰竭、使用升压药、皮质类固醇或抗生素,以及SAPSII评分也是ARDS预后的独立风险因素。
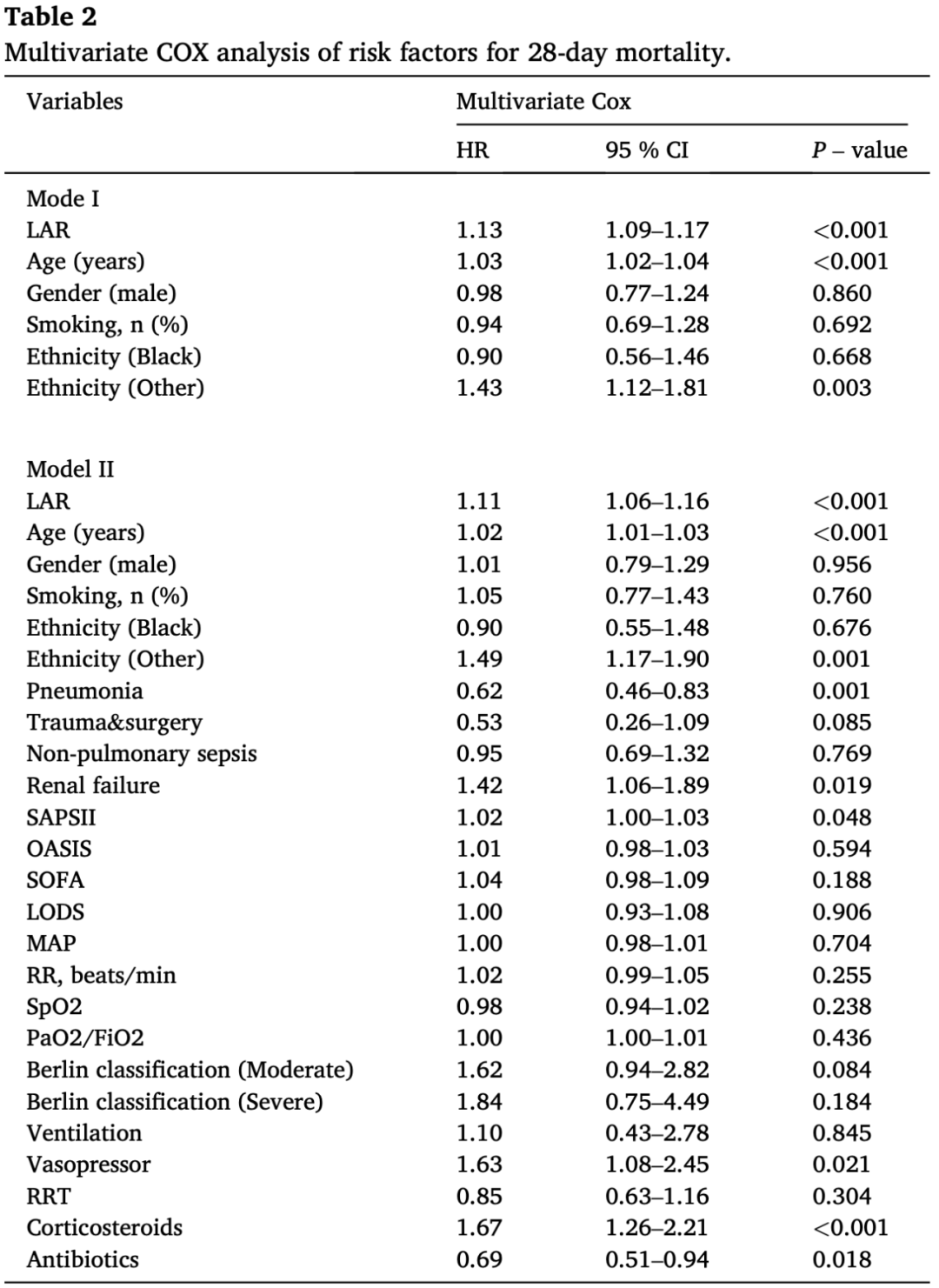
2.3ROC曲线分析和Kaplan-Meier曲线
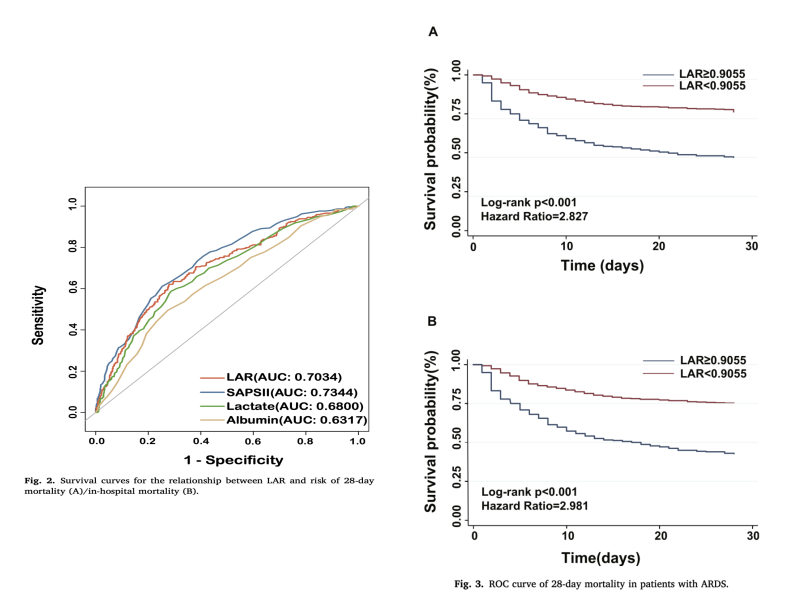
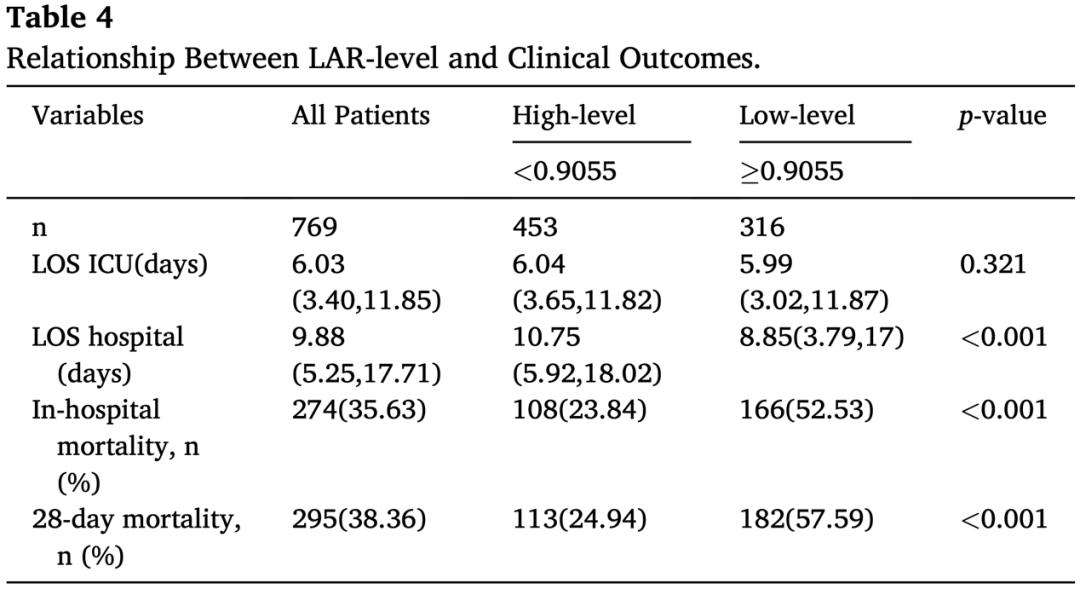
绘制ROC曲线进一步验证LAR对ARDS患者28天死亡率的预测能力(Fig.2)。LAR的AUC为70.34%(95% CI:66.53%-74.15%),明显高于乳酸的68.00%(95% CI:64.11%-71.88%)和白蛋白的63.17%(95% CI:59.13%-67.20%)。此外,LAR与SAPSII(73.44%,95% CI:69.84%-77.04%)的AUC之间并没有显著差异。LAR的灵敏度和特异度分别为62%和72%,而SAPSII的灵敏度和特异度则为61%和75%。我们根据截断值(0.9055)将ARDS患者分为高LAR组和低LAR组。Kaplan-Meier生存分析显示,高LAR组的ARDS患者在28天内的死亡率明显高于低LAR组(P < 0.001,见图3)。住院死亡率的分析结果也类似(P < 0.001,见图3)。LAR的AUC为70.34%(95%CI:66.53%-74.15%),明显高于乳酸[68.00%(95%CI:64.11%-71.88%]]和白蛋白[63.17%(95%CI:59.13%-67.20%)]。此外,LAR和SAPSII[73.44%(95%CI:69.84%-77.04%]的AUC之间无显著差异。LAR的灵敏度和特异度为62%和72%,SAPSII的灵敏度和特异度为61%和75%。我们根据截断值(0.9055)将ARDS患者分为高LAR组和低LAR组。根据Kaplan-Meier生存分析,高LAR组的ARDS患者的28天死亡率明显高于低LAR组(P < 0.001,Fig.3)。对住院死亡率的分析亦呈现出类似的结果(P < 0.001,Fig.3)。然而,高LAR患者的住院时间较短(Table 4),这可能是由于住院死亡率较高造成。
3.讨论
本研究表明,乳酸与白蛋白比率(LAR)是急性呼吸窘迫综合征(ARDS)患者28天整体死亡率的独立预测因素。此外,LAR的准确性(AUC = 70.34%)高于单独使用乳酸(AUC = 68.00%)或白蛋白(AUC = 63.17%)。同时,LAR的表现不逊色于SAPSII(AUC = 73.44%)。此外,Kaplan-Meier生存分析显示,高LAR组的ARDS患者在28天内的整体死亡率和住院死亡率显著高于低LAR组。
最近,LAR被广泛用于评估重症患者的预后,包括脓毒症、急性呼吸衰竭、急性心肌梗死和创伤性脑损伤等。一方面,乳酸和白蛋白是重症患者常规检测的指标;另一方面,它们包含了更多的信息。乳酸是组织氧合、血液灌注和身体代谢的重要指标,而白蛋白反映了营养状况和炎症情况。一项涵盖4723名患者的八项研究的系统评价和荟萃分析发现,LAR预测死亡的 pooled 灵敏度和特异度分别为0.71和0.68,表明LAR可以预测脓毒症或脓毒性休克患者的死亡率。Lu等人确认LAR是急性呼吸衰竭患者30天死亡率的预测因子(AUC = 64.6%),其准确性高于单独的白蛋白(AUC = 63.1%)或乳酸(AUC = 61.6%),甚至高于SOFA评分(AUC = 64.2%)。然而,目前尚未有使用LAR预测ARDS患者预后的研究。本研究显示,LAR(AUC = 70.34%)是ARDS患者28天整体死亡率的独立预测因素。LAR的准确性(AUC = 70.34%)高于单独的乳酸(AUC = 68.00%)或白蛋白(AUC = 63.17%),同时,LAR的表现也不逊色于SAPSII(AUC = 73.44%)。Kaplan-Meier生存分析显示,高LAR组的ARDS患者在28天整体死亡率和住院死亡率方面显著高于低LAR组,但住院时间较短。这可能是由于ARDS患者的住院死亡率较高。考虑到组织缺氧和炎症反应,LAR可能比炎症生物标志物更能有效预测ARDS患者的预后。
在本研究中,我们比较了LAR和SAPSII在预测ARDS患者28天死亡率方面的表现。在之前的研究中,SOFA评分几乎是预后判断的首选工具。SAPSII和SOFA都是临床上用于重症患者的常用评分系统。SOFA评分在预测住院时间和死亡风险方面更为有效。SAPSII评分系统包括多个生理和临床参数,如呼吸频率、氧合指数、平均动脉压等与ARDS相关的指标。以前的研究已经确认SAPSII在ARDS患者中的预测价值。与这些研究类似,多变量Cox回归分析显示SAPSII是ARDS患者28天整体死亡率的独立预测因素。因此,我们通过ROC分析比较了LAR和SAPSII的预测能力,结果表明LAR(AUC = 70.34%)与SAPSII(AUC = 73.44%)的预测能力相当。这表明,仅使用乳酸和白蛋白的LAR在预测能力上与包含众多参数的SAPSII相似,这将简化临床工作。
本研究存在一些局限性。我们选择28天死亡率作为主要预后指标,但未基于MIMIC-IV数据库(一个记录2008年至2019年期间数据的开放医学数据库)检测患者的生存状态。应开展多中心前瞻性研究,详细记录ARDS患者的生存时间,以确定LAR的预测价值。此外,肝功能异常、如沙丁胺醇、二甲双胍等药物可能影响乳酸代谢。我们无法排除可能影响ARDS患者LAR水平的所有影响因素,这可能对我们的结论产生干扰效应。此外,本研究使用了柏林定义的ARDS,这可能导致使用高流量鼻氧疗法(HFNO)的患者被遗漏。未来的前瞻性研究应使用新的全球ARDS定义,以进一步确认LAR在ARDS患者中的预测价值。
4.结论
本研究表明,LAR可作为预测ARDS患者28天总死亡率的独立危险因素。这一结果将为麻醉科和重症监护室医生提供一种与SAPSII预测效果相当但更为便捷的工具,有望更及时地识别预后不良的ARDS患者。


