阿替丽珠单抗、维奈克拉联合奥妥珠单抗治疗Richter转化弥漫性大B细胞淋巴瘤(MOLTO):一项多中心、单臂、II期临床试验
时间:2024-10-14 14:00:56 热度:37.1℃ 作者:网络
研究背景
Richter转化弥漫性大B细胞淋巴瘤(DLBCL-RT)通常对化疗耐药,预后较差。因此探索一种触发抗肿瘤免疫反应的无化疗治疗组合,即阿替丽珠单抗、维奈克拉、奥妥珠单抗联合治疗。
研究方法
一项前瞻性、开放标签、多中心、单臂、研究者发起的2期研究,NCT04082897。
纳入标准:确诊为慢性淋巴细胞白血病或小淋巴细胞白血病(根据国际慢性淋巴细胞白血病研讨会(IWCLL) 2008年的标准),活检证实转化为弥漫大B细胞淋巴瘤;以前没有接受过DLBCL-RT治疗,可接受过慢性淋巴细胞白血病治疗;以前没有使用三联药物中的任何一种药物进行治疗;年龄大于18岁;ECOG评分0-2分。
患者共接受35个周期,每21天为1周期治疗。治疗方案:奥妥珠单抗(第1周期第1天100mg,第2天900mg,第8天和第15天1000mg; 第2-8周期的第1天 1000mg)和阿替丽珠单抗(第1周期第2天1200mg,第2 - 18周期第1天1200mg)和维奈克拉(根据慢性淋巴细胞白血病时间表,从第1周期的第15天开始,初始剂量为每日20 mg,逐步递增。在第3周期的第1天达到每日400 mg,并持续至第35周期的第21天)。
主要终点:意向治疗第6周期第21天的总缓解率。
研究结果
从2019年10月9日至2022年10月19日,共筛选了30名患者,纳入了28名患者(12[43%]男性和16[57%]女性) (图1),代表了对安全性和疗效进行分析的意向治疗人群,没有发生导致入组停止的治疗相关不良事件。
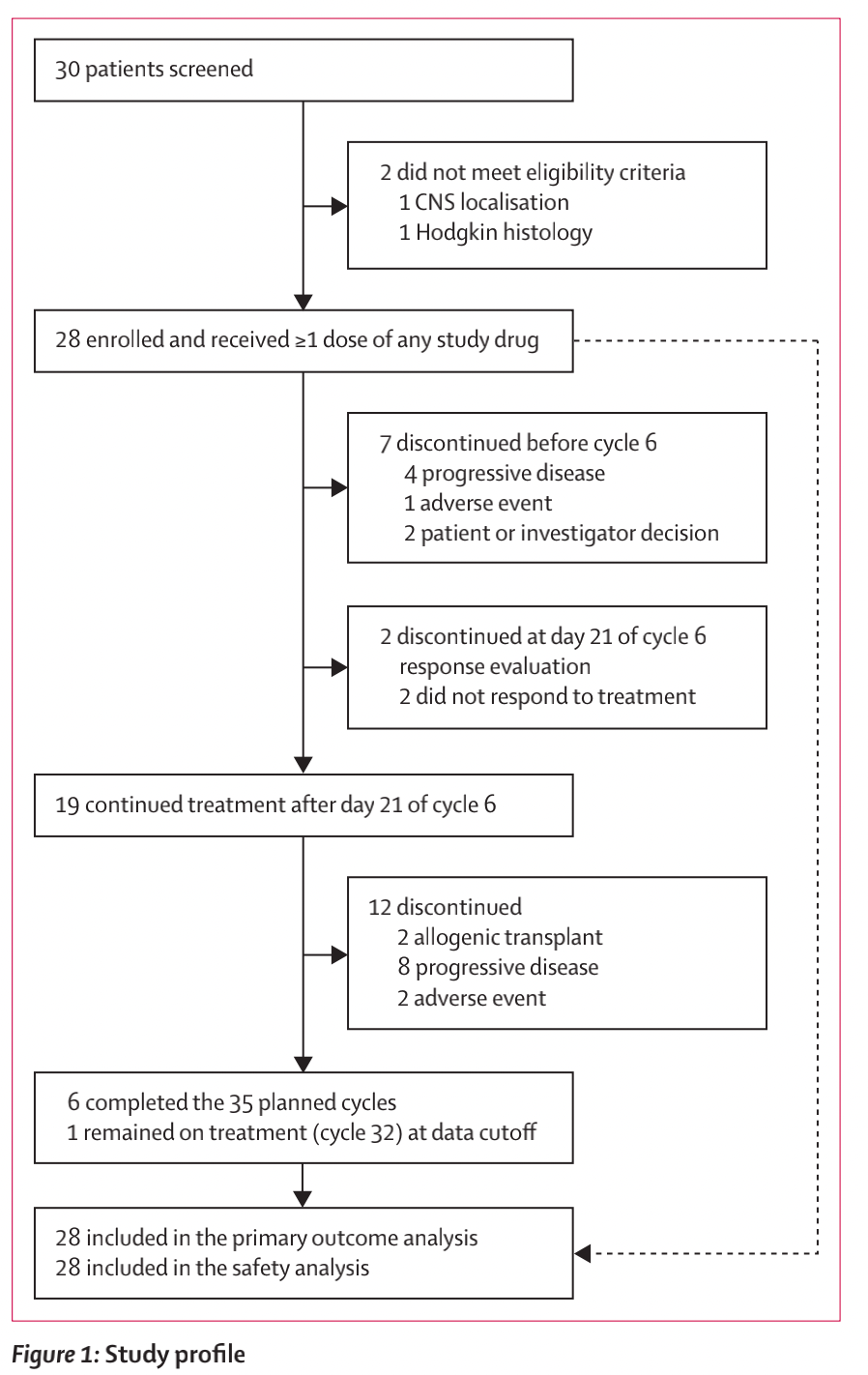
图1 研究流程图
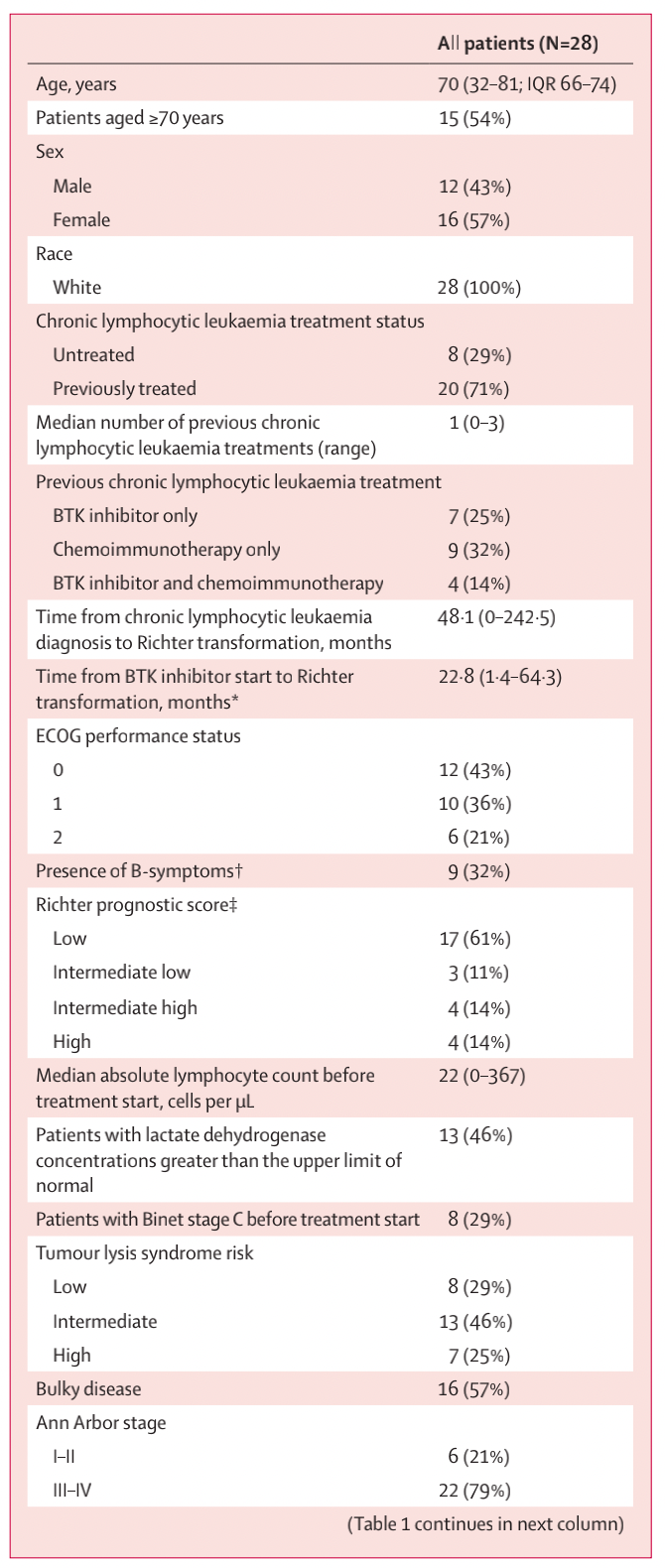
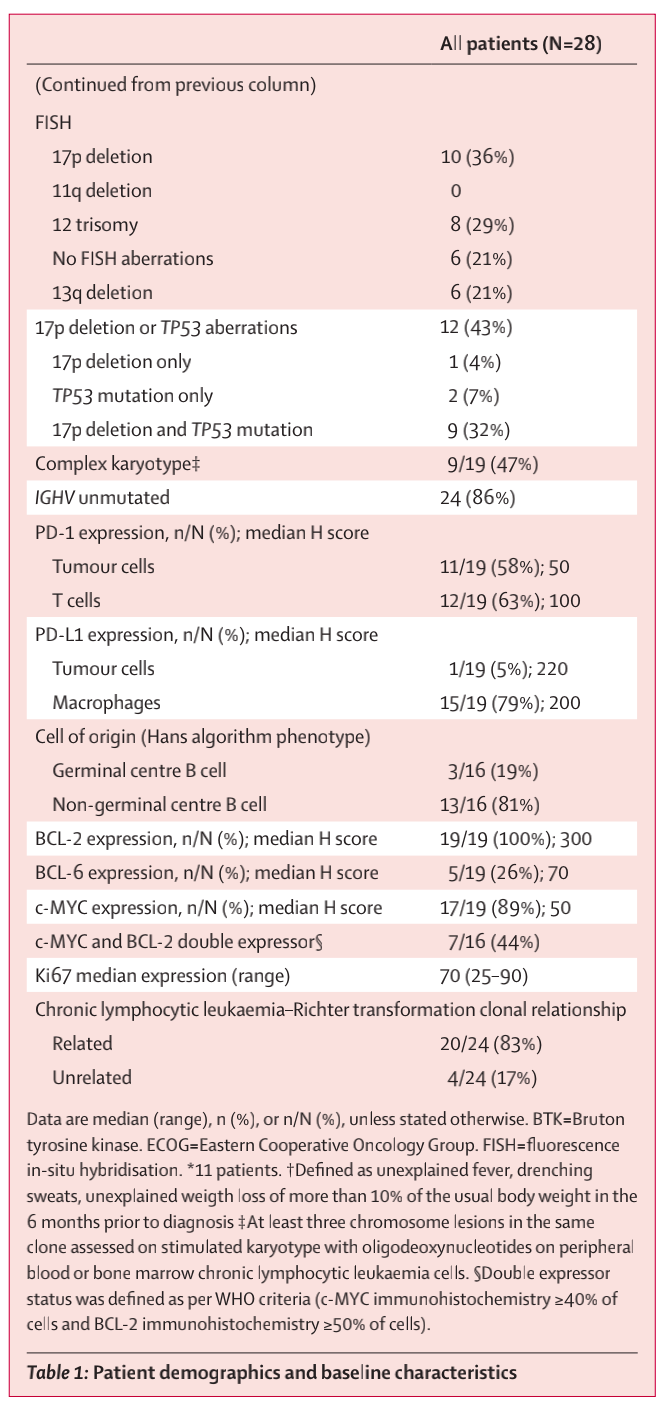
患者中位年龄70岁,20名患者(71%)既往接受过慢性淋巴细胞白血病治疗,11名患者(39%)接受过BTK抑制剂治疗(表1)。8名患者(29%)的Richter预后评分为中高或高。
对24名DLBCL和慢性淋巴细胞白血病患者进行了克隆性关系分析,其中20名患者(83%)为克隆相关性疾病。在这20名具有克隆相关性疾病的患者中有5名(25%)和4名具有克隆无关疾病的患者中有3名(75%)未接受过CLL的治疗。
表1 患者人口统计学和基线特征
截至2023年10月1日数据截止时,1名患者仍在接受治疗。中位随访时间16.8个月(IQR 7.8 ~ 32.0)。
根据意向治疗方法,全部28名患者均被纳入分析。在第一次疗效评估时(第6周期的第21天),21名患者仍在治疗中。7名患者被视为无应答者,其中4名因疾病进展、1名因大肠杆菌脓毒症(不良事件)和2名研究者的决策(图1)。
28名患者中有19名(67.9%)有效,总有效率为67.9% (95% CI 47.6 ~ 84.1%) (图2A)。8例完全缓解(28.6%;95% CI 11.8 ~ 45.3)。2名患者在第6周期后由部分缓解转为完全缓解,因此最佳完全缓解率为35.7%。
第6个周期后,19名有应答的患者继续接受了中位11个周期的治疗(范围0 ~ 29,图2B)。9名(32%)患者在数据截止时处于缓解状态,其中3名接受了巩固性同种异体干细胞移植(2名在10和18个周期后的治疗中,1名在完成治疗后)。2名患者在缓解期因感染死亡。总体而言,8名(29%)患者在治疗中位7个周期(IQR 5 ~ 9)后出现疾病进展,其中有2名在接受R-CHOP或类似R-CHOP的化疗免疫治疗后仍存活。
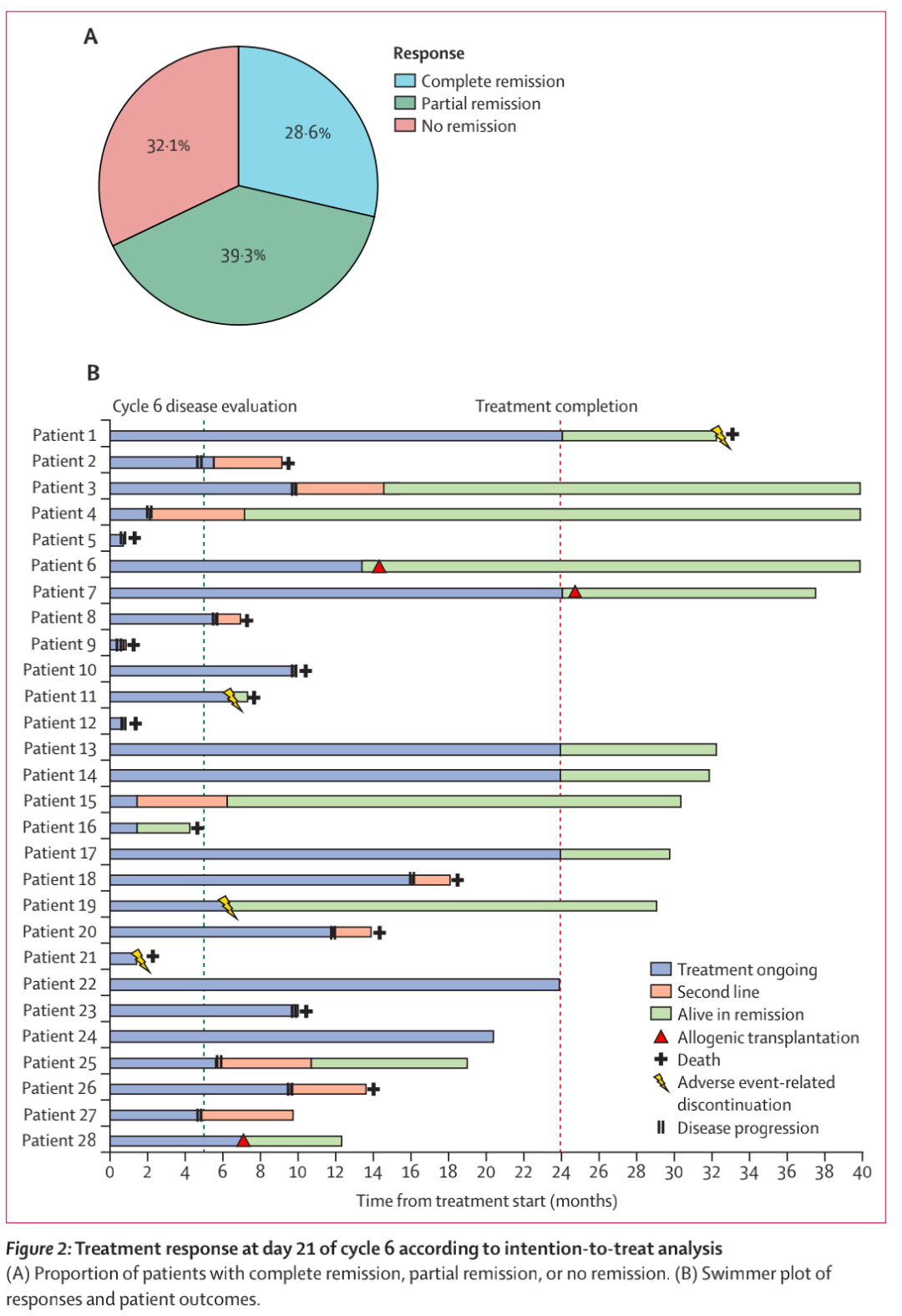
图2 根据意向治疗分析在第6周期第21天的治疗应答
12个月时,无进展生存率为42.9% (95% CI 24.6 ~ 60.0;图3A),在事后亚组分析中,仅受ECOG评分的影响(0 vs 1 ~ 2;p = 0·047)。28名患者中有14名(50%)出现疾病进展(4名在第一次评估应答前,2名在第6周期21日时对治疗无应答,8名在最初有应答后)。12个月时的总生存率为64.3% (95% CI 43.8 ~ 79.9)(图3B)。事后亚组分析中,与慢性淋巴细胞白血病的既往治疗(p= 0.033)、既往BTK抑制剂治疗(p= 0.007)、既往仅接受BTK抑制剂治疗(p= 0.032)、既往慢性淋巴细胞白血病的治疗次数(p= 0.039)和ECOG体能状态(p= 0.036)相关。
14名患者死亡(2名死于治疗期间的感染,1名死于治疗完成后完全缓解期间的COVID-19, 10名死于疾病进展,1名死于治疗终止后)。12个月时,19名患者中11名(57.9%)仍有缓解;95%CI 33.2 ~ 76.3;图3 c)。与较长缓解持续时间相关的基线特征只有男性和T细胞上PD-1的表达。12个月时,完全缓解患者的无进展生存期和反应持续时间均为87.5%(95% CI 38.7–98.1),而部分缓解患者的为36.4%(11.2–62.7)。在研究治疗中发生疾病进展的11名患者接受了R-CHOP或类似R-CHOP方案的后续治疗(图2B)。总体而言,在第6周期第21天缓解的19名患者中,有8名(42%)患者在24个月时仍存活且持续缓解(图2B)。
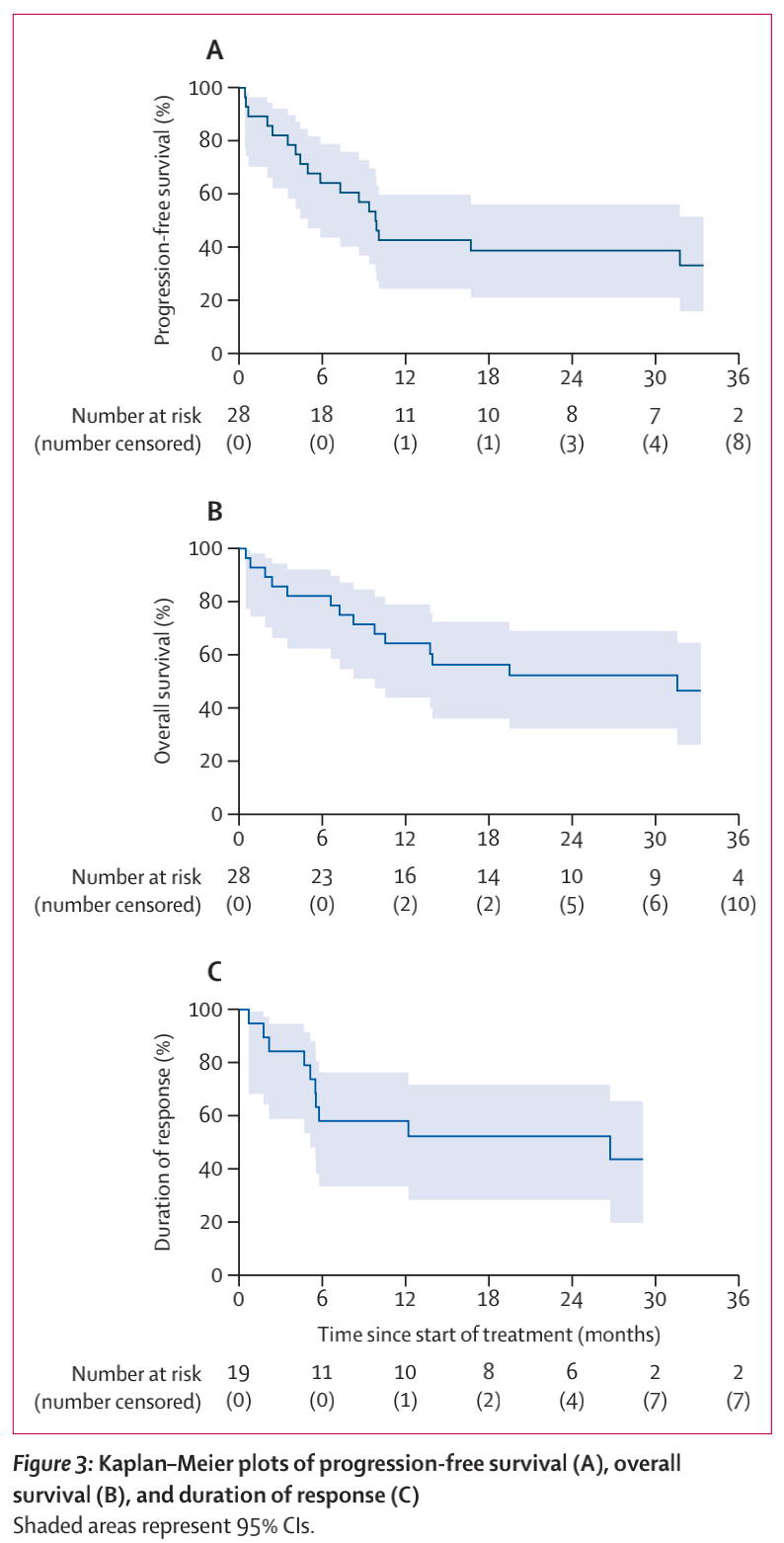
图3 Kaplan-Meier曲线生存分析
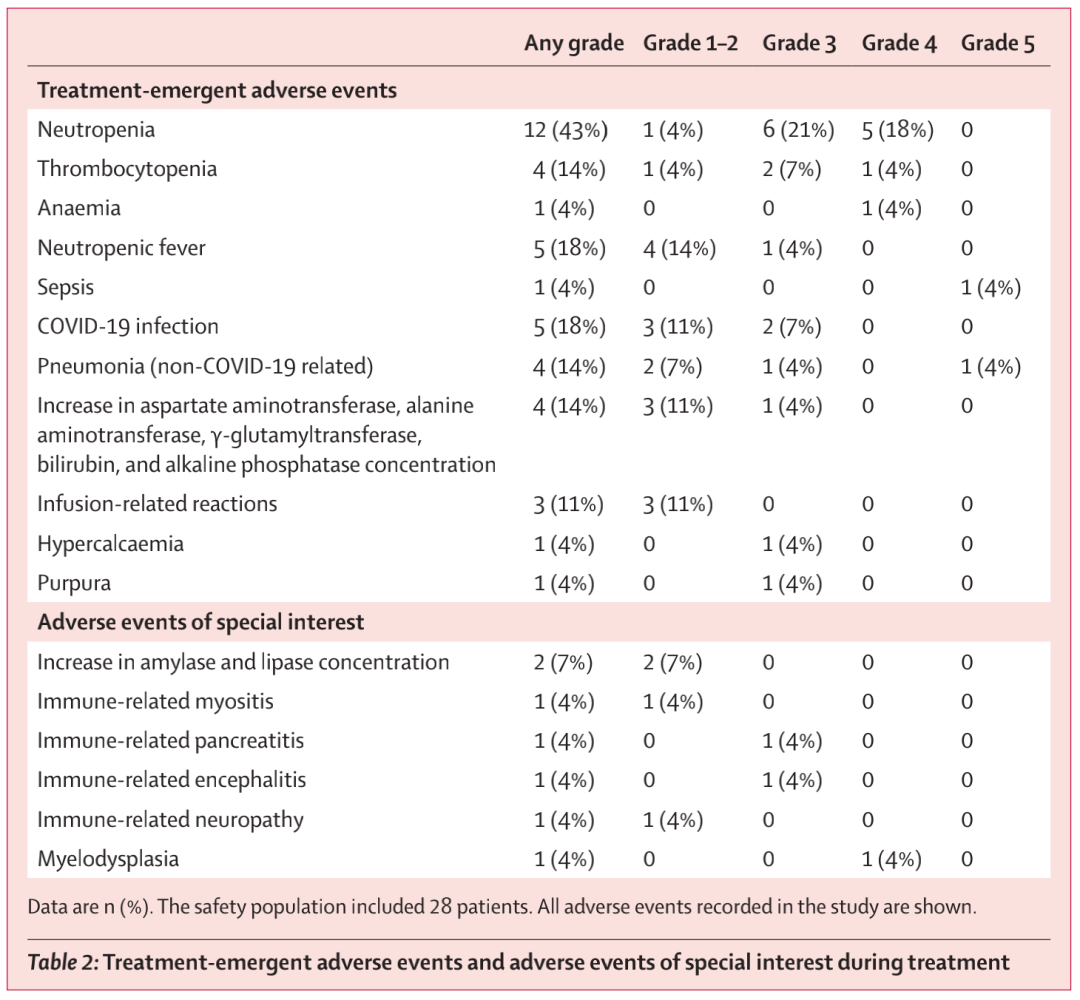
所有患者均发生了至少1起不良事件(表2)17 (61%;95% CI 40.6 ~ 78.5),17名患者发生了3级或更严重的不良事件,最常见的是中性粒细胞减少(11例,39%;21.5 ~ 59.4])。治疗期间发生了5例3级及以上的感染(5级:大肠杆菌脓毒症和曲霉菌性肺炎;3级:非covid -19相关性肺炎、covid -19相关性肺炎和covid -19胃肠炎)。7名患者(25%;10.7 ~ 44.9)发生了特别关注的不良事件(表2)。6名患者(21.4%)发生了免疫相关不良事件。所有免疫相关不良事件均可通过类固醇得到有效管理,且不需要永久停止治疗。在继续接受异基因干细胞移植的3例患者中,未出现与免疫相关的并发症。
表2 治疗期间出现的不良事件和特别关注的不良事件
在第6周期的第21日,流式细胞术检测的14名患者中有13名(93%)和Ig-HTS检测的14名患者中有9名(64%)的外周血慢性淋巴细胞白血病细胞分数的MRD不可测。在血浆cfDNA中,通过CAPP-seq, 19名患者中有10名(53%)的MRD不可测(图4)。在事后分析中,MRD状态不影响生存结局或缓解持续时间。
22例患者接受了从外周血纯化的慢性淋巴细胞白血病细胞的突变评估,16例患者接受了DLBCL-RT活检,24例患者接受了血浆ctDNA的突变评估。转化时,在外周血的慢性淋巴细胞白血病细胞中,22例患者中的11例(50%)有TP53突变,在DLBCL-RT活检中的16例患者中,有7例(44%)有TP53突变,在血浆中的24例患者中,有12例(50%)有TP53突变。在24例患者的外周血、Richter转化活检或血浆ctDNA标本中的慢性淋巴细胞细胞白血病细胞中,我们在15例(63%)患者中鉴定出TP53突变。在24例患者的外周血、DLBCL-RT活检或血浆ctDNA标本的慢性淋巴细胞白血病细胞中,我们在6例(25%)患者中发现了BTK或PLCG2突变。在分析了所有三个部位的患者中,只有22.6%(116 / 514)的突变在所有部位(即来自外周血的纯化的慢性淋巴细胞白血病细胞、DLBCL-RT活检和血浆ctDNA)。
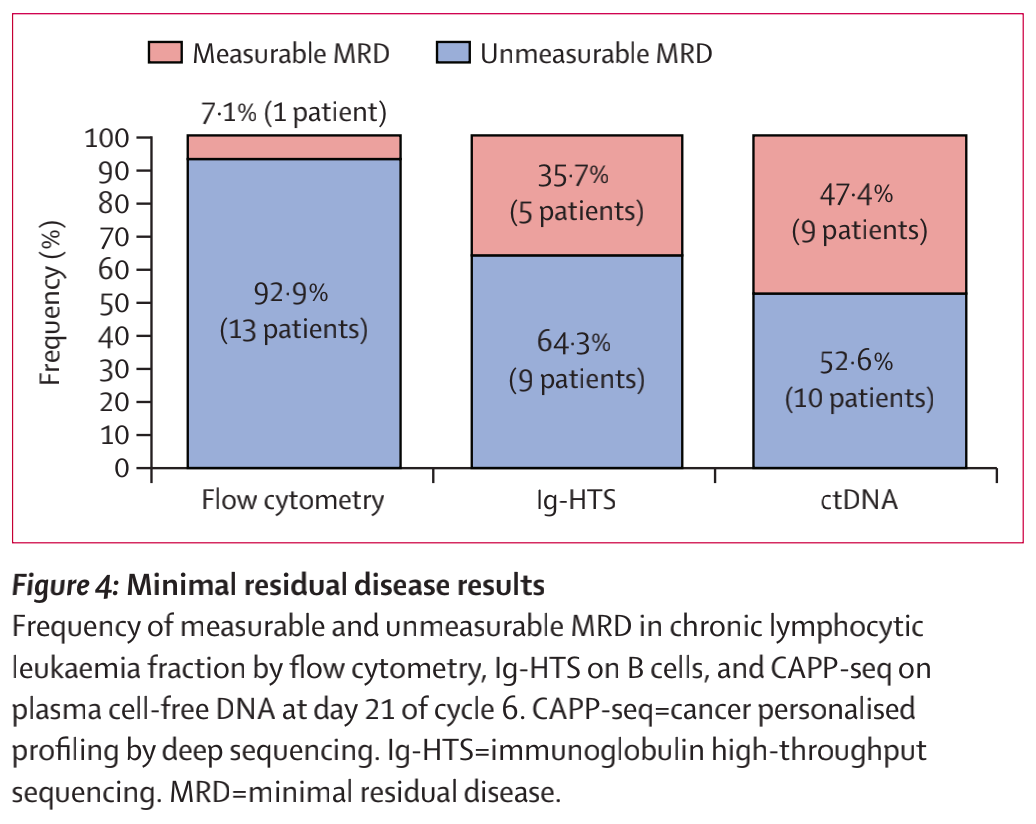
图4 微小残留病变(MRD)结果
在治疗期间,观察到CD3+、CD4+和CD8+ T细胞计数显著减少(图5A ~ C),NK细胞计数早期持续减少(图5D)。还观察到CD4+Th17细胞数量显著减少(图5E),以及Tregs细胞的减少(图5F, G)。在免疫检查点分子方面,PD-1+CD8+T细胞的数量从第2周期的第1天开始持续减少(图5H),而CD4+和CD8+T细胞上CTLA-4的表达没有变化(数据未显示)。在事后分析中评估基线免疫参数对临床结局的影响时,PD-1+CD8+ T细胞的数量不影响应答率、缓解持续时间或生存结局。
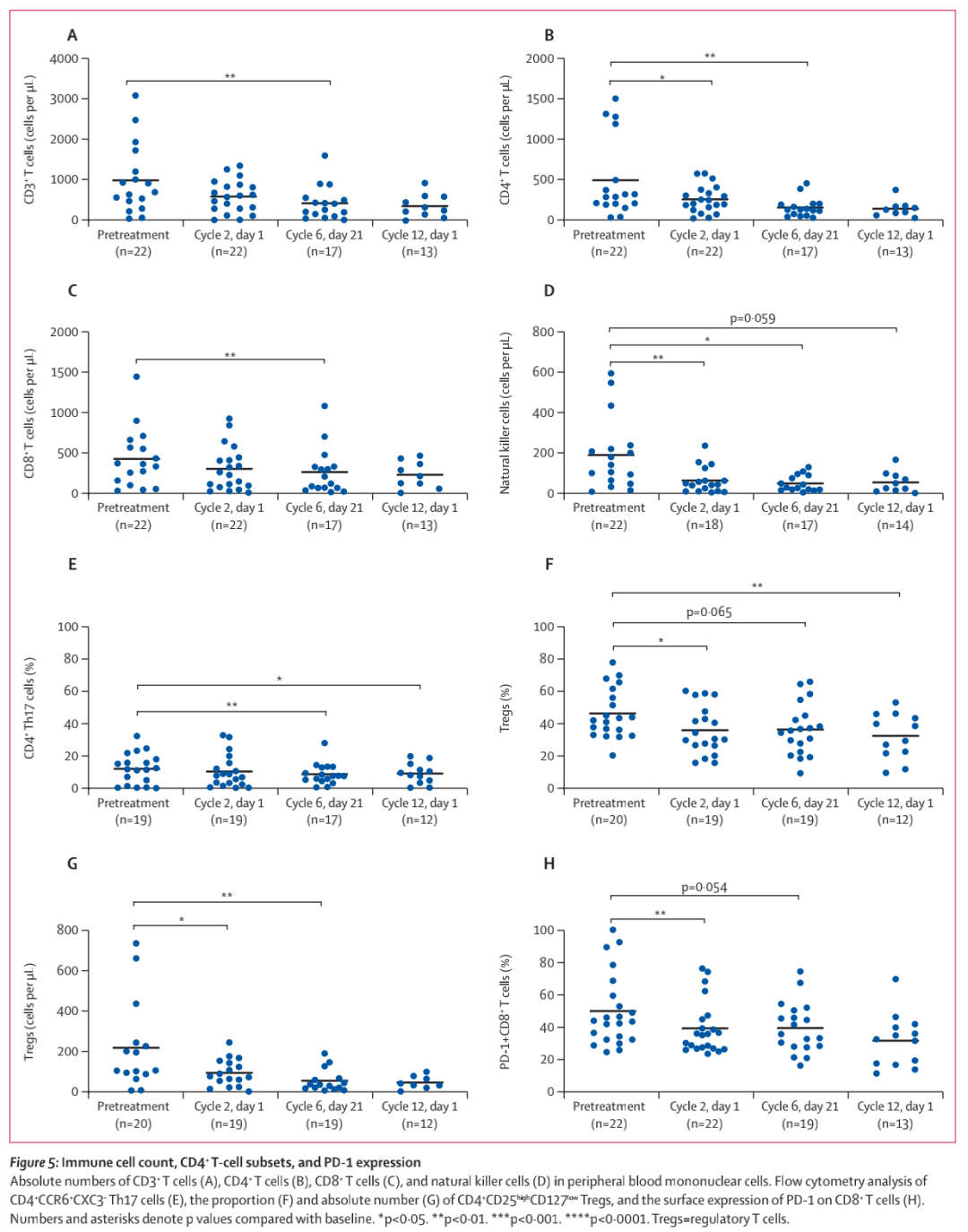
图5 免疫细胞计数、CD4+ T细胞亚群和PD-1表达
研究结论
阿替利珠单抗、维奈托克和奥妥珠单抗三联疗法被证明有效且安全,提示这一不含化疗的方案可能成为DLBCL-RT患者的新一线治疗方法。
参考文献
[1] Tedeschi, Alessandra et al. “Atezolizumab, venetoclax, and obinutuzumab combination in Richter transformation diffuse large B-cell lymphoma (MOLTO): a multicentre, single-arm, phase 2 trial.” The Lancet. Oncology vol. 25,10 (2024): 1298-1309. doi:10.1016/S1470-2045(24)00396-6.


