Nat Commun:中国科学院施剑林等团队合作研究设计了2-DG和DBG支架,用于增强癌症压电催化免疫治疗
时间:2024-10-22 11:00:25 热度:37.1℃ 作者:网络
纳米催化免疫疗法由于其快速激活免疫系统来攻击肿瘤细胞,在未来的癌症治疗中具有极好的潜力。然而,高水平的N-糖基化可以保护肿瘤细胞,损害纳米催化免疫治疗的抗癌免疫。
2024年10月18日,中国科学院施剑林、Wu Wencheng,同济大学周敏共同通讯在Nature Communications 在线发表题为“Ultrasound-triggered and glycosylation inhibition-enhanced tumor piezocatalytic immunotherapy”的研究论文,该研究设计了一个2-脱氧葡萄糖(2-DG)和铁酸铋共负载凝胶(DBG)支架,用于增强癌症压电催化免疫治疗。
DBG植入肿瘤后,在超声照射下同时产生活性氧(ROS)和压电信号,显著促进了抗癌免疫的激活。同时,从ROS敏感的DBG释放的2-DG破坏N-聚糖的合成,进一步克服肿瘤的免疫抑制微环境。超声触发和糖基化抑制增强肿瘤压电催化免疫治疗的协同效应在四种小鼠癌症模型上得到了证明。产生一个“热”肿瘤免疫生态位,抑制肿瘤进展和肺转移,并引发强烈的免疫记忆效应。研究为低免疫原性和高N-糖基化水平的恶性实体瘤提供了一种有前景的压电催化免疫治疗方法。

在过去的十年里,免疫疗法已经成为最有前途的癌症治疗策略之一。特别是,免疫检查点阻断(ICB)疗法已经成功地治疗了各种癌症,如黑色素瘤、肺癌和肾细胞癌。然而,由于肿瘤免疫抑制,导致细胞毒性T淋巴细胞(CTL)的肿瘤浸润受到限制,只有少数患者能从这种治疗中受益。因此,迫切需要制定有效的策略来提高免疫抑制肿瘤的免疫治疗应答率。
增强对癌症免疫反应的疗法在对抗恶性肿瘤方面是革命性的。最近,一类基于ROS的治疗方法使用压电纳米材料进行压电催化治疗(PCT)已经成为一种有前途的方案,可以增强对癌症的免疫反应。压电催化疗法利用压电纳米材料在超声照射下的极化作用产生具有电荷分离的局部电场。分离的电子和空穴迁移到纳米材料的相反侧,触发H2O氧化还原反应,产生细胞毒性ROS,如羟基自由基(·OH)和超氧阴离子(·O2−)。这类ROS能有效杀伤肿瘤细胞,诱导免疫原性细胞死亡(ICD),释放大量肿瘤相关抗原(TAAs),激活宿主的抗肿瘤免疫应答。此外,超声照射下压电催化剂产生的局部电信号可以显著促进肿瘤相关巨噬细胞(TAMs)的M1极化,从而激活先天免疫反应。因此,这种ROS生成策略不受恶劣肿瘤微环境(TME)如低浓度H2O2和缺氧的限制,与免疫治疗联合使用具有很大的潜力。然而,肿瘤免疫抑制微环境(ITME)可能会降低这种肿瘤杀伤效应的效果,从而损害抗癌免疫。
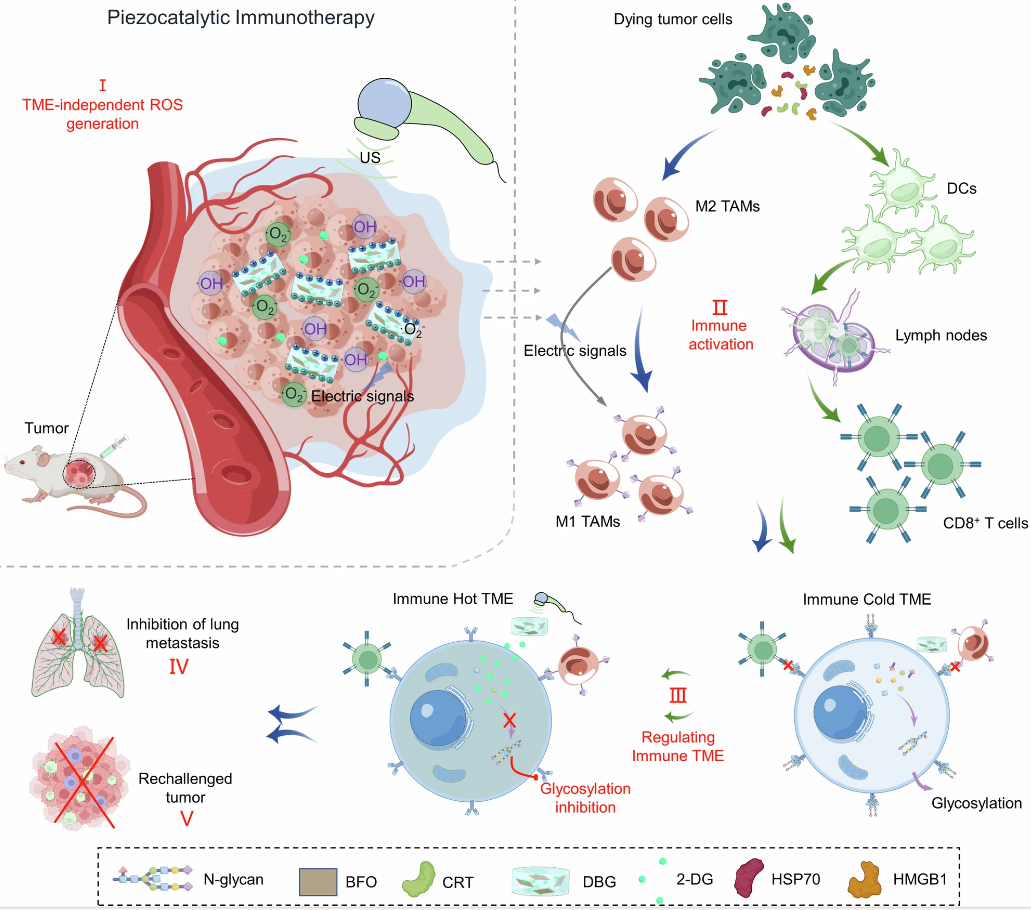
原位生成ROS和抑制肿瘤细胞糖基化的DBG扩增肿瘤压电催化免疫治疗(图源自Nature Communications )
恶性肿瘤的进展是由免疫系统对癌细胞的选择性压力引导的,导致肿瘤细胞变异的选择,这些变异可以从免疫活性宿主中存活/逃脱。以前的研究已经描述了肿瘤细胞逃避免疫监视的一些机制,包括免疫抑制检查点的表达,这为ICB治疗提供了机会。然而,对ICB免疫治疗的低应答率表明癌细胞可以通过其他免疫逃避机制逃避免疫识别。值得注意的是,肿瘤生长伴随着细胞聚糖的剧烈变化,通过异常糖基化观察到,特别是N-聚糖,包含两个N-乙酰氨基葡萄糖(GlcNAc)和三个甘露糖残基核心。这种不仅通过掩盖免疫细胞的表位或破坏其功能而损害免疫抗癌反应,而且还干扰免疫细胞对癌细胞的细胞内和细胞外靶向识别,最终导致肿瘤的免疫抑制。此外,癌细胞能够通过上调相关蛋白的N-糖基化水平来维持内质网蛋白的稳态,从而增加内质网折叠能力和内质网相关降解(ERAD),从而使免疫衍生的有毒蛋白(如颗粒酶)失活。因此,抑制肿瘤细胞的N-糖基化可能是一种方便而有效增强免疫抗肿瘤效果的策略。考虑到N-聚糖的核心含有大量的甘露糖残基,设想并证明了葡萄糖/甘露糖类似物2-脱氧-D-葡萄糖(2-DG)可以通过与甘露糖竞争并将其结合到新生糖蛋白的脂联低聚糖中,从而导致N-糖基化的中断。此外,由于肿瘤细胞的高代谢需求,2-DG可以安全地抑制N-聚糖的合成。因此,在肿瘤部位,压电催化剂和2-DG的协同作用可以在US照射下提供有效的癌症压电催化免疫治疗。
研究制备了具有高压电催化活性的二维BiFeO3 (BFO)纳米片,在US照射下有效地产生ROS,以激活抗癌免疫反应。为了克服ITME的屏障,设计了一种可注射的ROS敏感水凝胶支架(DBG),用于共同递送压电催化剂BFO和2-DG,以增强癌症压电催化免疫治疗。2-DG诱导的N-糖基化抑制可以有效逆转免疫抑制生态位,随后放大PCT介导的抗癌免疫。研究证明,BFOs负载的水凝胶支架可以通过诱导ROS介导的肿瘤细胞ICD和局部电刺激,在超声照射下同时显著促进细胞毒性T淋巴细胞的激活和肿瘤相关巨噬细胞的M1极化。重要的是,这种由压电催化触发的H2O氧化还原反应可以不受苛刻的TME限制而连续产生ROS。与持续的ROS触发的2-DG释放一起,N-糖基化可以被有效抑制,从而重塑ITME,随后通过根除原发肿瘤,抑制远处和扩散转移的进展,为治疗小鼠提供强大的长期免疫保护记忆,从而提供扩增的压电催化免疫治疗。
参考消息:
https://www.nature.com/articles/s41467-024-53392-1


