JHO:同济大学李砚东/高勇揭示了METTL16-SENP3-LTF轴赋予肝细胞癌抗铁死亡能力并促进其肿瘤发生
时间:2024-10-30 10:00:19 热度:37.1℃ 作者:网络
铁死亡以铁依赖性脂质过氧化为特征,由于其对肿瘤的敏感性,成为肝细胞癌(HCC)干预的有前景的途径。RNA N6甲基腺苷(m6A)修饰参与了几种类型的受调节细胞死亡。然而,m6A相关调节因子在HCC细胞铁死亡中的作用和分子机制尚不清楚。
2024年9月2日,同济大学李砚东及高勇共同通讯在Journal of Hematology & Oncology 在线发表题为“METTL16-SENP3-LTF axis confers ferroptosis resistance and facilitates tumorigenesis in hepatocellular carcinoma”的研究论文,该研究揭示了一个新的METTL16-SENP3-LTF信号轴,它调节铁死亡并驱动HCC的发展。靶向这一轴是一种有前景的策略,用于增敏铁死亡和对抗HCC。
通过检测一系列m6A修饰酶在铁死亡诱导或抑制下的作用,研究确定METTL16是HCC细胞中一种新型的铁死亡阻遏物。METTL16的高表达赋予HCC细胞和小鼠模型对铁蛋白沉积的抗性,并促进细胞存活和肿瘤进展。从机制上讲,METTL16与IGF2BP2合作,以m6A依赖的方式调节SENP3 mRNA的稳定性,后者通过去SUMO化阻碍蛋白酶体介导的乳铁蛋白(LTF)泛素化降解。升高的LTF表达有助于游离铁的螯合,降低易感铁库水平。SENP3和LTF与METTL16介导的HCC进展和体内外抗铁死亡作用有关。临床上,METTL16和SENP3的表达呈正相关,METTL16-SENP3的高表达预示着人类HCC样本的预后不良。

肝细胞癌(HCC)是一种全球流行的恶性肿瘤,以其显著的发病率和死亡率而闻名。几十年来,利用酪氨酸激酶抑制剂(TKIs)的系统治疗已成为晚期HCC管理的基础。索拉非尼是美国食品药品监督管理局(FDA)批准的第一种用于治疗恶性HCC的开创性TKI,已被发现通过抑制系统Xc-和提高细胞内铁水平来诱导铁死亡,部分解释了其抗癌作用。研究表明,在肝肿瘤微环境中观察到的癌症细胞的代谢活性显著增强,其特征是氧化应激升高、高活性氧(ROS)负荷和对铁的依赖增加,这增强了索拉非尼等铁死亡诱导剂根除肿瘤细胞的功效。
由广泛的铁依赖性脂质过氧化引发的调节性细胞死亡,称为铁死亡,作为一种内在的肿瘤抑制因子,在恶性肿瘤中起着至关重要的作用,引起了人们的广泛关注。有趣的是,间充质和去分化的癌症细胞通常对细胞凋亡和常规治疗具有抵抗力,表现出对铁死亡的显著易感性,这表明它们有望成为难治性癌症的治疗策略。最近的研究揭示了HCC中脱铁症的调节机制和癌症意义。就铁死亡相关的氧化还原系统调节而言,ATF4和USP8已被证明可以上调SLC7A11的转录表达并减少SLC7A11 GlcNA酰化,从而通过Xc-GS-GPX4轴调节氧化还原平衡以调节铁死亡。关于脂质代谢调节,非常规预折叠蛋白RPB5相互作用物(URI)通过重新编程与硬脂酰辅酶A去饱和酶1(SCD1)相关的脂质代谢来改善TKI诱导的铁死亡。然而,通过铁代谢调节铁死亡的研究仍然相对有限,铁代谢是另一个关键的调节因子。
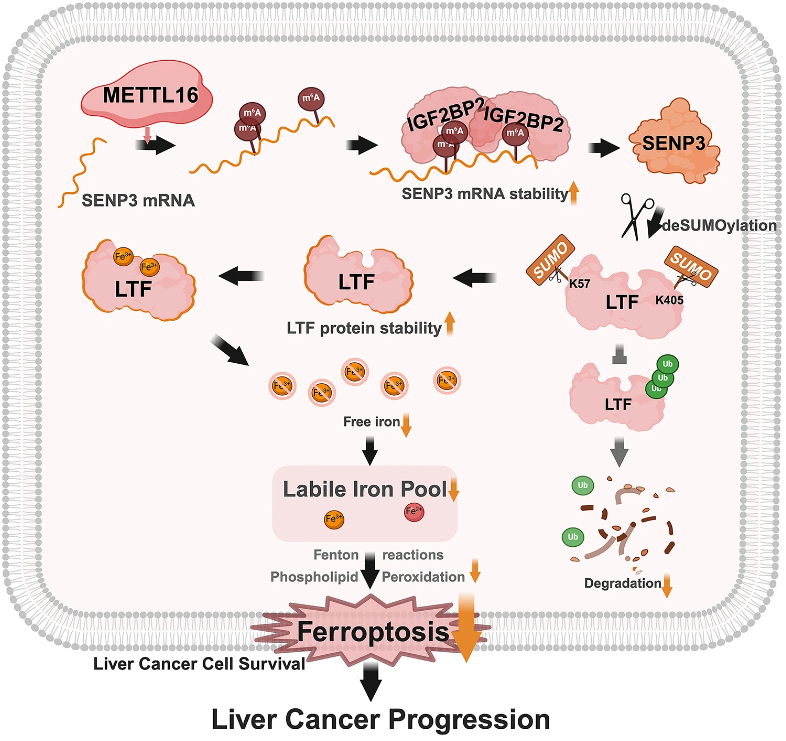
METTL16-SENP3-LTF轴赋予肝癌细胞对铁死亡的抵抗力并促进肿瘤发生(图源自Journal of Hematology & Oncology )
N6甲基腺苷(m6A)甲基化代表了真核mRNA中主要的转录后修饰,由催化m6A沉积的m6A甲基转移酶(“Writer”)、促进m6A去除的去甲基化酶(“Eraser”)和识别和结合m6A基序的RNA结合蛋白(“Reader”)控制,在mRNA剪接、衰变、稳定性、翻译和核输出的调节中起着重要作用。癌症中m6A相关调节因子的异常表达与肿瘤发展有关,最近引起了相当大的关注。靶向RNA修饰的干预措施已证明在破坏肿瘤细胞存活方面的有效性,从而为癌症治疗提供了新的途径。继经典的METTL3/14甲基转移酶之后,METTL16最近被确定为第二个m6A “Writer”,通过修饰特定的RNA底物在各种癌症中显示出致癌或肿瘤抑制作用。值得注意的是,在HCC中,METTL16通过m6A修饰长非编码RNA(lncRNAs)参与肿瘤发生,影响其转录稳定性和降解。此外,METTL16作为翻译起始因子表现出m6A非依赖性功能,有助于其促致癌作用。然而,关于METTL16在HCC中以m6A依赖方式调节的下游mRNA靶点的数据仍然很少。
研究探讨了m6A去甲基化酶和甲基转移酶在调节铁死亡和HCC发展中的作用。随后,METTL16被筛选并确定为关键候选者。研究阐述了METTL16通过催化SENP3(一种氧化还原敏感的SUMO2/3特异性蛋白酶)的mRNA m6A修饰在铁死亡和肿瘤发生中起着关键作用,后者调节HCC细胞内乳铁蛋白(LTF)的稳定,从而抑制铁死亡,导致疾病进展和不良临床结果。这些发现提供了一种新的METTL16-SENP3-LTF调节轴,可以抑制铁死亡并促进HCC的发展,突显了靶向该轴作为该疾病潜在治疗策略的重要性。
参考消息:
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-024-01599-6


