滕皋军院士:肝癌介入治疗的几个热点问题
时间:2024-10-31 12:00:21 热度:37.1℃ 作者:网络
前言
肝癌是严重威胁人类健康的恶性肿瘤,尤其在我国,2022年新发和死亡病例分别达到36.77万例和31.65万例,在所有恶性肿瘤中排名第四和第二位。我国有73%的肝癌病人在首次诊断时已处于中晚期,失去了接受根治性治疗的机会。
肝癌介入治疗在中晚期肝癌的管理中具有重要地位,涵盖了经动脉化疗栓塞(TACE)、选择性内放疗(SIRT)、经肝动脉灌注化疗(HAIC)、射频消融(RFA)、微波消融(MWA)、冷冻消融(CSA)等多种技术。这些技术的合理应用能够在不同分期的肝癌治疗中发挥关键作用。近日,东南大学附属中大医院滕皋军院士分享了《肝癌介入治疗的几个热点问题》。肝癌在线特将精华部分整理成文,以飨读者。
一、概述
原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和混合型肝细胞癌‑胆管细胞癌(CHC)3种,其中HCC占75%~85%,ICC占10%~15%。1976年,美国Wallace医师报道了经导管肝动脉明胶海绵栓塞术治疗肝癌,随后日本医师应该碘化油加明胶海绵栓塞化疗术(TACE)并在全球广泛应用。
20世纪80年代,随着数字减影血管造影(DSA)设备以及微导管等新器械的发展,肝癌介入治疗技术得到快速发展。随后,载药微球、钇90(90Y)放射性微球等新技术不断涌现,使经血管的肝癌治疗技术日趋成熟。进入21世纪后,肿瘤射频消融(RFA)、微波消融(MWA)、冷冻消融(CSA)等消融技术,以及125I放射性粒子植入技术广泛应用,开启了非血管性介入治疗快速发展的时代。
二、几项肝癌介入治疗新技术
1
钇90微球选择性内放射治疗
钇90微球内照射(SIRT,或TARE)治疗肝癌源于七十年代,九十年代也曾在我国进行临床研究。随着产品的完善和研究的进展,终于成为治疗肝癌(包括转移性肝癌)的重要技术。
钇90微球的作用机制主要是通过选择性插管方式将载有放射性核素钇90的微球注射到靶区域,钇90发射的纯β射线产生的电离辐射引起肿瘤组织不可逆损伤,导致肿瘤坏死,从而达到控制肿瘤的目的。
钇90的优势包括发射纯β射线,能量高半衰期短,体内穿透距离短易于防护;稳定性好,衰变产物无危害性,两周内释放95%的能量;生物相容性好,能与递送载体稳定结合等。
钇90的治疗流程如图1所示,相比于其他的介入治疗,术前评估更为复杂,尤其是在剂量的计算上。在兼顾安全性基础上,肿瘤吸收剂量与病理完全坏死率、肿瘤反应率及组织学应答均呈正相关。因此要在最大限度增加肿瘤细胞辐射剂量(保证效果)的同时,最大限度减少正常细胞的辐射剂量(保障安全)[1]。
选择钇90治疗前要先进行肝肺分流的评估,常于肝动脉造影结束后,将99mTc-MAA(锝-99m聚合白蛋白)由肝动脉直接注入后进行SPECT扫描获得99mTc-MAA的分布,然后计算出肺分流的百分比。在此操作中同时可以观察是否存在侧枝血管分流。
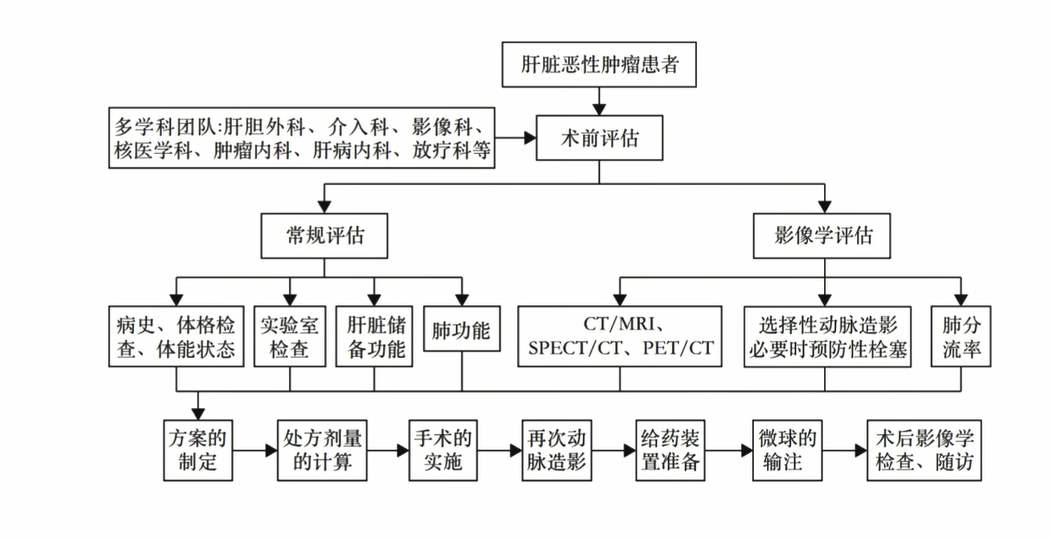
图1. 钇90的治疗评估流程
目前的钇90微球包括三种:
1)钇90树脂微球,已在国内应用于临床;
2)钇90玻璃微球,已完成治疗肝细胞癌适应证的临床试验(PI-滕皋军);
3)钇90炭微球,为我国的自主创新产品,已完成治疗肝癌临床试验I/II期临床试验(PI-滕皋军)。
SIRT治疗原发性肝癌的单中心RCT临床研究显示总生存率显著优于传统的介入治疗。在肠癌肝转移方面,一项研究[2]纳入了来自北美、欧洲和亚洲95个中心的428名患者,被随机分配接受联合或不联合钇90的化疗。
结果显示钇90组和化疗组的客观缓解率分别为34.0%(95%CI,28.0至40.5)和21.1%(95%CI,16.2至27.1;单侧P=0.0019)。在晚期肝细胞癌的治疗中,个体化剂量(≥250Gy)组明显优于标准剂量(120士20Gy)组。总体而言,只要技术精湛,适应证选择恰当,SIRT治疗肝癌具有较大的优势,包括缩瘤的效果和中远期疗效;当剂量达到一定程度,甚至可以起到根治性的效果。此外,其显著降期和对余肝的代偿效果,为后续手术转化治疗提供了更多的机会。
病例一:80岁,男性,HCC,PIVKA-1136671(mAu/ml)。钇90治疗前后影像学检查如图2所示。
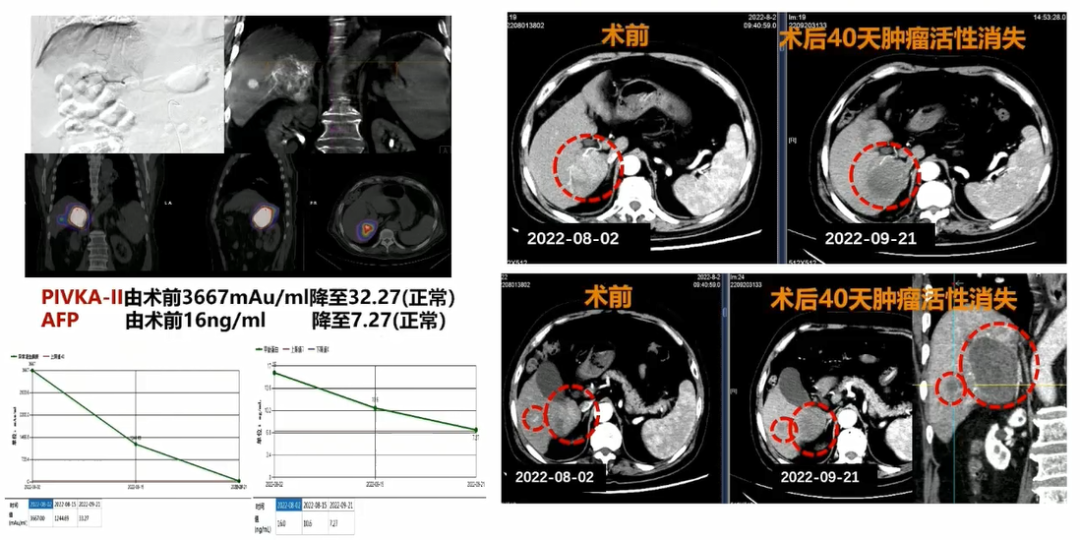
图2. 病例一患者钇90治疗前后影像学检查
病例二:男,50岁,直肠癌术后3年余,发现肝转移1月。钇90治疗前后影像学检查如图3所示。
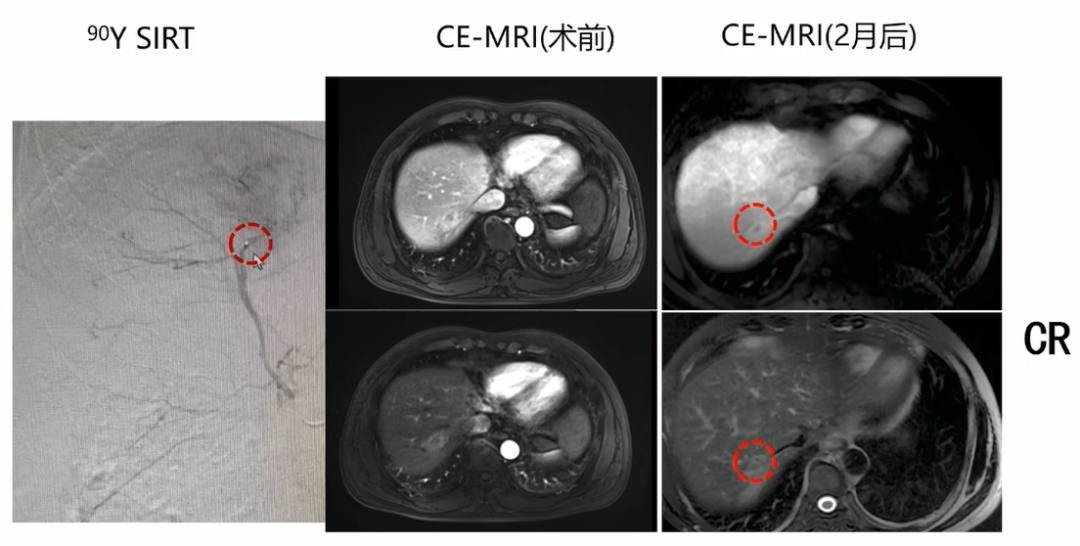
图3. 病例二患者钇90治疗前后影像学检查
除强效缩瘤外,钇90还具有增大余肝的作用。病例三患者64岁,男性,发现AFP升高20天,肝占位17天,MR增强示肝S8异常强化灶,考虑HCC;肝S3、S6结节,考虑高度不典型增生结节(HGDN)或早小HCC可能。Child Pugh A;ECOG-PS 0分。使用国产的钇90炭微球一次手术,同步治疗3个病灶,治疗前后影像学检查如图4所示。
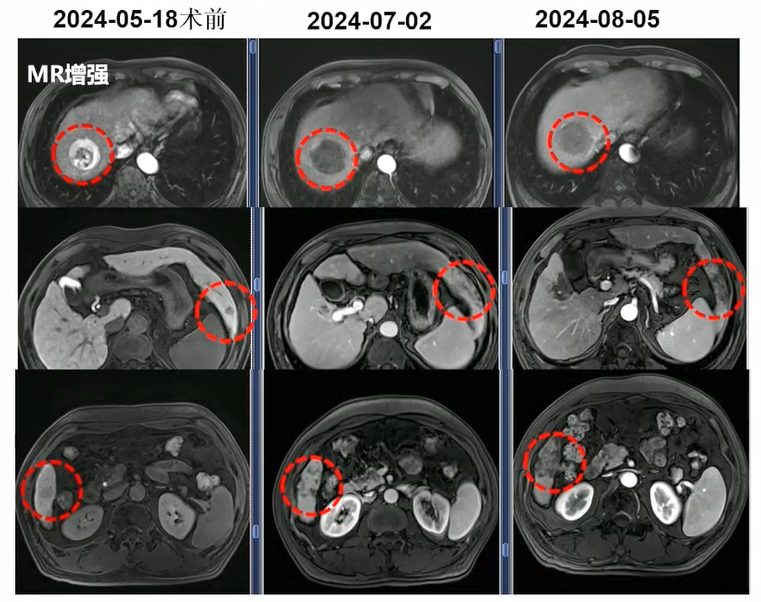
图4. 病例三患者钇90治疗前后影像学检查
2 原创性的系列125I粒子支架的研发与应用
原创性的系列125I粒子支架的研发与应用由滕皋军院士团队首创,自2003年完成首例125I粒子食管支架植入术,并发表于Lancet Oncology[3]和Radiology[4]上,随后,通过对植入器械的改型,成功地应用于治疗恶性胆道梗阻,首个单中心随机对照研究就显示了显著的优越性,内照射支架组的平均总生存期达8.03个月,而对照组为3.36个月。此外,与支架置入相关的并发症在两组之间没有显著性差异。首个研究于2012年3月在线发表在《Journal of Hepatology》上[5]。
为了进一步证实该新型内照射支架的有效性,于2013~2016完成了一项由20家医院参加的前瞻性、多中心随机对照研究,该研究共入组328例胆道恶性梗阻患者,主要研究终点为支架通畅率,次要研究终点为生存时间(OS)、安全性等。结果显示:包括通畅率和OS等都显著优于对照组,内照射支架组的中位生存时间达202天,对照组为140天,其中原发性胆管癌的OS达257天,显著优于对照组的183天;而胰腺癌达197天,优于对照组的138天[6]。
该支架系统不仅用于胆道,也应用于治疗肝癌门静脉癌栓(图5)。为了验证其有效性,滕皋军团队发起一项前瞻性多中心随机对照研究,对肝癌伴Vp3/Vp4门静脉癌栓患者进行治疗。结果显示其中位生存期达9.9个月,显著优于对照组的6.3个月[7]。
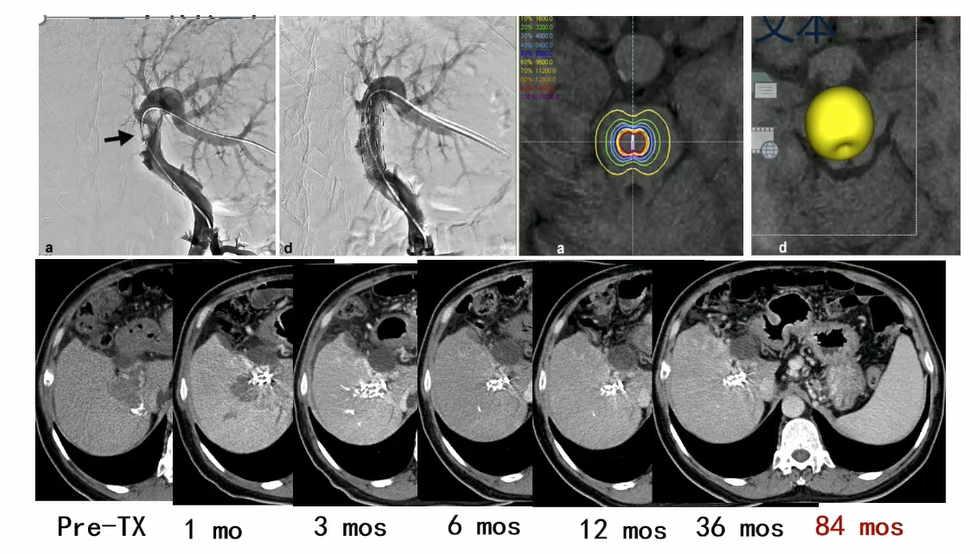
图5. 125I粒子支架治疗肝癌门静脉癌栓
三、TACE的规范化/精细化/HAIC
以TACE为代表的介入技术已近半个世纪,仅在我国,每年完成的TACE数量就达60~80例次。然而,多项调查研究表明,我国各地乃至同一家医院的TACE技术变异度较大,质控不足。为推动肝癌规范化诊疗的质控工作,提升TACE治疗肝癌的有效率。中国医师协会介入医师分会已连续颁布了TACE指南,该指南的核心是倡导精细TACE,国家卫健委《原发性肝癌诊疗指南》也写入精细TACE的概念。精细TACE的核心是栓塞终点,也包括采用先进的器械如微导管,先进的设备如CBCT和血管导航功能等;同时,对介入医师的培训也至关重要。
HAIC即经肝动脉化疗术,比TACE的历史更久,只是数十年前缺乏合适的化疗药物。近年来,以中国医师为代表的学者通过多项随机对照研究将HAIC推向了热潮,尤其是HAIC联合靶免诊疗、联合TACE序贯治疗等获得了越来越多的关注。必须指出的是,HAIC也有特定的适宜人群。日本和我国学者对HAIC提出了相关适应证:
1)肿瘤负荷过大;
2)多次TACE无效;
2)肝癌合并门静脉主干癌栓;
3)肝外转移;
4)巨大肿瘤且拒绝/不适合切除;
5)拒绝系统治疗的晚期HCC。
四、肝癌的介入与靶向免疫联合治疗
靶向联合免疫治疗肝癌是近年来最重要的进展之一,为肝癌的系统治疗展示了光明的前景。但是,现阶段的靶向免疫并非适合所有HCC患者。从III期IMbrave150、ORIENT-32和HIMALAYA研究的患者入组标准和排除标准来看,免疫联合疗法一线治疗适用人群仍有限(图6)。
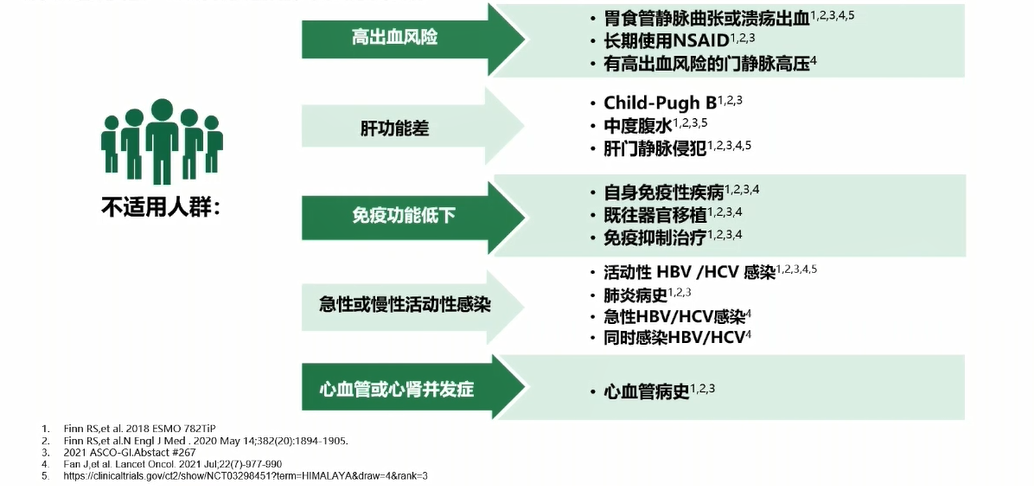
图6. 免疫治疗不适用人群
通过介入治疗增强肿瘤对免疫治疗的应答率,即将对免疫治疗无效的“冷肿瘤”转化为对免疫治疗有效的“热肿瘤”,是近年来的研究热点。介入与靶向/免疫有协同增效的机制可能涉及介入治疗后的大面积肿瘤坏死组织激活各种抗肿瘤免疫细胞亚群;和/或抑制具有促肿瘤活性的免疫细胞类型等多个层次。
滕皋军院士团队牵头的CHANCE001[8]是目前为止关于经动脉化疗栓塞(TACE)联合免疫及靶向药物治疗HCC全国多中心、全球样本量最大的真实世界研究。纳入的HCC患者覆盖全国22个省市的59家三甲医院。该研究入组2018年01月至2021年5接受TACE联合PD-(L)1抑制剂及MTA治疗的HCC患者(实验组,最低入组要求为271例),同期纳入接受TACE而未接受PD-(L)1抑制剂及分子靶向药物(MTA)治疗的HCC患者(对照组)。初步筛选患者1142例,按照研究方案进行纳排和匹配,最终实验组和对照组分别纳入228例进行分析。
研究结果显示:联合治疗组的中位PFS为9.5个月,显著优于单TACE治疗组的8.0个月,HR及95%CI为0.70(0.56-0.88),P=0.002。联合组中位OS为19.2个月,单TACE治疗组中位OS为15.7个月,HR及95%CI为0.63(0.47-0.83),P =0.001。联合治疗组和单TACE组的客观缓解率(ORR)分别为60.1%和32.0%(P<0.001)。该研究表明与单纯TACE相比,TACE联合PD-(L)1抑制剂联合MTA显著改善了以晚期HCC为主的患者的PFS、OS和ORR,并且具有可接受的安全性。
虽然TACE治疗BCLC C期晚期肝癌在我国和多数亚太地区广泛应用,但BCLC指南为首选药物治疗,基于临床显而易见的TACE联合靶免治疗对晚期肝癌患者的生存获益,滕院士与任正刚教授共同牵头发起了CHANCE2201研究[9],是一项比较TACE联合PD-I/PD-LI抑制剂及抗血管生成药物与单纯PD-I/PD-LI抑制剂及抗血管生成药物一线治疗晚期肝细胞癌有效性及安全性的全国多中心真实世界研究。该研究共纳入1244例接收了一线靶免药物联合/不联合TACE治疗的晚期肝癌患者,覆盖30个省、市65家三甲医院。
研究结果显示:TACE联合靶免治疗组的中位OS为22.6个月,显著优于单纯靶免治疗组的15.9个月,中位PFS为9.9个月对比7.4个月。TACE联合靶免治疗组和单纯靶免治疗组的ORR分别为41.2%和22.9%。该研究表明与单纯靶免治疗相比,TACE联合靶免治疗显著改善了晚期肝癌患者的OS、PFS和ORR,并且具有可接受的安全性。该项研究为《国家卫健委原发性肝癌诊疗规范2024版》将TACE/TACE+靶免系统治疗作为CNLC IIIa期肝癌的首选奠定了坚实的基础。
五、肝癌介入治疗的未来
由于我国肝癌病人数量庞大,尤其中晚期肝癌病例较多,同时我国介入医师不仅具有每天铅衣负重,且富有创新精神,已逐渐形成了独特的创新之路。最近,滕皋军团队研发了国际首台人机交互的可进行放射学粒子植入和活检消融术的介入机器人,他们还开启了多项能改变肿瘤局部免疫微环境的新型微球的临床试验。更令人振奋的是,滕院士团队采用自行研发的血管内消融设备进行交感神经消融,即通过神经调节治疗代谢性疾病和恶性肿瘤也渐露曙光。相信,未来一定会越来越多源于中国的药械与技术应用于临床。
参考文献
1. The Lancet Gastroenterology H. USPSTF recommends expansion of colorectal cancer screening. Lancet Gastroenterol Hepatol 2021; 6(1):1.
2. Mulcahy MF, Mahvash A, Pracht M, Montazeri AH, Bandula S, Martin RCG, 2nd, et al. Radioembolization With Chemotherapy for Colorectal Liver Metastases: A Randomized, Open-Label, International, Multicenter, Phase III Trial. J Clin Oncol 2021; 39(35):3897-3907.
3. Zhu HD, Guo JH, Mao AW, Lv WF, Ji JS, Wang WH, et al. Conventional stents versus stents loaded with (125)iodine seeds for the treatment of unresectable oesophageal cancer: a multicentre, randomised phase 3 trial. Lancet Oncol 2014; 15(6):612-619.
4. Zhong BY, Ni CF, Chen L, Zhu HD, Teng GJ. Early Sorafenib-related Biomarkers for Combination Treatment with Transarterial Chemoembolization and Sorafenib in Patients with Hepatocellular Carcinoma. Radiology 2017; 284(2):583-592.
5. Zhu HD, Guo JH, Zhu GY, He SC, Fang W, Deng G, et al. A novel biliary stent loaded with (125)I seeds in patients with malignant biliary obstruction: preliminary results versus a conventional biliary stent. J Hepatol 2012; 56(5):1104-1111.
6. Zhu HD, Guo JH, Huang M, Ji JS, Xu H, Lu J, et al. Irradiation stents vs. conventional metal stents for unresectable malignant biliary obstruction: A multicenter trial. J Hepatol 2018; 68(5):970-977.
7. Lu J, Guo JH, Ji JS, Li YL, Lv WF, Zhu HD, et al. Irradiation stent with 125 I plus TACE versus sorafenib plus TACE for hepatocellular carcinoma with major portal vein tumor thrombosis: a multicenter randomized trial. Int J Surg 2023; 109(5):1188-1198.
8. Zhu HD, Li HL, Huang MS, Yang WZ, Yin GW, Zhong BY, et al. Transarterial chemoembolization with PD-(L)1 inhibitors plus molecular targeted therapies for hepatocellular carcinoma (CHANCE001). Signal Transduct Target Ther 2023; 8(1):58.
9. Jin ZC, Chen JJ, Zhu XL, Duan XH, Xin YJ, Zhong BY, et al. Immune checkpoint inhibitors and anti-vascular endothelial growth factor antibody/tyrosine kinase inhibitors with or without transarterial chemoembolization as first-line treatment for advanced hepatocellular carcinoma (CHANCE2201): a target trial emulation study. EClinicalMedicine 2024; 72:102622.


