西安建大/西工大AFM:水凝胶,实现抗菌、电疗和伤口监测!
时间:2024-11-04 06:01:34 热度:37.1℃ 作者:网络
新型软体生物电子材料的设计与制造对于加速伤口愈合和实现实时监测的智能医疗具有重要意义。然而,由于制造过程的动态特性和感应界面问题,开发此类集成多功能材料设备仍然面临挑战。在此,西安建筑科技大学周元臻/杨琴&西北工业大学李剑利提出了一种创新策略,通过双金属酚网络加速水凝胶的动力学,实现抗菌、电疗和伤口监测功能的整合。Al3+能够催化丙烯酸的自由基共聚反应,使系统在10秒内凝胶化,同时还催化银与木质素的氧化还原反应,诱导持续释放儿茶酚,显著增强水凝胶的抗菌活性并缩短伤口愈合过程。同时,大量非共价相互作用增强了水凝胶的组织粘附性和机械性能(拉伸强度为1.558 MPa,伸长率为1563%)。此外,双金属离子赋予水凝胶优异的感应特性。在电刺激的协同作用下,伤口愈合速度加快。值得注意的是,通过监测伤口表面电信号的变化可以进行伤口评估,从而帮助医生和患者实现智能化伤口管理。这项研究为多功能智能生物电子材料的设计和应用提供了新的见解。该研究以题为“High Antimicrobial Electrotherapy and Wound Monitoring Hydrogel with Bimetal Phenolic Networks for Smart Healthcare”的论文发表在《Advanced Functional Materials》上。

图1展示了双金属酚醛网络基自粘附、刚性、抗菌和导电PALA水凝胶的设计策略,包括通过Ag-Lig-Al3+动态氧化还原系统触发的水凝胶凝胶化过程、Ag-Lignin NPs的核壳结构及其元素分布、PALA水凝胶结构的SEM和EDS图谱以及PAA、PAL和PALA水凝胶的FTIR和XRD分析。这些结果表明,Al3+能够快速促进含有Ag-Lignin NPs的水凝胶形成,并且在没有光或热的条件下在25°C下构建双金属酚醛网络结构,同时通过FTIR和XRD分析确认了PALA水凝胶中形成的配位复合物,揭示了水凝胶网络结构的致密性和元素的均匀分布,为后续的水凝胶性能研究提供了基础。
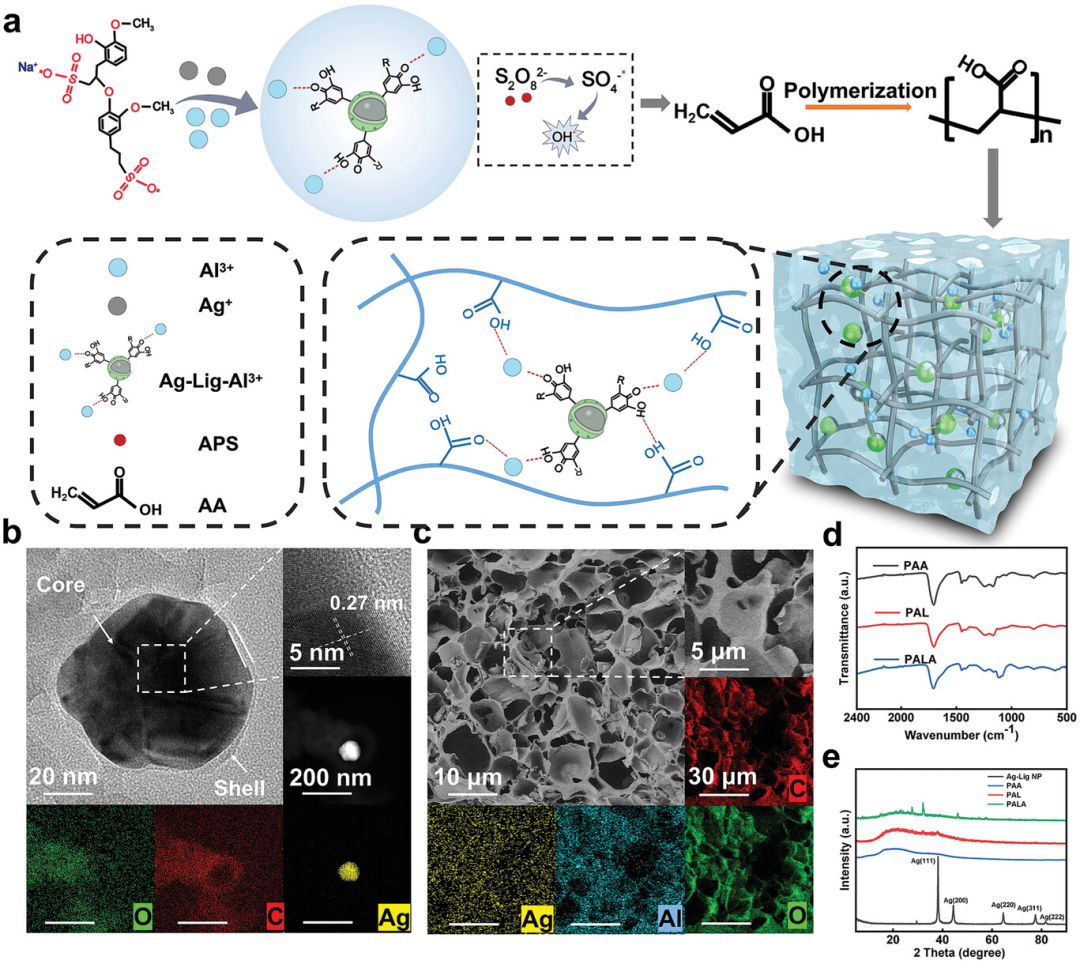
图1. 双金属酚醛网络基自粘附、刚性、抗菌和导电PALA水凝胶的设计策略
【水凝胶的机械稳定性】
图2展示了水凝胶的机械稳定性,包括不同Ag-Lig NP含量的PAL水凝胶、不同Al3+含量的PALA水凝胶以及PAA、PAL12.5、PAL5A20和PAL12.5A20水凝胶的拉伸应力-应变曲线,以及PALA水凝胶在循环拉伸/卸载过程中的力学性能和不同湿度条件下的力学特性。研究结果表明,Al3+的加入显著提高了水凝胶的机械性能,PALA水凝胶的断裂强度和断裂应变分别达到了1.558 MPa和1563%,与PAA水凝胶相比,断裂强度提高了187倍,断裂应变提高了13倍。这些增强的机械性能归因于金属-配体和氢键之间的协同效应,这些相互作用在拉伸过程中充当“牺牲键”以耗散能量,从而提高了水凝胶的应力-应变性能。此外,PALA水凝胶还表现出良好的韧性、压缩和抗穿刺性能,以及在不同湿度环境下的力学性能稳定性,说明了Al3+对提高PALA水凝胶机械稳定性的重要性。
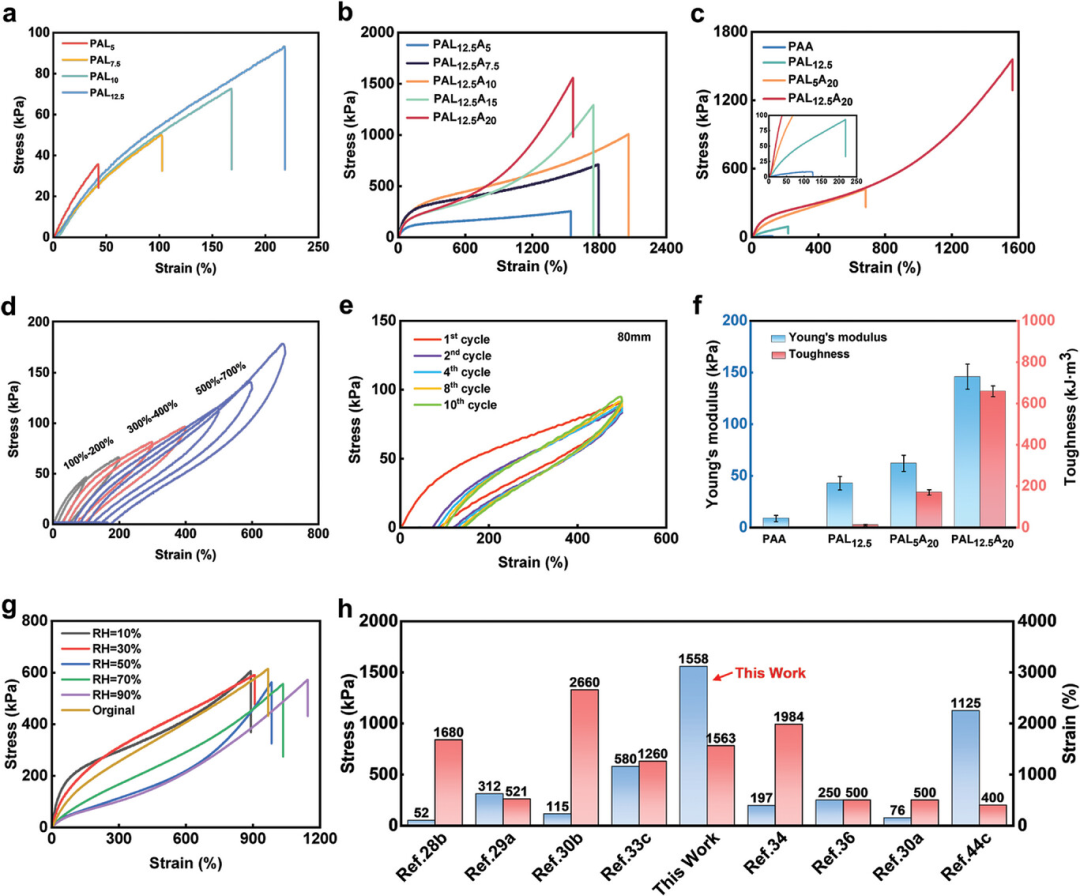
图2. 水凝胶的机械稳定性
【水凝胶的粘附性能】
图3探讨了水凝胶的粘附性能,包括PALA水凝胶对不同材料(如聚乙烯、聚四氟乙烯、玻璃和金属等)以及生物组织(如心脏、肺、肾脏、脾脏、肝脏和肌肉)的粘附能力。实验结果显示,PALA水凝胶能够在空气和水中对多种基材展现出长期和可重复的粘附性,且在猪皮上能支撑起700克的重量,表明其具有强大的粘附强度。通过剥离实验定量测试了水凝胶的粘附强度,发现随着Ag-Lig含量的增加,粘附强度增加,而Al3+含量的增加则先增加后减少粘附强度,7.5 wt.% Al3+时达到最大粘附强度49.8 kPa。此外,PALA水凝胶在30次皮肤粘附循环后仍保持良好的粘附性能,且能够在不留下残留物或引起过敏反应的情况下从人体皮肤上剥离下来,这对未来在生物医学、柔性电子等领域的实际应用具有重要意义。总体而言,PALA水凝胶因其出色的粘附性能,有望在生物医学和柔性电子设备中得到应用。
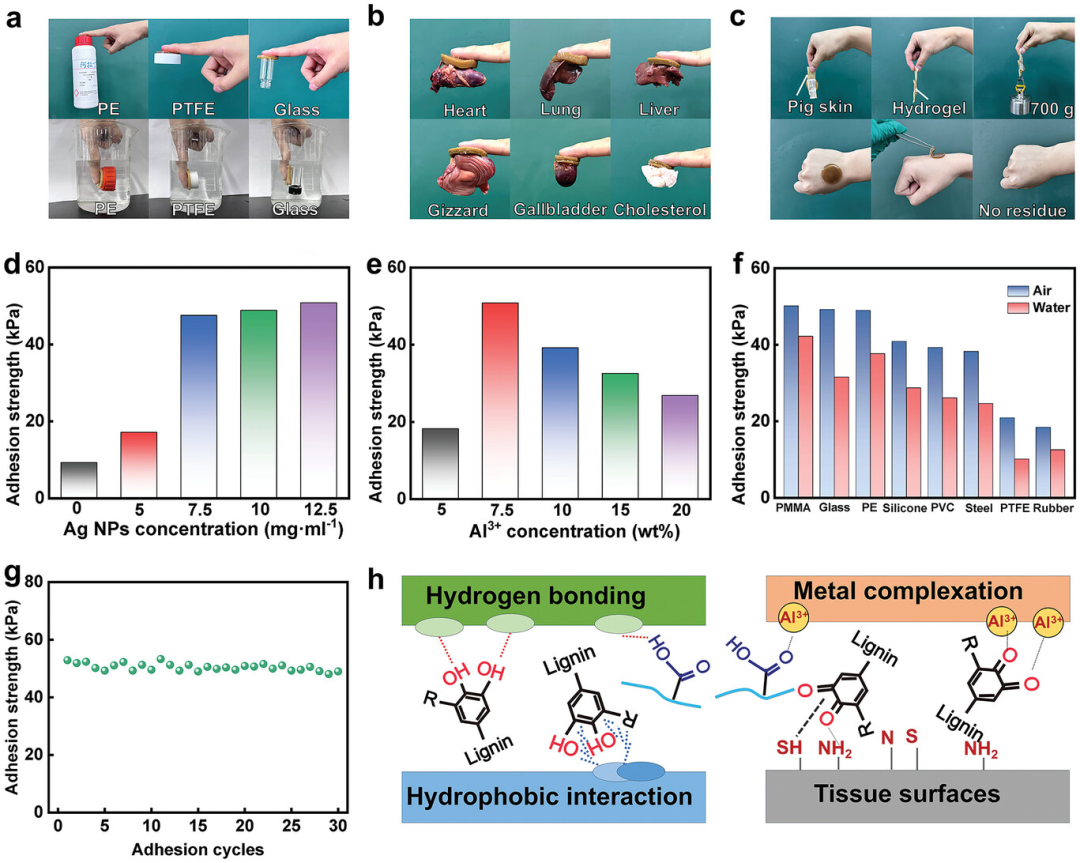
图3. 水凝胶的粘附性能
【水凝胶的体外抑菌性和生物相容性】
图4展示了PALA水凝胶的抗菌性能及其体外生物相容性,包括对大肠杆菌的抗菌活性测试、抗菌圈直径的测量、与PAL和PALA水凝胶共培养的皮肤成纤维细胞(HSF)的细胞活力测试。实验结果表明,含有Ag-Lig NPs和Al3+的PALA水凝胶展现出最强的抗菌效果,其抑制区域直径最大,证实了双金属酚醛网络水凝胶具有显著的协同抗菌活性。同时,通过CCK-8方法评估的细胞毒性实验显示,PAL和PALA水凝胶的提取物对HSF细胞活性的影响较小,即使在提取物浓度达到100%时,HSF细胞活性仍超过80%,表明这两种水凝胶具有低细胞毒性。综上所述,PALA水凝胶不仅具有优异的抗菌性能,而且具有良好的生物相容性,这为将其应用于伤口敷料和生物电子设备提供了科学依据。
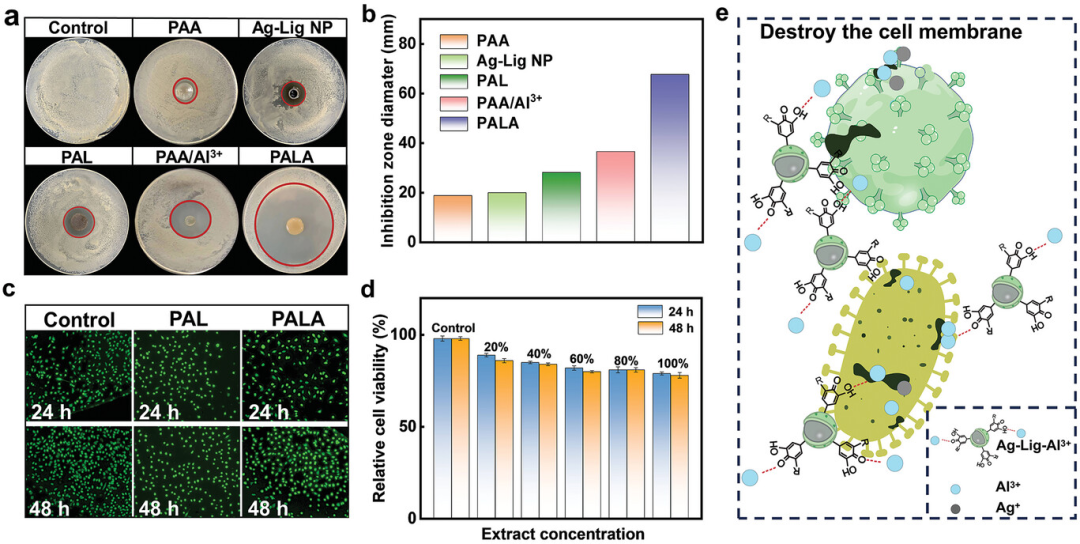
图4. 水凝胶的体外抑菌性和生物相容性
【Al3+增强水凝胶的机制】
图5探讨了Al3+增强水凝胶的机制,包括电子自旋共振光谱(ESR)检测醌自由基、PALA水凝胶的XPS光谱分析、PALA水凝胶的循环伏安(CV)测试结果以及Al3+加速丙烯酸自由基聚合和参与Ag-Lig氧化还原反应的示意图。实验结果表明,Al3+能够部分还原为Al2+,并通过加速APS激活效率,促进丙烯酸自由基的快速聚合,从而加快水凝胶的形成。同时,Al3+的存在加速了Ag-Lig中儿茶酚/醌的动态氧化还原反应,这通过CV测试中增加的氧化还原峰强度和曲线下面积得到证实,表明Al3+显著提高了水凝胶中氧化和还原物质的量,从而增强了水凝胶的抗菌性能。因此,Al3+不仅在水凝胶的制备阶段通过加速初级自由基的形成来加速水凝胶的形成,而且在使用过程中通过加速儿茶酚/醌的动态氧化还原反应来增强水凝胶的抗菌活性。
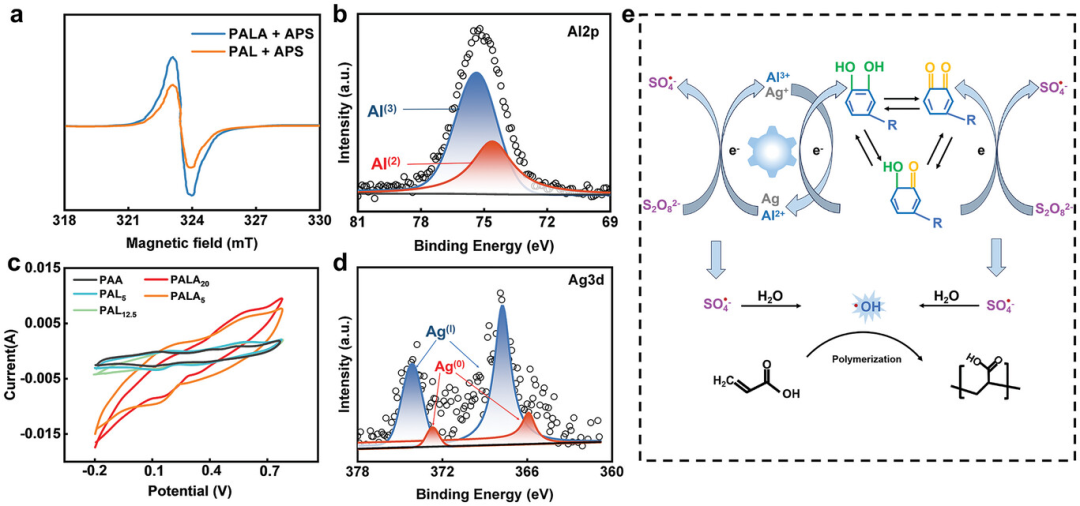
图5. Al3+增强水凝胶的机制
【水凝胶用于整合抗菌、电疗和伤口监测】
图6展示了PALA水凝胶在整合抗菌、电疗和伤口监测方面的应用,包括小鼠金黄色葡萄球菌伤口模型的建立和PALA水凝胶促进伤口愈合效果的评估、伤口闭合情况的追踪、相对电阻变化的监测、不同拉伸下的灵敏度系数变化、以及伤口愈合过程中电阻值的变化和伤口恢复指数的计算。实验结果表明,PALA水凝胶能够显著加速小鼠伤口的愈合过程,与对照组相比,使用PALA水凝胶的小鼠伤口愈合率更高,且在电刺激(ES)的辅助下,伤口愈合率进一步提升。此外,PALA水凝胶作为一种柔性传感器,能够通过监测电阻的变化来实时跟踪伤口愈合过程,显示出良好的动态稳定性和高灵敏度。因此,PALA水凝胶不仅在抗菌和促进伤口愈合方面表现出色,还能作为有效的电疗和伤口监测平台,为智能医疗设备的设计和应用提供了新的可能性。
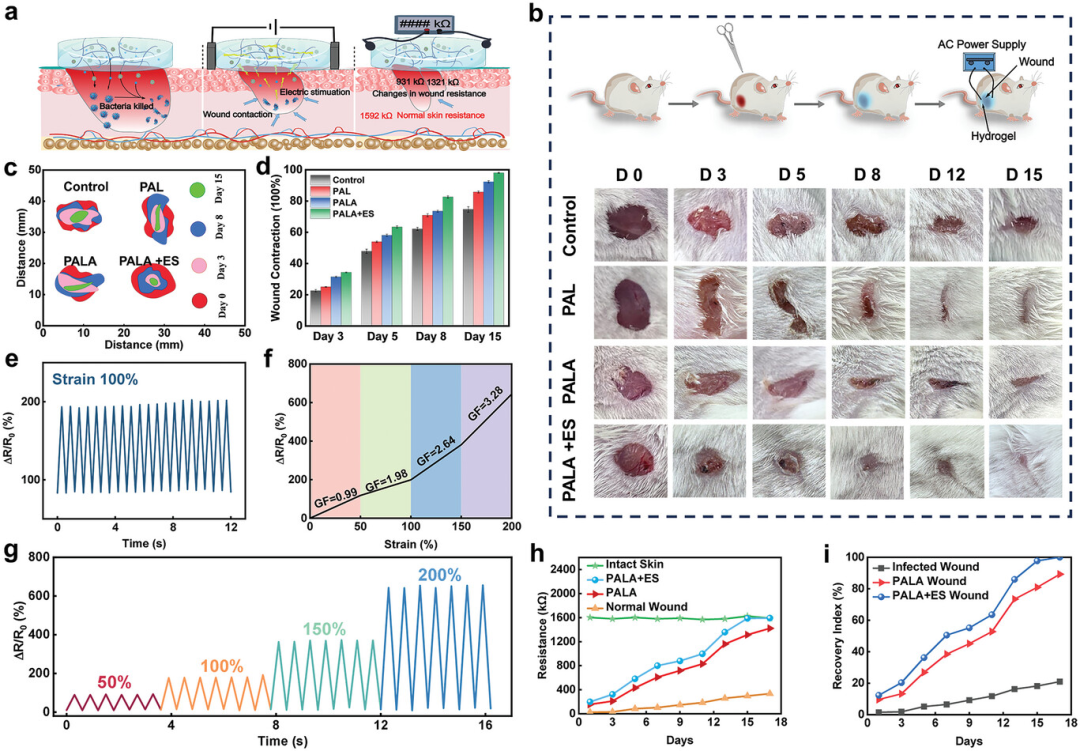
图6. 水凝胶用于整合抗菌、电疗和伤口监测
【小结】
该论文提出了一种通过双金属离子增强的策略,用于提升基于多酚的水凝胶在抗菌、导电和机械性能方面的性能。研究制备了一系列具有优异抗菌性、导电性、生物组织粘附性、自愈合性、快速止血和机械稳定性的基于聚丙烯酸(PAA)的多功能水凝胶。这些水凝胶在室温下无需光照或加热即可快速凝胶化,这是由于Al3+促进了过硫酸铵(APS)产生的硫酸根自由基,加速了丙烯酸的聚合,从而降低了水凝胶制备的成本。水凝胶的卓越机械稳定性归因于丙烯酸链、Ag-Lig纳米粒子和Al3+之间的氢键和金属-配体键的协同效应,这些相互作用在拉伸过程中充当“牺牲键”以耗散能量。由于Ag-Lig的卓越生物组织粘附性,PALA水凝胶展现出对多种亲水性和疏水性材料(如猪皮和人皮)的长期稳定性和湿粘附性,且在人皮上无残留。含有Ag-Lig和Al3+的PALA水凝胶展现出更强的抗菌效果,部分Al3+和Ag+在水凝胶中破坏细胞壁并杀死细菌。显著的是,Al3+/Al2+的存在加速了Ag-Lig中儿茶酚/醌的动态氧化,导致系统持续释放具有杀菌特性的酚羟基,增强了其杀菌特性。体内实验也证实了双金属酚醛网络水凝胶在小鼠中加速了伤口愈合过程。由于PALA水凝胶的强电导率,电刺激(ES)在伤口中均匀分布,这种微电流刺激伤口中深层或表层皮肤细胞的迁移,加速伤口愈合。此外,基于水凝胶的敏感和稳定的传感特性,构建了一个灵活的设备,用于实时监测伤口愈合过程,该设备可以通过观察电阻变化来监测伤口愈合过程。快速愈合显著减少了患者的不适,而实时伤口监测为医生在诊断和治疗中提供了参考。总体而言,Al3+在双金属酚醛网络水凝胶中显著加速了儿茶酚/醌的可逆动态氧化,为设计实用的新型抗菌敷料提供了理论基础。构建的整合抗菌-电疗-监测伤口治疗和监测设备,促进了软生物电子材料在智能医疗中的进展。
原文链接:
https://doi.org/10.1002/adfm.202413080


