全球首次!《柳叶刀》:“百变细胞”恢复角膜,挽救视力,开启眼部再生疗法新篇章
时间:2024-11-09 17:07:51 热度:37.1℃ 作者:网络
角膜是位于眼球最前端的结构,可保护其他所有眼球结构,避免受到外伤。角膜缘干细胞(LSCs)不断分裂、分化,持续补充脱落的角膜细胞,从而使角膜保持透明和完整,这是我们获得清晰视力的关键因素之一。灼伤、免疫疾病、遗传疾病等原因,可能导致角膜缘干细胞缺失或功能障碍,引起眼表不适、视力下降、畏光,甚至失明。通过移植手术补充角膜缘干细胞是主要治疗方法,比如用另外一只健康眼的结膜角膜缘组织自体移植,但这种方式供体来源非常有限,还需要使用全身免疫抑制剂防止免疫排斥,成功率也较低。因此,探索更合适的治疗方式是临床研究热点。
多能干细胞具有自我更新和分化成人体内几乎所有细胞类型的能力,堪称“百变细胞”。2019年,日本大阪大学Kohji Nishida团队成功利用诱导多能干细胞(iPSCs)分化的角膜上皮片层进行了1例角膜缘干细胞缺乏症(LSCD)的临床移植试验,发现可以成功分化为角膜上皮细胞,随后移植可有效地恢复视觉功能。近日,该研究团队在《柳叶刀》The Lancet发表了接受诱导多能干细胞移植术的4例患者,随访2年的情况,研究表明所有患者治疗眼的疾病分期均有所改善,矫正远视力增强,角膜混浊情况改善,且无一例患者出现临床免疫排斥反应或有肿瘤形成,提示这种治疗方式是安全有效的。
文章表示,这是作者团队所知的首次使用人类诱导多能干细胞分化的角膜上皮细胞,来修复因角膜缘干细胞缺乏症而视力受损患者的角膜,该疗法是未来角膜缘干细胞缺乏症极具潜力的治疗选择。

截图来源:The Lancet
如下图所示,研究人员通过自主开发的自形成、外胚层、自主、多区域(SEAM)培养方式,模拟了部分全眼发育过程,成功将诱导人类多能干细胞分化为角膜上皮细胞,经过一系列的处理后,研究人员将新的角膜上皮细胞移植到已去除结膜组织的患眼上。
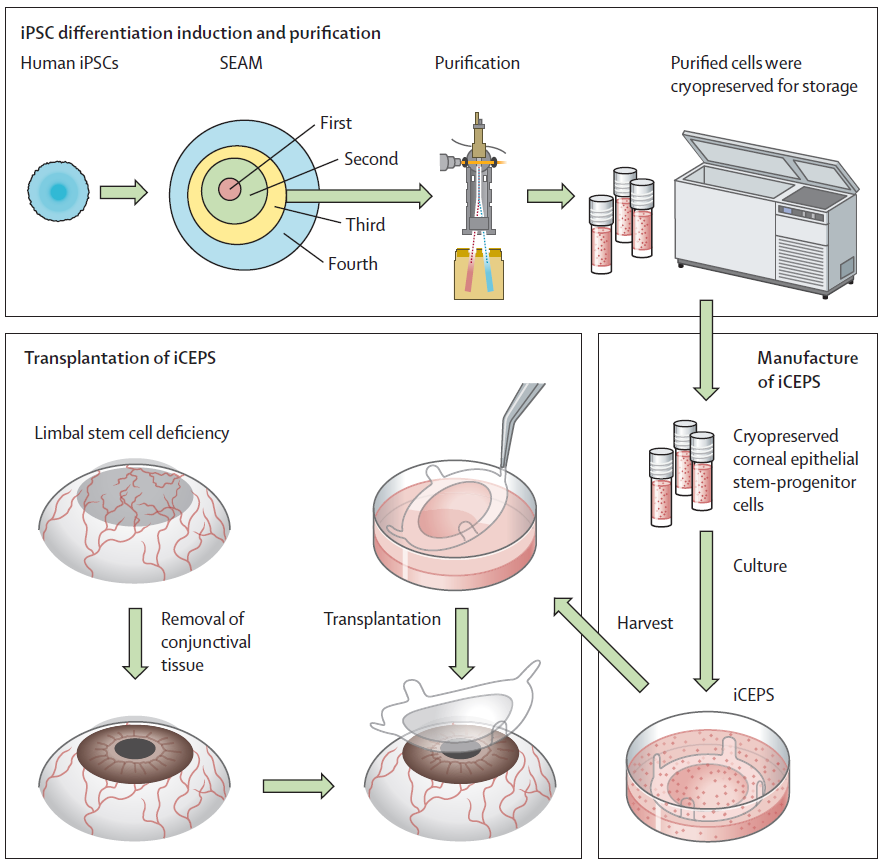
▲诱导人类多能干细胞的制备与移植(图片来源:参考文献[1])
4例患者均于2019年6月至2020年11月入组,随访期为52周,52周至104周的随访为额外的安全监测期。研究结果显示,所有患者治疗眼的疾病分期均有所改善,矫正远视力增强,角膜混浊情况改善。角膜上皮缺损、主观症状、生活质量等方面多有改善或无明显变化。整体而言,患者1和2的治疗效果明显优于患者3和4。
-
患者1和2治疗眼从Ⅲ期降低至1A期,患者3从ⅡB期降至1A期,且为期52周的随访期内,均维持了改善效果。患者4病情比较严重,虽然治疗第32周时疾病分期改善至1A期,但术后1年,再次退化至ⅡB期。
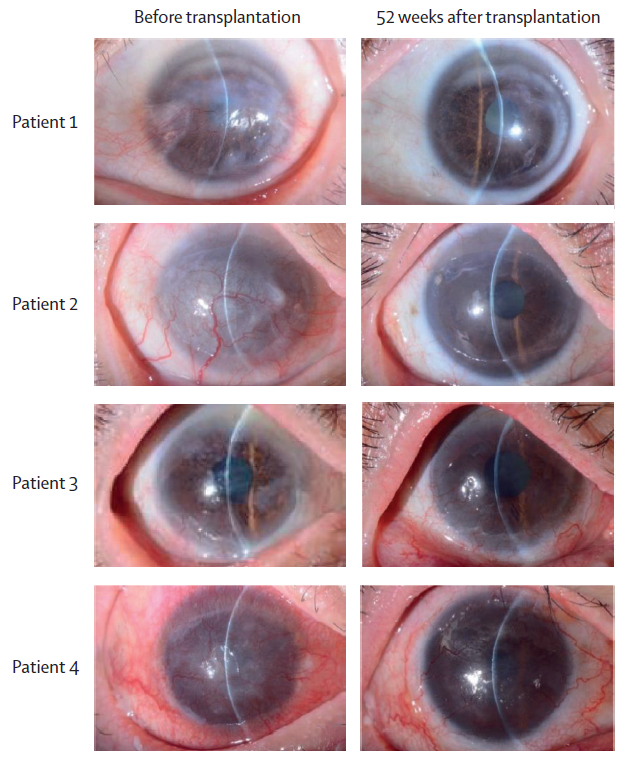
▲4例患者患眼裂隙灯显微镜图像(图片来源:参考文献[1])
-
角膜上皮缺损严重程度方面,患者1术前为0级,术后仍为0级,即情况较为稳定;患者2和3术前为1级,术后降为0级,缺损有所改善;患者4术前、术后均为1级,情况也比较稳定。
-
4例患者主观症状无明显不同或改善(如移植后眼睑粘连程度、眼部疼痛、异物感等)。
-
矫正远视力均有所增加,即视力表检查均有不同程度的行数提高,且患者1和2行数提高情况优于患者3和4。
-
生活质量方面,患者1、2、3在随访第52周时,生活质量评分均高于术前,但患者4的有所下降。
-
4例患者术后角膜混浊情况均较术前有所改善。
安全性方面,诱导多能干细胞体内移植后的致癌风险是临床关注重点。本次研究的2年观察期内,研究人员未发现4例患者有临床免疫排斥反应或有肿瘤形成,安全性较高。
The Lancet发表的同期社论指出,该研究未进行人类白细胞抗原(HLA)分型匹配或使用全身免疫抑制剂,相比于其他移植方式近40%的排斥率,这是诱导多能干细胞治疗角膜缘干细胞缺乏症的强有力优势。
不过,文章也表示,尽管该研究获得了令人欢欣鼓舞的结果,提示诱导多能干细胞治疗角膜缘干细胞缺乏症是未来极具潜力的治疗方式之一,但考虑到目前仅有4例患者的数据,很难与当前其他移植方式做直接对比,仍需进一步开展研究。因此,研究团队计划启动一项多中心临床研究,以明确诱导多能干细胞治疗角膜缘干细胞缺乏症在更广泛群体中的疗效和安全性。让我们共同拭目以待。
参考资料
[1] Soma, Takeshi et al.Induced pluripotent stem-cell-derived corneal epithelium for transplant surgery: a single-arm, open-label, first-in-human interventional study in Japan. The Lancet, November 07, 2024. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)01764-1/fulltext


