【产麻新谭】分娩期剖宫产硬膜外镇痛后母体和胎儿游离罗哌卡因的关联性:一项前瞻性观察试验
时间:2024-11-09 18:05:13 热度:37.1℃ 作者:网络
局部麻醉药通常用于硬膜外镇痛,以治疗分娩疼痛。局部麻醉药通过硬膜外腔吸收进入母体血液循环,随后可能导致胎儿的暴露。罗哌卡因是一种酰胺类局部麻醉药,是产科麻醉的标准药物,以蛋白质结合和游离形式存在于血浆中,游离形式是其潜在的毒性物质。
硬膜外镇痛期间,母体对局部麻醉药的累积暴露量因多因素变量而不同,包括局部麻醉药的类型和浓度、负荷量的药量和次数,用药持续时间,以及分娩方式。在一项包括10名接受硬膜外分娩镇痛产妇的研究中,Porter等人发现,母体接受罗哌卡因的药量在57mg~225mg之间。考虑到局部麻醉药潜在的毒性,估计其在某些住院人群、不同疾病状态或特殊症状患者中的血清浓度具有临床意义。特别是,新生儿人群容易受到局部麻醉药的毒副作用,因为他们的蛋白质结合能力较低,血清中α-1-酸性糖蛋白(AAG)水平较低,导致游离局部麻醉药量过高。
除了新生儿的生理特性外,产妇还会经历非生理变化,这可能会导致游离局部麻醉药水平升高。通过测定局部麻醉剂的基本不带电浓度,母体血清pH值和胎儿血清pH值已被证明会显著影响胎盘转移。在先兆子痫或其他母体血浆蛋白浓度降低的病理条件下,局部麻醉药的胎盘转移会增加。
毒性副作用的风险随着游离局部麻醉药浓度的增加而增加。Knudsen等人发现局部麻醉药的全身浓度与全身中枢神经系统(CNS)毒性的发生之间存在关联。在此背景下,当产妇,特别是新生儿出现神经症状时,应考虑局部麻醉药的潜在中毒。本研究旨在通过分析母体和胎儿罗哌卡因浓度之间的潜在关联,为确定胎儿局部麻醉药暴露提供一种诊断方法。研究的结果发表在2024年5月的Int J Obstet Anesth.杂志上。

材料和方法
试验设计
本研究是一项前瞻性、单中心试验,德国法兰克福大学医院妇产科、麻醉科、重症监护医学和疼痛治疗科合作实施。该研究方案获得当地科学和伦理审查委员会批准,以参考号506/14存档,并根据《赫尔辛基宣言》进行。
受试者
该研究队列由接受连续硬膜外分娩镇痛并在分娩期剖宫产的产妇组成。纳入标准:1)连续硬膜外分娩镇痛,2)年龄>18岁。排除标准:需要紧急分娩和额外的脊髓麻醉的产妇。产妇在纳入研究之前签署书面知情同意书。
数据收集
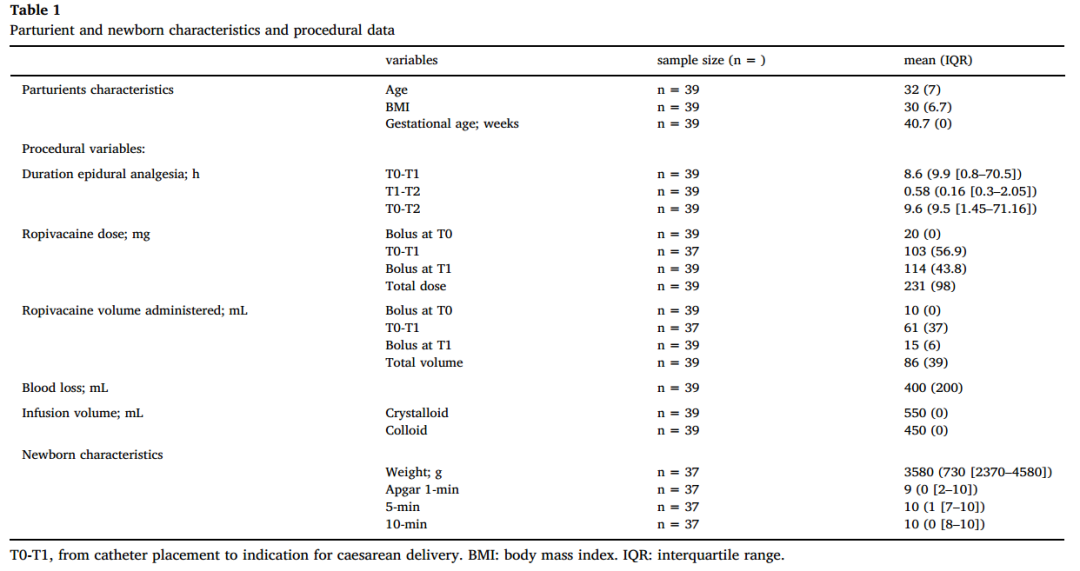
记录孕产妇人口统计学数据,包括年龄、体重、身高、体重指数(BMI)、胎龄、病史、目前用药和妊娠相关疾病。记录新生儿数据,1、5和10 min时的体重和Apgar评分。手术变量包括剖宫产指征、连续硬膜外镇痛持续时间、罗哌卡因药量、剖宫产期间的失血量和静脉输液量。为了量化失血量,使用了有刻度的采集管,从中可以读取失血量。
在三个不同时间点采集母体血液样本:硬膜外镇痛开始(基线,T0);持续输注结束(决定剖宫产时间,T1);以及分娩时(T2)。在分娩时(T2)采集新生儿血液样本。测定上述时间点母体和新生儿血液样本中的罗哌卡因浓度(总浓度和游离浓度)。
硬膜外导管的放置和连续硬膜外镇痛管理
选择L3-4或L4-5椎间隙行硬膜外穿刺,使用18号Tuohy针和阻力消失法,将导管置入硬膜外腔。在负压回抽试验后,给予5~15 mL 0.2%罗哌卡因(共10~30mg)和10µg舒芬太尼,直至产妇报告视觉模拟评分(VAS)为0~3。如果产妇在第一次给药后VAS未达到3,可再给予5 mL 0.2%的罗哌卡因。以4 mL/h的速度开始连续输注(罗哌卡因1.6 mg/mL和舒芬太尼0.05μg/mL),作为患者自控硬膜外镇痛的一部分,每20 min可以要求一次4 mL的药液推注。输液泵预设为4h内最大容量为40 mL(64 mg罗哌卡因和2μg舒芬太尼)。如果发生运动阻滞,则停止持续输注。当有剖腹产迹象时,终止硬膜外输注。给药10~30 mL 0.75%罗哌卡因(共75~225 mg)和固定药量的10µg舒芬太尼,直至阻滞平面达到T4至T5水平。
血液学分析
血液取样
在硬膜外输注开始时(基线,T0)、连续输注结束时(T1)和分娩时(T2)从外周静脉采集母体静脉血样本。T2时,从双夹脐带中采集新生儿静脉血液样本。记录罗哌卡因给药和样品采集的时间点。
罗哌卡因血清浓度分析
样品离心。将血清分离并储存于-20℃下,直至分析。为了分析罗哌卡因的总浓度,将50 µL血清与50 µL内标溶液、100 µL磷酸盐缓冲液和650 µL氯丁醚(50:50)溶液混合。内标溶液由罗哌卡因-D7 25 ng/mL的甲醇溶液组成,磷酸盐缓冲液为pH 9.5的1M磷酸氢铵水溶液。将混合物在Retsch MM400振荡磨机中以30 Hz的频率振荡2 min,然后在Heraeus Biofuge pico中以16060×g的速度离心10 min。
在60℃下蒸发上清液,将残余物溶解在100 µL的水、甲酸和乙腈混合物(79.92:0.08:20)中。将2μL注射到HPLC系统中。为了将游离罗哌卡因与蛋白质结合部分分离,使用Amicon Ultra 0.5ML 30 K滤杯过滤血清,并将200 µL血清加入滤杯中,在12000×g下离心20 min。将50 µL滤液与50 µL内标溶液、100 µL磷酸盐缓冲液和650 µL氯丁醚溶液混合并摇匀。蒸发溶药后,用50 µL水(79.92%)、甲酸(0.08%)和乙腈(20%)的混合物溶解残余物。将2 µL注射到HPLC系统中。分析在安捷伦1100 HPLC系统和6230 B质谱仪上进行。50℃下,在波罗申科EC‐C 18100×2.1 mm,2.7 µm柱上进行色谱分离。使用由乙腈(A)和甲酸铵缓冲液20 mM pH 6.6(B)组成的两个流动相,流速为0.5 mL/min。B相在15%下保持0.5 min,并在接下来的7.5 min内增加到100%。质谱仪的源参数为气体温度225℃,干燥气体8 L/min,鞘气温度300℃,鞘气流量11 L/min,毛细管电压3 kV。质谱仪在正模式下运行。从100到1500 m/z连续记录质谱数据。目标m/z值为275.2118(罗哌卡因)和282.2557(罗哌卡因-D7)。校准曲线(各七个校准水平)在50至2000 ng/mL(总)和2至200 ng/mL罗哌卡因(游离)范围内呈线性。日内、日间精密度和准确度的相对标准偏差和偏倚均小于± 15%。
主要指标
将分娩时(T2)母体静脉和脐静脉游离罗哌卡因浓度定义为主要指标。
次要指标
次要变量定义为T1时母体静脉罗哌卡因的总血清浓度和游离血清浓度,以及T2时母体静脉和脐静脉罗哌卡因的总血清浓度。
样本量分析
样本量分析基于主要指标,重点关注母体和胎儿游离罗哌卡因之间的潜在相关性。该分析采用Spearman等级相关性(相关系数>0.5,α为0.05,β为80%,非正态分布数据)进行,至少需要n = 33名产妇的样本量,以检测统计学上显著的相关性。
统计学分析
采用SigmaPlot 12进行统计分析。进行Spearman rank‐order相关分析,以量化总罗哌卡因和游离罗哌卡因之间的关联。根据数据的分布(Kolmogorov-Smirnov检验),分别采用t检验和配对t检验或Mann-Whitney秩和检验和Wilcoxon符号秩检验来描述组和测量点之间的差异。结果以均数±标准差或中位数(第25/75百分位数)的形式呈现。统计学差异水平设定为P < 0.05。
结果
连续招募了128名足月分娩并要求硬膜外镇痛的产妇。总共89名产妇被排除在外:3名产妇因数据不完整(n = 1)或错误(初次剖宫产n = 2)被排除,86名经阴道分娩的产妇被排除在外。分娩期剖宫产的适应症包括产程进展缓慢(n = 25)、胎儿窘迫(n = 10)、即将发生的子宫破裂(n = 2)、羊膜感染综合征(n = 1)和不明原因感染(n = 1)。所有剖宫产均使用之前置入的硬膜外导管进行麻醉。
表1显示了人口学统计学数据(包括产妇和新生儿数据)和手术变量(罗哌卡因消耗量和容积、硬膜外镇痛持续时间、剖腹产期间的失血量和输液量)。
在T0时,未检测到罗哌卡因浓度。T1时母体静脉罗哌卡因总浓度和游离浓度低于T2。T2时母体静脉和脐静脉游离罗哌卡因的血清浓度没有显著差异(P=0.46),见表2。
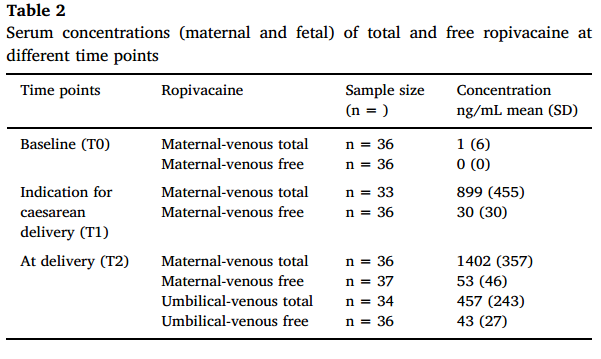
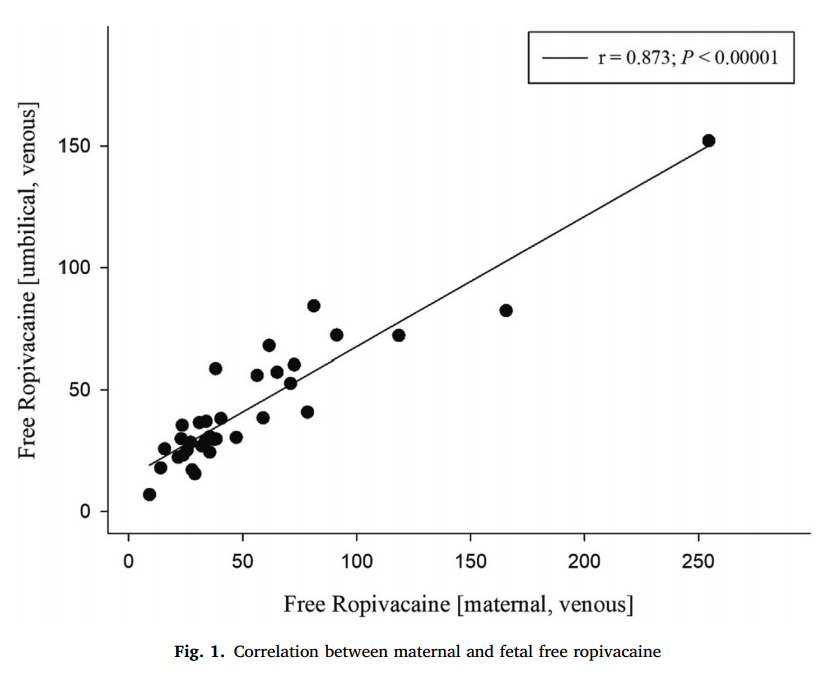
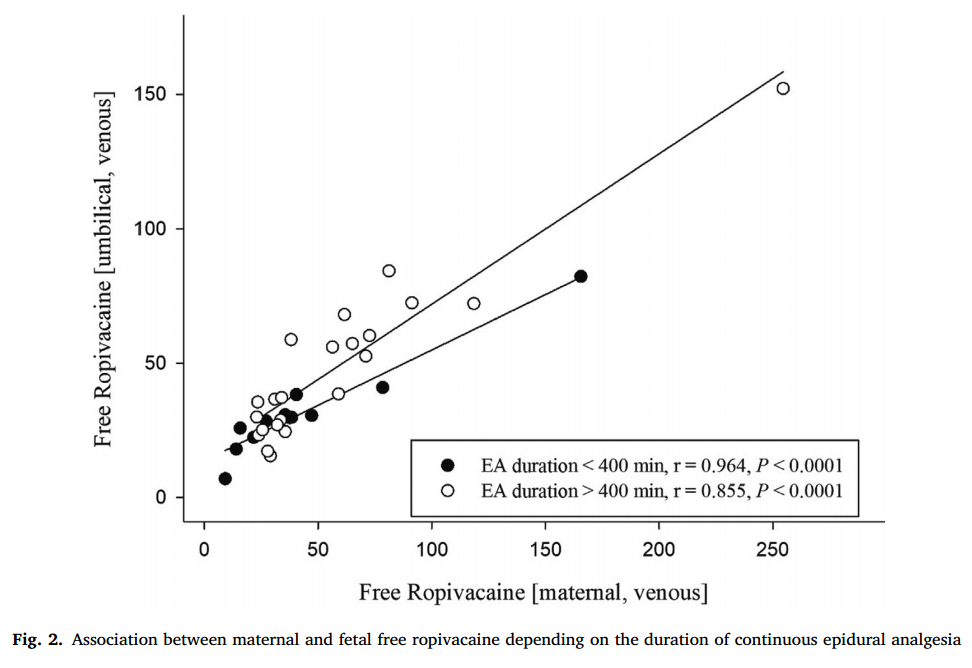
分娩时(T2)母体静脉和脐静脉游离罗哌卡因浓度呈显著正相关(r=0.87,P<0.00001),见图1。根据硬膜外镇痛持续时间[> 400 min(n = 25)vs < 400 min(n = 14)]进行亚组分析,显示在 > 400 min和 < 400 min两组中,母体静脉和脐静脉游离罗哌卡因浓度与硬膜外镇痛/麻醉持续时间之间存在显著相关性(r=0.855,P<0.0001 vs r=0.964,P<0.0001),如图2所示。
讨论
该研究表明,分娩时母体和胎儿罗哌卡因游离浓度之间存在显著相关性,确定了母体血液中游离罗哌卡因浓度可能是估算新生儿接触罗哌卡因情况的可行选择。
罗哌卡因硬膜外分娩镇痛后,每个新生儿在分娩时存在全身暴露于罗哌卡因下。对于罗哌卡因等局部麻醉药,已证实其全身浓度与中枢神经系统(CNS)和心血管毒性的发生之间存在关联,并且中枢神经系统症状通常早于心血管症状。研究发现,健康志愿者中枢神经系统副作用发生的阈值药量为总罗哌卡因3~3500 ng/mL,游离罗哌卡因150 ng/mL。在本研究人群中,产妇或新生儿均未达到总罗哌卡因的阈值药量。游离罗哌卡因的阈值药量在产妇中达到两次(254 ng/mL和165 ng/mL),在新生儿中达到一次(152 ng/mL)。游离罗哌卡因血清浓度最高的新生儿是游离罗哌卡因血清浓度最高(254 ng/mL)的母亲所分娩的新生儿。达到游离罗哌卡因毒性阈值药量的新生儿Apgar评分为9/10/10,表明在这种情况下没有临床相关的局部麻醉药毒性。然而,在一项局部麻醉药全身毒性的回顾性分析中,Riff等人发现,超过60%的症状发生在分娩10 min后,因此,即使Apgar值最初正常,也不能完全排除局部麻醉药全身中毒的发生。在特定病例中,新生儿罗哌卡因的暴露可能具有临床意义。
为了量化产科硬膜外镇痛期间母体对罗哌卡因的暴露,Porter等人在硬膜外试验药量后60 min和分娩时测量了血浆游离罗哌卡因浓度,显示分娩时母体血浆游离罗哌卡因浓度为140(100)ng/mL,还发现分娩时母体和胎儿游离罗哌卡因之间没有显著关联性。他们认为,缺乏关联性与影响局部麻醉药胎盘转移的多种不同因素有关。
在本研究中,分娩时母体静脉和脐静脉游离罗哌卡因浓度(53 ng/mL和43 ng/mL)低于Porter等人报道的浓度。考虑到本研究队列中,分娩期剖宫产(连续输注和负荷量)施用了更高剂量的罗哌卡因,这一观察结果与总药量越高必然导致游离罗哌卡因血清浓度越高的假设相反。
本研究是第一项在分娩期硬膜外镇痛下进行剖宫产时调查新生儿全身暴露于罗哌卡因的研究。此前,母体和胎儿游离罗哌卡因之间的关联尚未得到证实,可能是由多种因素引起的。Porter等人怀疑,包括子宫血流、子宫收缩的相位和药物因素(分子量、电离度、脂质溶解度)在内的影响局部麻醉药胎盘转移的多种因素造成了两者之间缺乏关联性。Morton等人认为,两者缺乏相关性,是因为硬膜外镇痛持续时间太短,无法在产妇和新生儿之间的循环中达到必要的平衡。本研究亚组分析结果没有证实这一假设,因为游离罗哌卡因的浓度在硬膜外镇痛的时长上没有显著差异。因此,硬膜外镇痛持续时间似乎不是母体或胎儿罗哌卡因暴露程度的可靠预测因素。
母体和胎儿中总罗哌卡因浓度(与游离罗哌卡因相比)高于Morton和Irestedt等人的先前报道值。基于本研究中罗哌卡因的总药量明显高于其他作者报告的药量,这一结果是意料之中的。罗哌卡因总浓度和游离浓度之间的巨大差异可能源于罗哌卡因的蛋白质结合特性,罗哌卡因与AAG结合。研究表明,在连续硬膜外输注过程中,总罗哌卡因浓度增加,而游离罗哌卡因的浓度达到稳定状态。由于AAG是一种急性期蛋白,人们怀疑AAG血浆浓度的增加会导致蛋白结合程度的增加,随后罗哌卡因的清除率降低。然而,尽管创伤或手术后血浆AAG浓度显著增加,但这种影响在产妇中尚未显示出来。
对于本研究人群选择了分娩期剖宫产产妇,因为由于硬膜外镇痛持续时间和进行剖宫产的额外药物推注,这一队列可能会接受更高剂量的罗哌卡因。罗哌卡因的平均给药药量为231 mg(83~373 mg),与Irestedt和Porter等人在阴道分娩硬膜外镇痛背景下研究罗哌卡因浓度的研究(99~255 mg vs 57.4~146 mg)相比,正如预期的那样,本研究的平均药量高于已发表的研究。
本研究存在一些局限性。首先,尽管基于主要结果进行了样本量分析,但该研究队列包括相对较小的健康产妇,因此获得的结果可能不具有普遍代表性,并受到统计误差的影响。其次,本研究在放置硬膜外导管时,预计剖宫产时和分娩时检测了血液样本。如果在导管置入后以短时间间隔和产后24h内以预定义的间隔实施更多的检测,那将很有意义。此外,在大剂量给药和分娩之间只有几分钟间隔,因此很可能在最后一次抽血时没有达到最大浓度。
结论
本研究发现分娩时母体和胎儿的罗哌卡因游离浓度之间存在显著相关性,与硬膜外镇痛的持续时间无关。更高剂量的罗哌卡因给药导致血清罗哌卡因总浓度更高。因此,确定母体血液中游离罗哌卡因浓度可能是估计新生儿罗哌卡因暴露量的可行选择。
产麻新谭·述评
该研究为硬膜外分娩镇痛中罗哌卡因在母婴间的转移与安全性提供了新见解,与现有研究成果相辅相成。此前已有研究指出,由于新生儿蛋白结合能力较差,其对自由形式的局麻药更为敏感,容易出现潜在毒性风险。本研究首次在分娩期剖宫产的背景下验证了母体游离罗哌卡因浓度与新生儿暴露之间的显著相关性,提示母体游离罗哌卡因的水平可作为新生儿暴露风险的评估指标。这与已有关于硬膜外局麻药物跨胎盘转移的研究报道一致,后者发现局麻药能够通过胎盘进入新生儿循环。相比之前的研究,本研究进一步明确了母体和新生儿游离罗哌卡因浓度的关联,为临床通过监测母体罗哌卡因浓度预测新生儿暴露提供了新的依据,但在推广应用前仍需更大规模的临床研究进行验证。


