Gastroenterology:上海交通大学张志刚/蒋书恒/张雪莉发现肝细胞癌进展的调控新机制
时间:2023-05-30 11:57:01 热度:37.1℃ 作者:网络
iNature
核糖体生物发生的过度激活导致肝细胞转化,并在肝细胞癌(HCC)的发展中起关键作用。但是HCC进展中过度表达和至关重要的关键核糖体生物发生蛋白尚未明确清楚。
2023年5月27日,上海交通大学张志刚、蒋书恒及张雪莉共同通讯在Gastroenterology在线发表了题为“ALKBH5 Drives Immune Suppression via targeting AXIN2 to Promote Colorectal Cancer and is a Target for Boosting Immunotherapy”的研究论文,该研究发现了非正常表达的HEATR1与HCC恶性肿瘤密切相关,并揭示了HEATR1在核糖体生物发生和蛋白质组稳态调节中不可或缺的作用。HEATR1敲低导致泛素-蛋白酶体系统的破坏和IkB/NF-kB和NPM1-MYC轴的改变。这些发现为HCC的发生机制提供了新的见解。

肝细胞癌是世界范围内最常见的人类恶性肿瘤之一,预后较差。乙型或丙型肝炎病毒感染和代谢综合征异常激活信号通路,如Wnt/β-catenin、PI3K/Akt/mTOR和Hedgehog通路,或使TP53失活,对肝癌发生构成重大风险。这些促进生长的信号在核仁中聚集,促进核糖体的生物发生和肝细胞的恶性转化。增强的核糖体生物发生是HCC细胞的一个特征,有助于蛋白质合成和无限制的细胞增殖和代谢。Sorafenib耐药HCC残余肿瘤的转录组学分析显示,核糖体生物发生增强也可能是HCC化疗耐药的原因。最近,一些靶向核糖体生物发生的化合物在临床前模型中显示出明显的抗肿瘤作用。
核仁是由纤维中心、致密纤维组分和粒状组分组成的多相液体凝结物。核糖体生物发生是由核仁中核糖体DNA (rDNA)的限速转录启动的一个多步骤过程。人类二倍体基因组包含400个43kb的rDNA单元,串联排列在核仁组织区。rDNA单元由一个长基因间隔区和一个前体rRNA (pre-rRNA)编码区组成,由核核RNA聚合酶I (Pol I)转录。上游结合转录因子(UBTF)和选择性因子SL1与rDNA启动子的协同结合对于Pol I预起始复合物的组装至关重要。
Pre-rRNA被许多小核仁核糖核蛋白(snoRNPs)共转录加工成成熟的18S、5.8S和28S rRNA。Pol I转录机制在癌症中被癌基因如MYC和生长信号介质如mTOR激活。具体来说,在HCC中,MYC的异常激活在核糖体生物生成的过度激活和驱动肝癌发生中起着核心作用。然而,HCC中过度活跃核糖体生物发生的分子机制尚不完全清楚。
通过分析GEO和TCGA数据库中的HCC数据集,该研究发现在HCC中307个核糖体生物发生相关基因中,HEATR1是上调最多的基因。人类HEATR1基因编码一个由2144个氨基酸组成的大蛋白,其c端有一个HEATR重复序列。它是酵母U3 snoRNA相关蛋白10 (UTP10)蛋白的同源物,该蛋白定位于人类细胞的核核中,在核糖体生物发生中具有潜在的作用。UTP10是UTP-A多蛋白复合物的重要组成部分,它通过结合新生的pre-rRNA启动pre-rRNA加工,并招募UTP-B和U3 snoRNP形成U3小亚基(SSU)加工体。HRAT1通过不同的机制参与胶质瘤、胰腺导管腺癌、胃癌和口腔鳞状细胞癌的调控过程,但其在HCC中的功能尚未被研究。
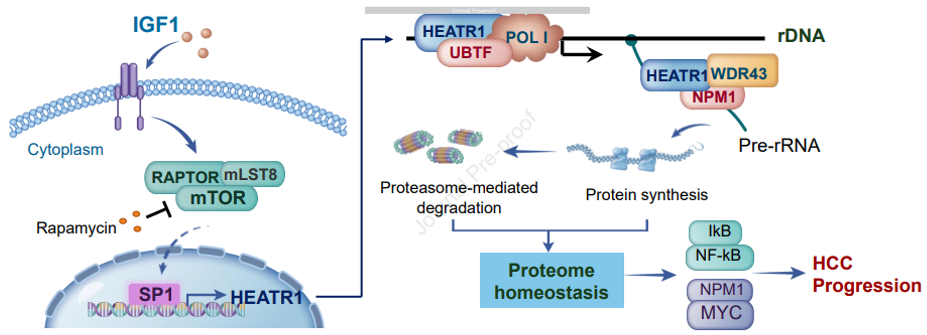
HEATR促进肝细胞癌进展的机制示意图(图源自Gastroenterology )
该研究使用TCGA和GEO数据库分析含有HEAT repeat1 (HEATR1)表达和临床相关性,并通过HCC组织芯片的免疫组织化学分析进一步评估。基因表达被小干扰RNA敲低。对HEATR1敲低的细胞进行活力、细胞周期和凋亡检测,并用于建立皮下和原位肿瘤模型。采用染色质免疫沉淀和qPCR检测候选蛋白与特定DNA序列的关联。内源性共免疫沉淀结合质谱法鉴定蛋白质相互作用。该研究用免疫印迹和免疫荧光法检测和定位细胞中的蛋白质。透射电镜观察核仁超微结构。Click-iT?RNA成像和嘌呤霉素掺入实验分别用于测定新生RNA和蛋白质合成。在HEATR1敲除的HCC细胞中,评估蛋白酶体活性、20S蛋白酶体灶形成和蛋白稳定性。
研究发现,在HCC样本中,一组核糖体生物发生介质中,HEATR1是上调最多的基因。HEATR 1的高表达与HCC患者的低生存率和恶性临床病理特征相关,并有助于HCC在体外和体内的生长。在HCC细胞中,HEATR 1的表达受转录因子SP1调控,而转录因子SP1可被IGF1-mTORC1信号激活。HEATR 1主要定位于核仁,与核糖体DNA结合,并与RNA聚合酶I转录/加工因子相关。
敲低HEATR 1破坏了rRNA的生物发生,损害了新生蛋白的合成,导致细胞质蛋白酶体活性和IkB/NF-kB信号传导降低。此外,HEATR1敲低诱导核仁应激,核蛋白酶体活性增加,核磷蛋白1 (NPM1)-MYC轴失活。该研究表明,在HCC中,IGF1-mTOR-SP1信号通路上调了HEATR1,并作为核糖体生物发生和蛋白质组稳态的关键调节因子,促进HCC的发展。
原始出处:
ALKBH5 Drives Immune Suppression via targeting AXIN2 to Promote Colorectal Cancer and is a Target for Boosting Immunotherapy. Gastroenterology, 2023.


