俞书宏院士团队NSR:免疫调控新发现——纳米材料广谱抑制炎症小体的激活
时间:2023-07-05 17:18:08 热度:37.1℃ 作者:网络
炎症小体(lnflammasomes)是一种较大的多聚体蛋白复合物,主要存在于消除病原体的先天免疫细胞中,其在响应外源性病原体或内源性危险信号时会引发炎症反应。炎症小体于2002年被发现后一直是免疫和炎症疾病领域的重点研究对象,研究热度逐年攀升。
目前已发现的炎症小体主要有NLRP1,NLRP2,NLRP3,NLRP6,NLRC4,NLRP12和AIM2炎症小体等(图1)。炎症小体激活有助于清除病原体和受损细胞,对于先天免疫反应至关重要。然而,炎症小体激活也可能是自身免疫和代谢紊乱的主要驱动因素,包括阿尔茨海默病、帕金森病、肺纤维化、肠炎、II型糖尿病、痛风、动脉粥样硬化等。
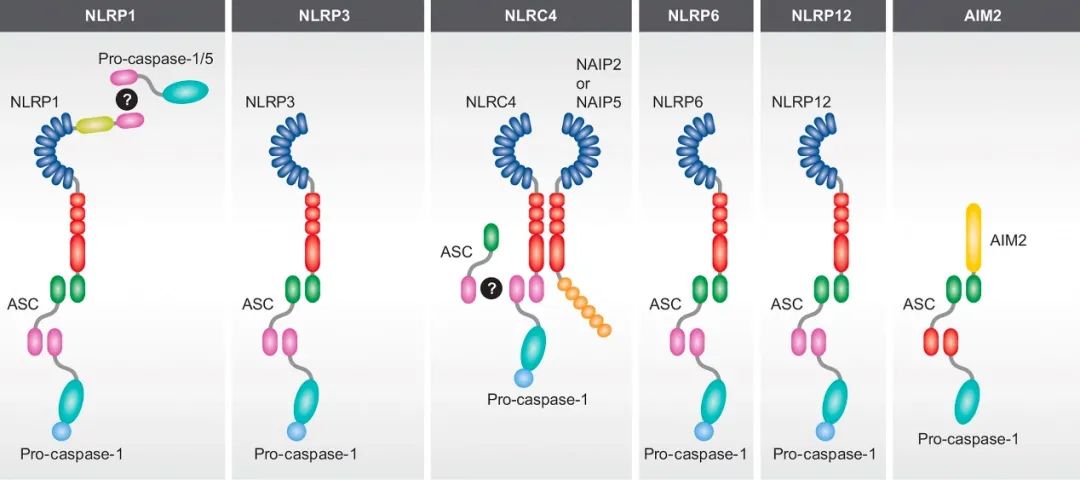
常见的几类炎症小体
由于炎性小体的激活与自身免疫和代谢紊乱的关系,需要开发有效的炎性小体抑制剂。当前,包括MCC-950、冬凌草甲素、omega-3脂肪酸、芬那酯非甾体抗炎药等在内的一系列小分子被确定可以抑制炎症小体的激活。而这些小分子往往也只能针对一种炎症小体的激活发挥作用。
巨噬细胞是产生炎症小体的主要细胞类型,同时也是集体吞噬纳米颗粒的主要细胞类型。若能发现具有抑炎功能的纳米药物,则可以通过靶向巨噬细胞获得更好的抑炎效果,同时减小因作用于别的细胞类型而产生副作用。然而,目前已被报道的纳米材料几乎都是促进炎症小体的激活。

中国科学技术大学俞书宏院士/温龙平教授、合肥工业大学陆杨教授及中国科学技术大学瞿昆教授多团队合作,揭示了一种纳米材料免疫调控的新特性——广谱抑制炎症小体激活。研究者们首先通过体外实验证明了镍钴合金纳米晶体抑制炎症小体激活的效果。体内实验进一步证实镍钴合金纳米晶体通过抑制炎症小体的激活缓解小鼠结肠炎和腹膜炎症状。然后通过纳米医学和基因组学、生物信息学的学科交叉揭示了镍钴合金纳米晶体发挥抑炎作用的机制——通过抑制非编码RNA的转录抑制炎症小体的组装(图1)。
相关工作以 “Nickle-cobalt alloy nanocrystals inhibit activation of inflammasomes” 为题于近日在《National Science Review》上在线发表,本研究不仅为炎症小体激活相关疾病的治疗提供了新的思路,测序数据还为炎症小体激活机制研究提供了大量潜在的靶点。
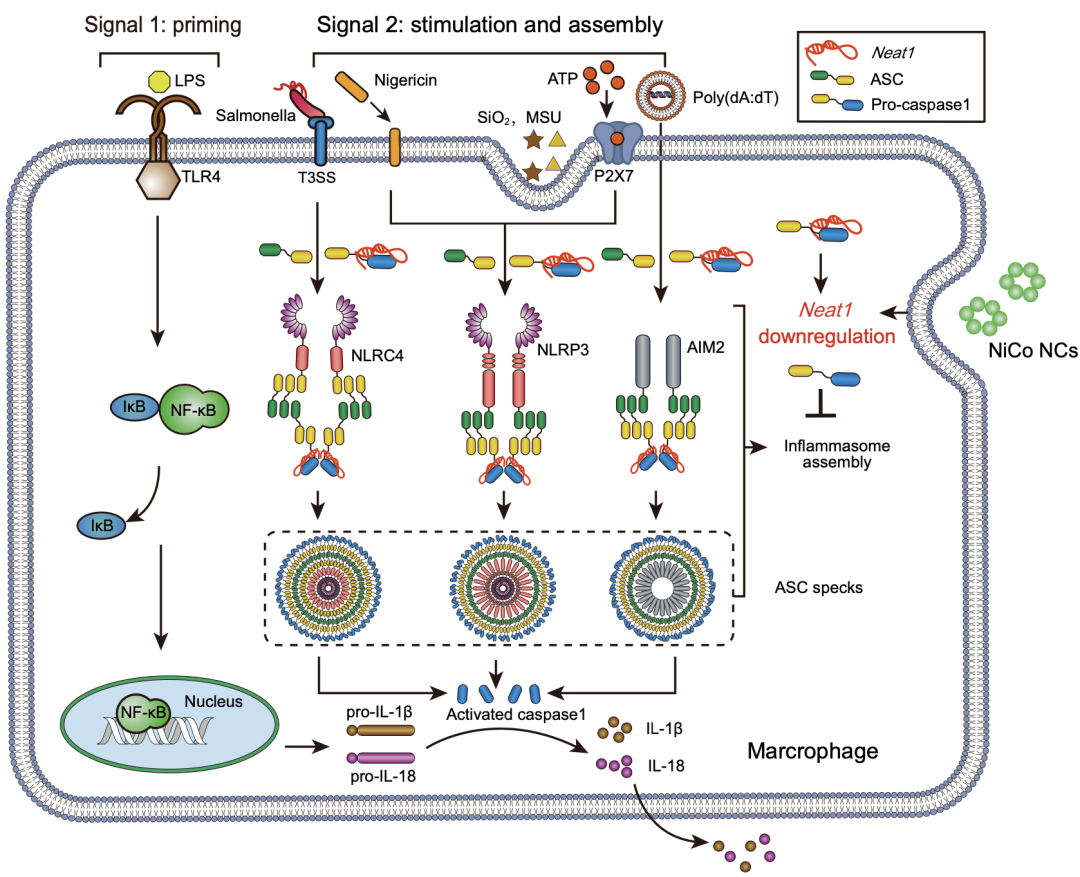
图1 镍钴合金纳米晶体(NiCo NCs)抑制炎症小体激活机制示意图
研究者们合成了环状镍钴合金纳米晶体(NiCo NCs),在原代巨噬细胞中证实,NiCo NCs可以非常有效的抑制分别由尼日利亚菌素、沙门氏菌和poly(dA:dT)诱导的NLRP3、NLRC4和AIM2三种炎症小体的激活(图2)。
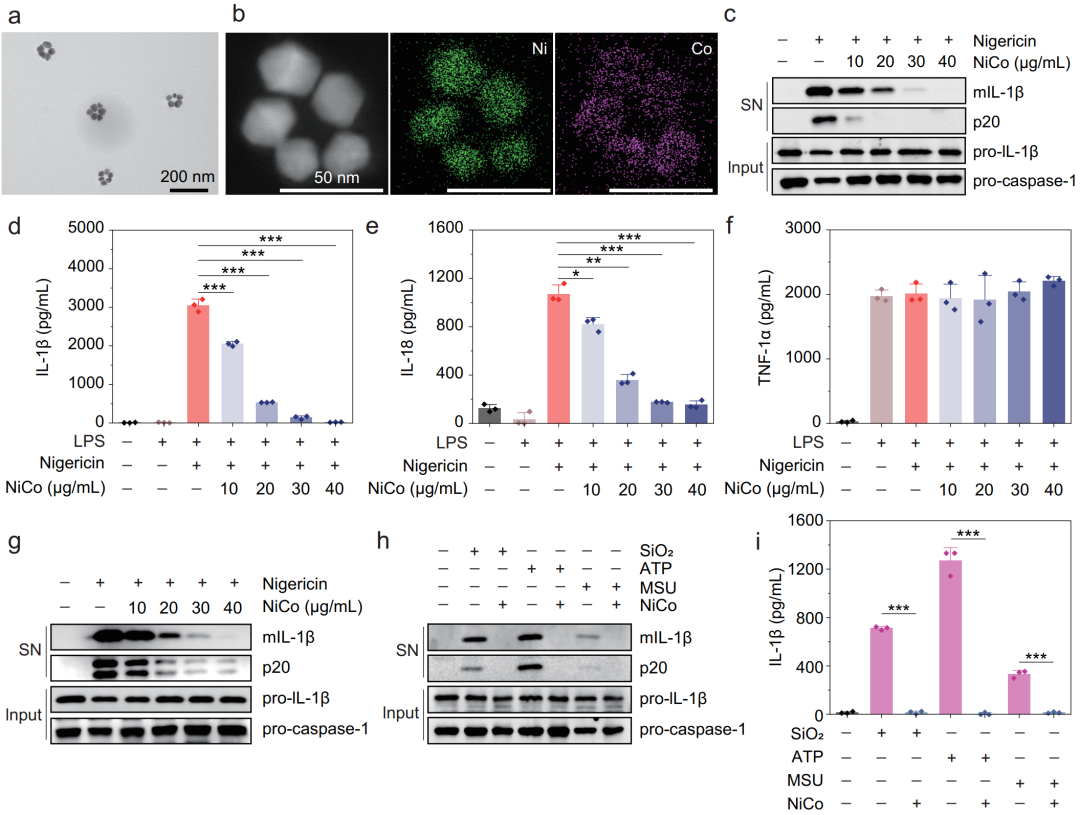
图2 体外实验证实镍钴合金纳米晶体抑制NLRP3、NLRC4和AIM2炎症小体激活
研究者们构建了两个因炎症小体过度激活导致的疾病模型——急性腹膜炎和小鼠结肠炎。在急性腹膜炎模型中,NiCo NCs治疗组可以显著减少腹水中IL-1β的产生以及中性粒细胞的趋化,表明NiCo NCs通过抑制炎症小体的激活来缓解急性腹膜炎症状。在结肠炎模型中,NiCo NCs治疗组可以显著缓解小鼠多种症状(包括体重降低、结肠长度缩短、以及肠壁黏膜上皮损伤)。并且在结肠浸出液中,NiCo NCs治疗组可以显著减少DSS导致的小鼠结肠IL-1β产生,表明NiCo NCs缓解小鼠的结肠炎症状也是通过抑制炎症小体激活来实现的(图3)。
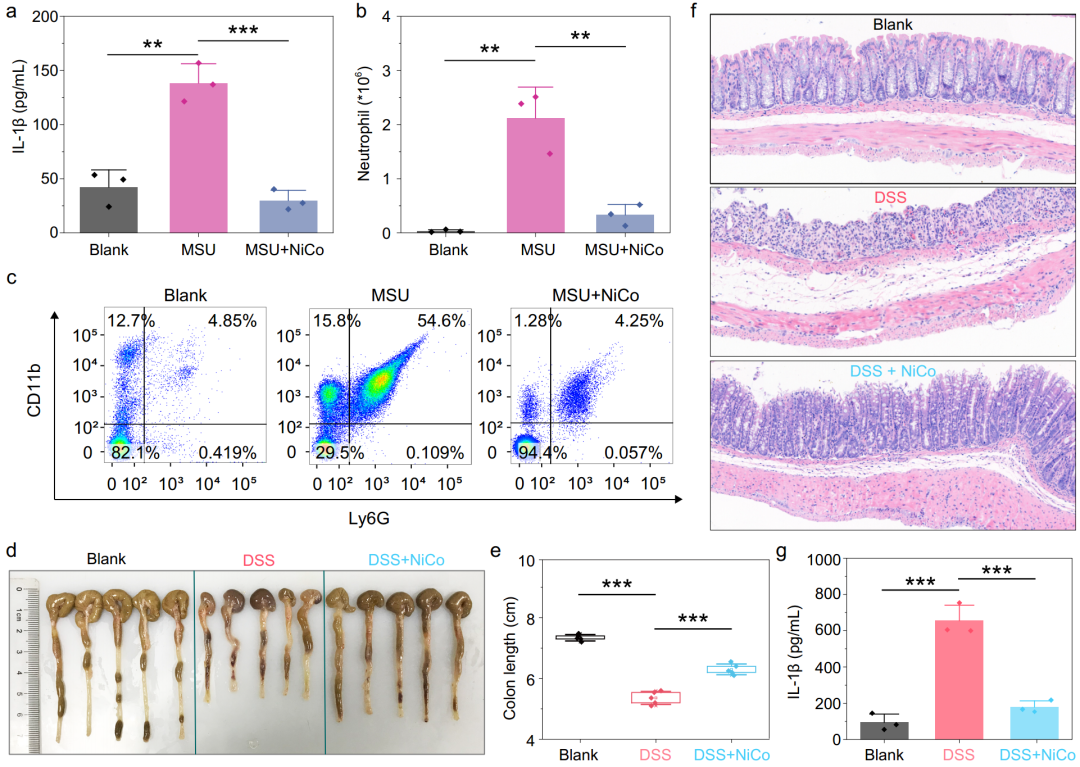
图3 体内实验证实镍钴合金纳米晶体通过抑制炎症小体激活缓解小鼠疾病症状
为了确认NiCo NCs是否需要进入细胞才能发挥其抑炎作用,研究者们借助被广泛使用的内吞抑制剂细胞松弛素D实施验证实验。细胞松弛素D处理能显著降低巨噬细胞对NiCo NCs的内吞作用。巨噬细胞对NiCo NCs的内吞抑制会随之降低NiCo NCs的抑炎效果,表明NiCo NCs必须进入细胞才能发挥其抗炎作用(图4a-d)。
研究者们同时合成了镍纳米颗粒和钴纳米颗粒作为对照,以验证是否镍基纳米材料或钴基纳米材料单独可抑制验证小体的激活。结果证明,两种材料各自均能显著抑制炎症小体的激活。含镍和含钴的纳米材料可能为设计具有抗炎特性的纳米药物提供可能性(图4e-g)。
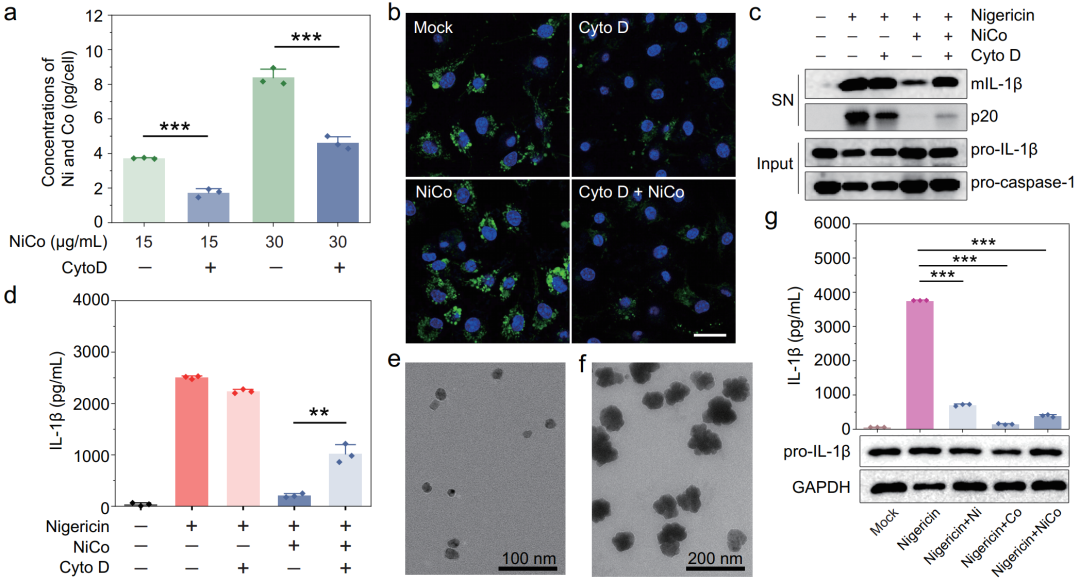
图4 内吞进入细胞对镍钴合金纳米晶体发挥抑炎效果至关重要。镍基或钴基纳米材料各自均能抑制炎症小体激活
揭示纳米材料发挥作用的生物学机制对其潜在的医学应用至关重要,然而通过传统的生物学实验手段搞清楚这种具备广谱抑炎效果的纳米晶体抑制炎症小体激活的生物学机制充满挑战。为此,研究者们通过基因组学和生物信息学的交叉融合,对样品开展了转录组和染色质可及性测序及分析。通过对转录组测序结果进行分析,重点关注炎症小体激活后表达上调,NiCo NCs共处理后表达下调的基因。作者在基因列表中发现了一个已被报道过的参与炎症小体组装的非编码RNA——Neat1在接受NiCo NCs治疗之后,表达量显著降低。之前的研究已证实单纯敲低Neat1表达即可显著抑制NLRP3、NLRC4和AIM2三种炎症小体的激活。为了探究导致的Neat1表达下调是通过促进其降解还是抑制其转录来实现的,研究者们利用染色质可及性测序证实NiCo NCs处理组中Neat1的基因体和启动子区域的染色质可及性显著降低,表明NiCo NCs抑制炎症小体激活是通过抑制Neat1的转录而不是促进其降解来实现的。
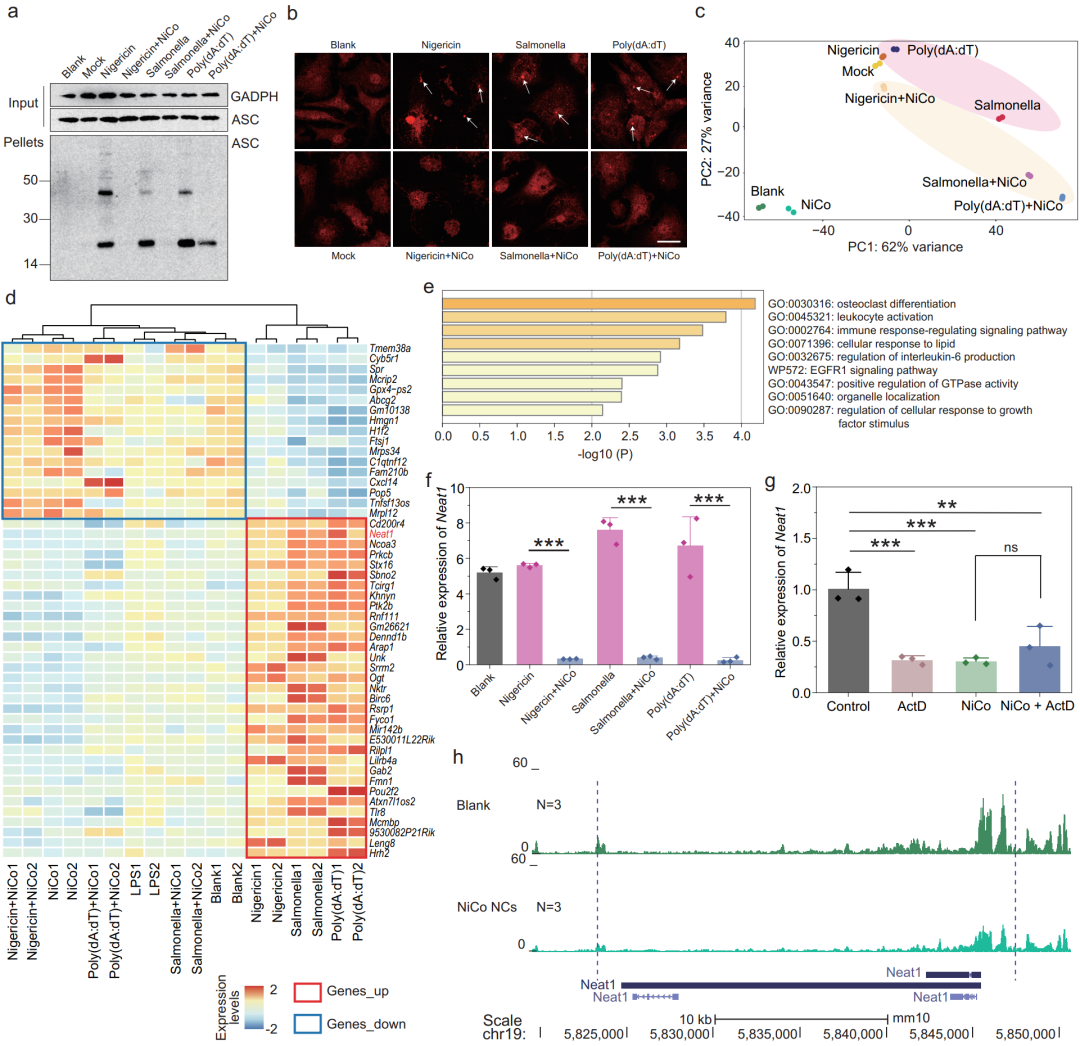
图5 转录组测序结合染色质可及性测序揭示镍钴合金纳米晶体抑制炎症小体激活的机制
中国科学技术大学生命科学与医学部林俊副研究员,微尺度物质科学国家研究中心董良副研究员(现为中国科学院杭州医学研究所研究员)和中科大生医部刘一鸣博士后为论文的共同第一作者。本工作主要得到了国家自然科学基金等项目的资助。
参考文献:
[1] Franz Bauernfeind and Veit Hornung. Of inflammasomes and pathogens – sensing of microbes by the inflammasome. EMBO Mol Med 2013; 5: 814-826.
[2] Sun BB, Wang X and Ji ZX et al. NLRP3 inflammasome activation induced by engineered nanomaterials. Small 2013; 9: 1595-607.
[3] Wang X, Chang CH and Jiang JH et al. Mechanistic differences in cell death responses to metal-based engineered nanomaterials in Kupffer cells and hepatocytes. Small 2020; 16: 2000528.
[4] Lin J, Dong L and Liu YM et al. Nickle-cobalt alloy nanocrystals inhibit activation of inflammasomes. National Science Review 2023; DOI: 10.1093/nsr/nwad179.
[5] Zhang PF, Cao LM and Zhou RB et al. The lncRNA Neat1 promotes activation of inflammasomes in macrophages. Nature Communications 2019; 10: 1495.
原文链接:
https://doi.org/10.1093/nsr/nwad179


