华领医药first in class降糖药多格列艾汀(华堂宁)获批上市
时间:2022-10-13 16:03:39 热度:37.1℃ 作者:网络
10月8日,华领医药开发的first in class降糖药多格列艾汀(dorzagliatin)正式获得NMPA批准上市。多格列艾汀是全球首款GKA类降糖药物。
多格列艾汀是一种全球首创葡萄糖激酶启动剂(GKA),旨在通过解决葡萄糖激酶(GK)的葡萄糖感应功能,恢复2型糖尿病患者的葡萄糖稳态平衡来控制糖尿病的渐进性退行性特性。多格列艾汀有望成为治疗2型糖尿病的一线标准药物,既可以作为单药使用,亦可以作为基础药物与当前批准的抗糖尿病药物联合使用。
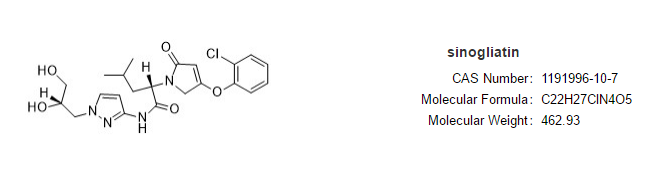
多格列艾汀分子结构式
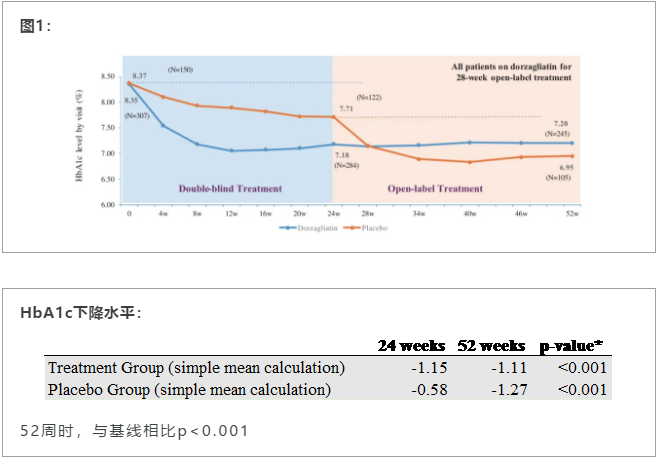
代号为SEED的III期临床研究评估了多格列艾汀单药对从未接受过糖尿病药物治疗的2型糖尿病患者的疗效。前24周为安慰剂对照研究,受试者随机接受多格列艾汀或安慰剂治疗。后28周为开放性药物治疗研究,所有患者均接受多格列艾汀治疗。
结果显示,第24周时,治疗组患者糖化血红蛋白(HbA1c)相对基线降低了1.07%,安慰剂组下降了0.5%,组间差异具有显著统计学意义。第52时,患者持续显示出良好的安全性和耐受性,治疗期间低血糖(血糖低于<3 mmol)发生率低于1%。
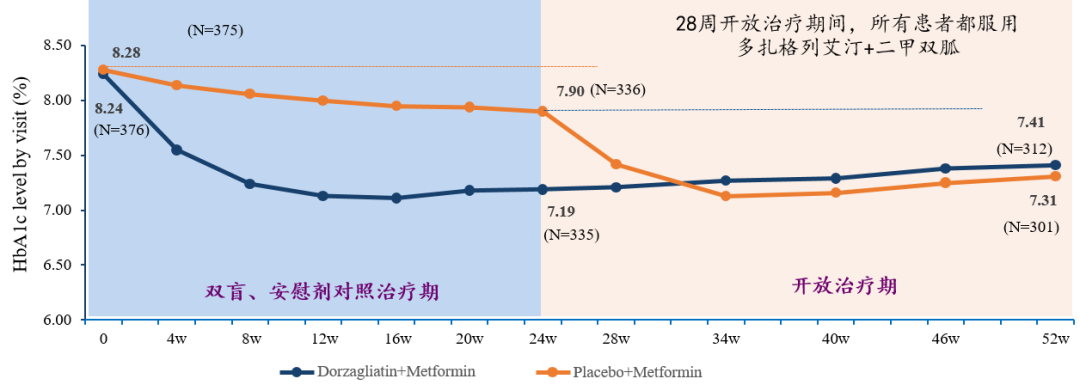
另一项关键III期研究(DAWN)评估了多格列艾汀+二甲双胍治疗此前接受二甲双胍片治疗,但血糖仍未充分控制2型糖尿病患者疗效。前24周为安慰剂对照研究,患者分别接受多格列艾汀+二甲双胍或安慰剂治疗,后28周为开放性药物治疗研究,所有患者均接受多格列艾汀+二甲双胍治疗。
结果显示,第24周时,多格列艾汀+二甲双胍组患者HbA1c较基线降低1.02%,餐后2小时血糖较基线显著降低5.45mmol/L(p<0.0001)。第52时,患者持续显示出良好的安全性和耐受性,治疗期间低血糖(血糖低于<3 mmol)发生率低于1%。
2020年8月华领医药与拜耳达成合作,华领医药作为药品上市许可持有人负责临床开发,注册,产品供应以及分销工作。拜耳作为推广服务提供方负责该产品在中国的市场营销,推广以及医学教育活动。
华领医药将获得3亿元人民币的预付款,此外其还将获得额外最高可达到41.8亿元人民币的里程碑付款。拜耳获得该产品在中国独家商业化的权利,并将根据华领净销售额的一定比例获得服务费用。


