Nat Chem Biol :李大力/宋高洁/赵永祥合作开发高精准、低脱靶的碱基编辑器
时间:2022-10-23 14:59:46 热度:37.1℃ 作者:网络
DNA碱基编辑器是一种创新的基因组编辑工具,它可以催化高效的碱基转换,而不需要产生DNA双链断裂 (DSB),也不需要供体DNA模板。
腺嘌呤碱基编辑器 (adenine base editors, ABEs) 是通过将nCas9与野生型或进化型TadA (eTadA)(最初是大肠杆菌中的转移RNA (tRNA)腺嘌呤脱氨酶)融合而开发的,以有效地产生A•T到G•C的转变。与CBE不同的是,由于碱基切除修复通路的激活,CBE也会诱导C到非T的副产物。然而,ABE7.10的编辑效率对于很多靶点而言不尽如人意,分子进化获得的更高活性的ABE8 (ABE8e和ABE8s)也没有解决ABE引起大量随机的RNA脱靶编辑的缺陷。此外,由于ABE8编辑窗口变宽,还会引起非目标碱基改变而产生旁观者效应以及ABE会在特定的TCN motif的背景序列中诱导胞嘧啶碱基的转换。
2022年10月13日,华东师范大学李大力与宋高洁以及广西医科大学赵永祥合作在Nature Chemical Biology 杂志在线发表题为“Engineering a precise adenine base editor with minimal bystander editing”的研究论文,该研究生成了在1-2nt核苷酸编辑窗口内精确催化A -to- G转化而不诱导细胞和啮齿动物胚胎中的C-to-T转化的ABE9。研究证明了它能精确纠正近50%致病的单核苷酸变异 (SNVs) ,特别是在具有极低比例的Cas9独立RNA和DNA脱靶效应的均聚腺苷位点。总之,ABE9实现了高精度、低脱靶的碱基编辑,这不仅为基础研究带来新的碱基编辑工具,更有望极大提高未来临床应用的安全性。
为了提高编辑效率和靶向范围,通过对eTadA单体的分子进化,开发了两组新的ABE变体,ABE8e和ABE8s。ABE8e是最高效和兼容的ABE变体,其活性比ABE7.10提高了3到11倍,同时它还扩展了编辑窗口。在小鼠和非人类灵长类动物的肝脏或镰状细胞贫血患者的造血干细胞中,ABE8e和ABE8s也显示出相当高的编辑效率,显示出它们在基因治疗方面的潜力。然而,随着脱氨基活性的增加,ABE8e表现出显著的Cas9独立的DNA和RNA脱靶编辑。
虽然ABE8变体是高效的,但编辑窗口也扩大了,对旁观者腺嘌呤的编辑率显著增加。此外,一些研究表明,ABE7.10具有胞嘧啶脱氨基活性,使C-to-T/G/A转换偏好TCN基序,证明ABEs也在细胞系和动物胚胎中诱导非靶向的旁观者胞嘧啶突变。消除腺嘌呤和胞嘧啶的旁观者效应和Cas9独立的ABEs脱靶编辑是至关重要的,特别是在临床应用中。
在这项研究中,通过结构导向工程,该研究发现带有N108Q突变的ABE8e减少了腺嘌呤和胞嘧啶的旁观者编辑,并引入额外的L145T突变(ABE9),进一步将编辑窗口细化到1-2个核苷酸,消除了对胞嘧啶的脱靶编辑。
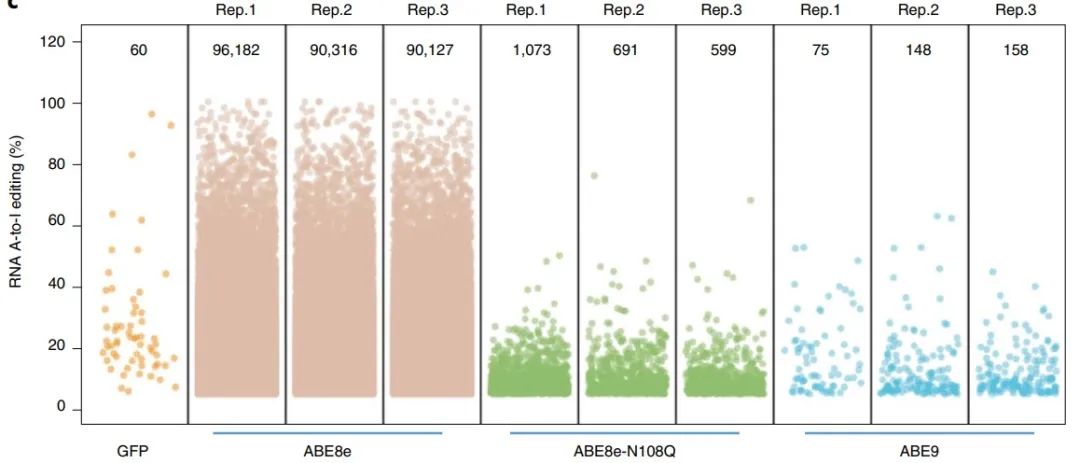
ABE8e, ABE8e- N108Q和ABE9RNA的脱靶编辑活性(图源自Nature Chemical Biology )
更重要的是,ABE9能够将DNA/RNA脱靶事件降低到背景水平。此外,ABE9还精确编辑了致病均聚腺苷位点上原间隔序列的A5位置(精度是ABE8e的342.5倍),并通过导向RNA -靶序列对文库确认。
由于编辑窗口最小化,当与Cas9突变体融合时,比如SpRY几乎不需要任何PAM序列,ABE9-SpRY可以通过适当的sgRNA精确靶向任何腺嘌呤,由此ABE9可以进一步扩大靶向范围,以精确校正致病的单核苷酸突变体,扩大原间隔相邻基序的相容性。
综上所述,该研究证实ABE9在非常狭窄的编辑窗口下是准确的。更重要的是,通过一个包含超过9000个靶标的gRNA -靶对库,数据表明,ABE9可以被认为是一个聚焦于1 – 2nt核苷酸编辑窗口的ABE的效率最高。这可能是迄今为止最准确的ABE。重要的是,ABE9在DNA和RNA水平上几乎没有诱导脱靶效应(无论是Cas9依赖还是独立),这不仅对基础研究很重要,对临床应用也非常重要。
华东师范大学生命科学学院陈亮,张舜,薛念念、洪梦佳以及张晓辉为该论文的共同第一作者,华东师范大学为第一单位,华东师范大学李大力教授,宋高洁教授和广西医科大学赵永祥教授为本文通讯作者。
原文链接:
https://www.nature.com/articles/s41589-022-01163-8


