生存期超10年!二次复发伴肝脾胰转移的BRCA野生型IV期卵巢癌患者创造生命奇迹
时间:2023-07-12 19:26:37 热度:37.1℃ 作者:网络
大约10%的卵巢癌患者诊断时即为IV期,IV期上皮性卵巢癌人群的5年相对生存率仅仅为31%,治疗方式主要依靠肿瘤细胞减灭术联合全身化疗。近年来,随着对卵巢癌靶向治疗研究的不断深入,PARP抑制剂维持治疗显示出良好疗效,助力卵巢癌患者实现更长生存。本期介绍的是一例BRCA未突变的卵巢癌IV期患者,患者术后二次复发并伴肝脏、脾脏和胰腺转移,经手术+化疗后,肿瘤标志物CA125降至正常水平,后采用PARP抑制剂维持治疗,PFS已达40个月,且无明显不良反应,发病至今生存期已超10年!
病例诊疗经过
基本情况
患者女,64岁,初次入院时间:2013-03-28。
主诉:下腹胀痛3个月。
现病史:患者绝经7年,3个月前无明显诱因出现下腹部绞痛,未予重视,持续1个月后自行缓解;4天前无明显诱因感下腹胀痛,就诊于外院,超声检查示胆总管上段扩张,大量腹腔积液;盆腔混合性肿块,多考虑卵巢囊腺瘤;胃镜检查示胆汁反流性胃炎伴糜烂;腹水病理检查可疑乳头状腺癌细胞;给予“抗炎治疗”4天(具体不详),效果不佳,遂来我院就诊。自发病以来,患者体重已下降10 kg。
既往史:29年前行双侧输卵管结扎术,23年前因“胆结石”行胆囊切除术,术中输注同型红细胞悬液,均无并发症。
个人史:24岁结婚,丈夫体健,生育史2-0-0-2,2006年自然绝经。
家族史:无特殊。
体格检查:体温37.9℃,脉搏84次/分,呼吸18次/分,血压130/80 mmHg,一般情况好,心肺等查体无异常。右上腹部可见长约8 cm的纵行陈旧性瘢痕,于耻骨联合上2横指处可见长约2 cm的纵行陈旧性瘢痕。
妇科检查:外阴已婚经产式;阴道通畅,黏膜光滑,分泌物不多;宫颈光滑,常大,无举痛;宫体中位,如孕8周大小,外形不规则,表面欠光滑,质中,有压痛;子宫后壁可触及约1.0 cmx0.5 cm两突起,质中,活动度差;右侧附件有增厚,未及明显包块,压痛阳性;左侧附件可触及大小约10 cmx8 cmx10 cm实性包块,活动度差,压痛阳性。
辅助检查:CA125:602.55 U/mL;血小板:405x109/L;纤维蛋白原含量:4.74 g/L;D-二聚体:2.3 mg/L;纤维蛋白原降解产物:17 mg/L。
超声检查:子宫3.3 cmx3.1 cmx2.7 cm,内膜0.2 cm(双层);子宫后方可见大小约11.9 cmx7.9 cm的混合性包块,与子宫后壁肌层分界不清,实性为主,内有血流信号,内另可见数个无回声区,外形不规则;盆腹腔大量积液。
胸+全腹CT平扫:腹腔积液征象。
MRI:盆腔混杂包块(63.66 mmx99.15 mmx99.85 mm),盆腔积液并积液边缘结节样充盈缺损,考虑左侧卵巢来源恶性肿瘤并腹膜播散转移;右侧附件区异常信号,考虑恶变可能。子宫后壁、膀胱上壁外侧受侵不完全除外;双侧腹股沟多发淋巴结肿大。
初步诊断
1、卵巢癌
2、胆囊切除术后
初始治疗
剖腹探查术(2013-04-03):术中探查腹腔内见淡黄色腹水约4000 mL;子宫常大,左侧附件区可见一大小约5 cmx6 cmx7 cm的肿块,质脆,表面呈菜花样,与左侧肠管粘连;右附件未见明显异常;子宫前方及膀胱表面可见多个转移灶,直径约2-4 cm,部分病灶贴近输尿管入口处,肝脾胃表面未见明显异常;左侧附件区肿块+膀胱病灶术中冰冻病理检查提示左卵巢低分化癌,膀胱纤维组织内低分化癌浸润,术中见达膀胱粘膜层。
术中请我院泌尿外科协同手术,同家属交代病情后,有输尿管外置风险,家属决定放弃膀胱病灶完整切除术,遂行次全子宫+双附件+大网膜切除术+盆腹腔病灶切除术,钝锐性分离膀胱表面及直肠前方肿块,尽可能缩小残留病灶,残留肿瘤直径<1 cm。
术后病理
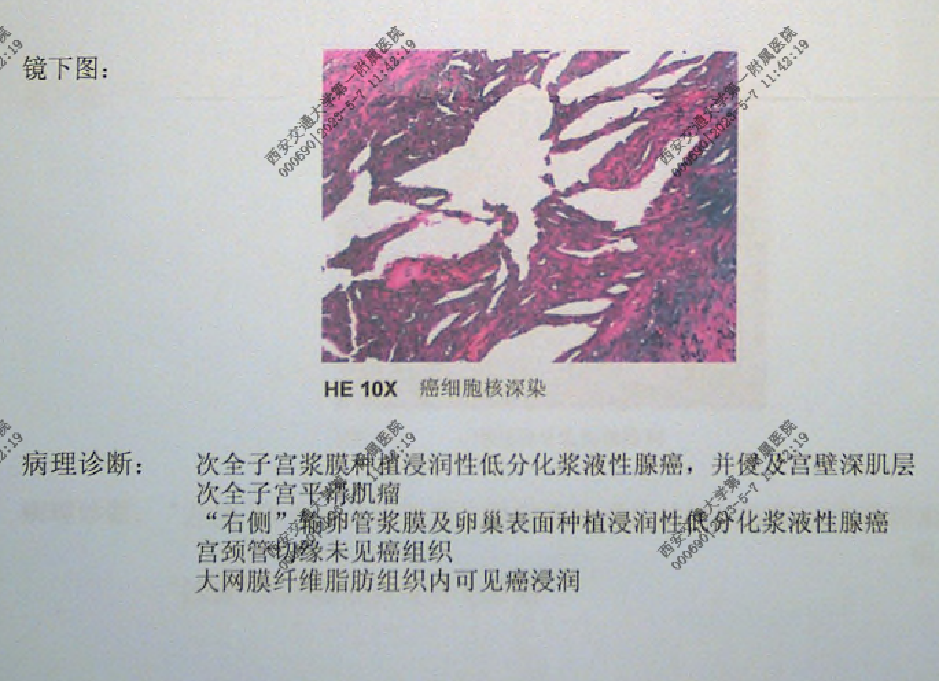
术后诊断
1、卵巢癌IV期
2、胆囊切除术后
术后化疗
腹腔灌注(2013-04-04/2013-04-09):重组人白介素-2(100 IU)+顺铂(40 mg)。
紫杉醇脂质体240 mg+卡铂400 mg化疗8程,2013-10-23入院行第8次化疗,查CA125降至1.65 U/mL,后于门诊随诊。
第一次复发
2016-11-24,复查CT:肝脾内低密度影,建议增强,盆腔未见明确复发迹象。复查CA125:66.1 U/mL。
2017-02-08,复查CT:肝脾内病灶,多考虑恶性病变;双侧腹股沟可见多发小淋巴结影。复查CA125:91.1 U/mL。
诊断:复发性卵巢癌
第一次MDT:影像科、肝胆外科和妇产科MDT结果:肝内病灶直径4.5 cm,无法手术及射频消融干净,无法达到R0,决定化疗。
化疗:紫杉醇脂质体270 mg+卡铂600 mg,首次化疗时间2017-02-18。
第5周期化疗后患者出现IV度骨髓抑制(发热、乏力,白细胞0.97x109/L,血小板68x109/L,血红蛋白92 g/L),给予升白细胞及升血小板治疗。
第6~7周期:紫杉醇脂质体270 mg+卡铂500 mg;第6周期复查CA125降至9.5 U/mL,7程化疗后于门诊随诊。
影像学评估
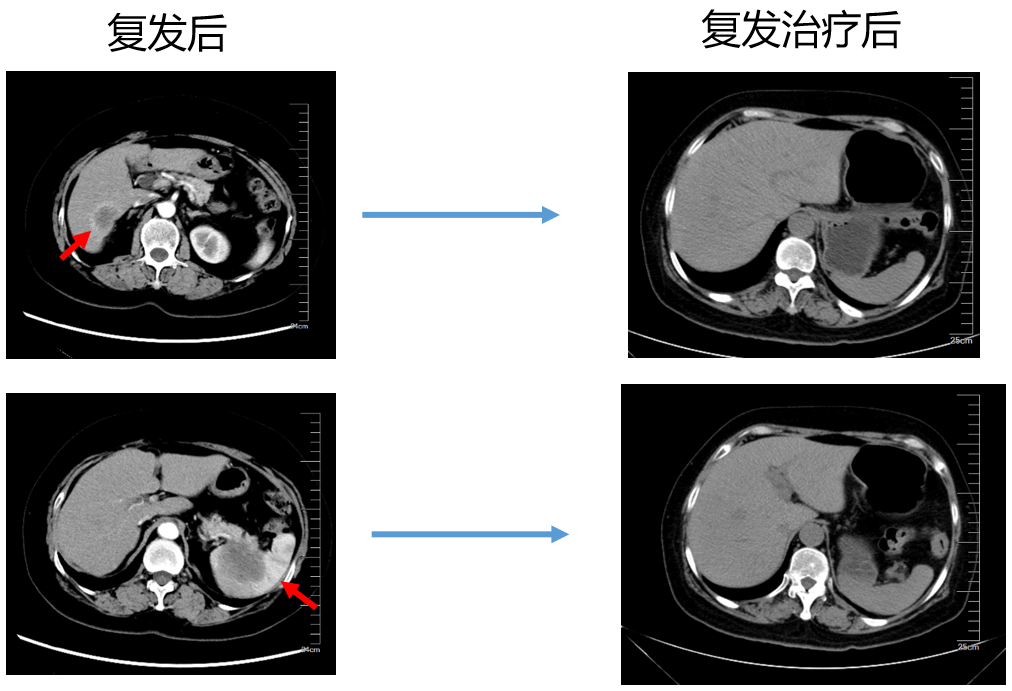
第二次复发(2019-03-07)
复查CA125:39.9 U/mL。
全腹+盆腔CT(请我院王秋萍主任医师会诊):脾脏肿块呈弱强化,分叶状,累及胰尾,经抗肿瘤治疗癌灶减小至29 mm(2017-04-18),后又增大,至2018-11-01脾内病灶呈双球影,直径约25.8 mm、31 mm。近日片内病变增大,直径分别约39.5 mm、42.8 mm,脾前缘隐约可见略低密度影,疑似新发病灶;肝右叶S6段包膜下病灶,呈弱强化,经抗肿瘤治疗后于2017-04-18缩小(22 mm vs. 37 mm),前片(2018-11-01)病灶显示不清,2019-05-09显示病灶直径约28.9 mm;上述病灶均考虑转移癌。

增强CT:慢性肝损害征象,肝右后叶钙化灶;脾内类圆形模糊稍低密度灶,增强扫描轻度强化,转移不除外。
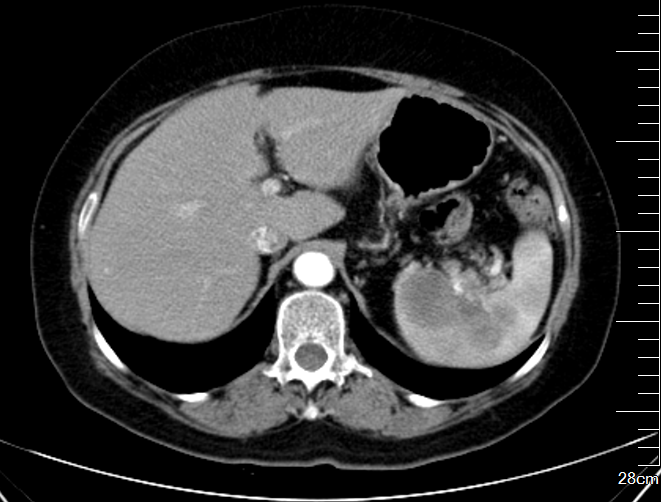
诊断
1、复发性卵巢癌(二次)
2、肝脏转移癌
3、脾脏转移癌
4、胆囊切除术后
第二次MDT:此次复发肝内病灶小,肝脏经皮超声引导下射频消融可彻底消除,其他部位病灶可手术切除。
腹腔镜脾脏切除+肝癌切除备射频消融术(2019-05-28):腹腔未见明显腹水;大网膜同腹壁粘连,游离后可见肝脏色红,网膜同肝脏表面致密粘连,肝十二指肠韧带未见异常,肿瘤深在于肝肾间隙,难以暴露;脾脏大小约9 cmx6 cmx5 cm,与周围组织及胰体尾部粘连严重,游离脾脏周围粘连,可见脾门处存在一大小约4 cm的白色质硬包块;遂决定行全麻下腹腔粘连松解术+胰体尾部+脾切除+肝癌射频消融术,术后给予抗酶及对症治疗。
术后病理:脾脏及部分胰腺组织内转移性低分化腺癌,侵及局部脾脏被膜;染色结果提示为卵巢癌高级别浆液性癌转移,胰腺切缘未见癌组织。
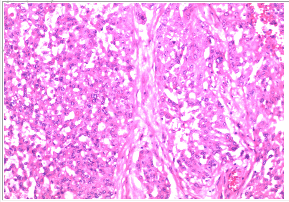
术后诊断
1、复发性卵巢癌(二次)
2、肝脏转移癌
3、脾脏转移癌
4、胆囊切除术后
术后化疗:紫杉醇脂质体270 mg+卡铂500 mg,首次化疗时间2019-06-07。第5周期化疗间歇第7天查白细胞3.3x109/L,中性粒细胞0.52x109/L;第6周期化疗前复查CA125降至8.6 U/mL。第6~7周期(2019-11-19)化疗方案调整为紫杉醇脂质体270 mg+卡铂400 mg。
基因检测:未检测出BRCA1/2突变。
维持治疗:2019-12入组临床试验(氟唑帕利胶囊对比安慰剂用于复发性卵巢癌的随机、双盲、对照、多中心III期临床研究),予患者氟唑帕利150 mg bid po,服药期间CA125指标一直维持在正常水平,未发生明显不良反应,截至2023年4月末次随访,仍为CR状态,PFS3已达40个月。
CA125变化

病例小结

专家点评
卵巢癌深藏在骨盆腔中,早期很难被患者察觉,多数情况是在出现腹水、腹胀时才被发现,当被发现时70%~80%已为晚期,且大多数患者会复发,其5年生存率仅为40%,过去30年里这个数字仅提高了5%。晚期卵巢癌患者的预后更差,且因一般状况较差,很多患者难以耐受化疗的副作用,因此,治疗应以延长患者的生存期、改善生存质量为目标,既要考虑药物毒性又要兼顾疗效。
本例中患者因“下腹胀痛3个月”就诊,查肿瘤标志物CA125达602.55 U/mL,MRI示盆腔混杂包块,盆腔积液并积液边缘结节样充盈缺损,考虑左侧卵巢来源恶性肿瘤并腹膜播散转移,遂行次全子宫+双附件+大网膜切除术+盆腹腔病灶切除术,残留肿瘤直径<1 cm,术后诊断为卵巢癌IV期,术后化疗后复查CA125降至1.65 U/mL。该患者二次复发伴肝脏、脾脏和胰腺转移,经手术+化疗后,CA125降至正常水平,后入组氟唑帕利临床试验,采用氟唑帕利150 mg bid维持治疗,服药期间CA125指标一直维持在正常水平,未发生明显不良反应,患者自诉用药期间身体状况良好,未感知到不适,维持了良好的生活质量,截至末次随访2023-04-13,PFS已达40个月。
近年来,PARP抑制剂用于铂敏感复发卵巢癌患者的维持治疗研究取得较大突破,已被公认为铂敏感复发后患者的标准维持治疗。本例患者入组的FZOCUS-2临床试验是氟唑帕利用于铂敏感复发卵巢癌患者维持治疗的随机、双盲、对照、多中心III期研究,入组252例患者,截至2020年7月1日,中位随访8.5个月。结果显示,氟唑帕利组和安慰剂组患者的中位PFS分别为12.9个月和5.5个月(HR=0.25,95%CI 0.17~0.36)(FZOCUS-2研究中位PFS尚未成熟,12.9个月为根据Kaplan-Meier曲线预测值)。亚组分析显示,gBRCA突变人群复发或死亡风险降低86%,非gBRCA突变人群复发或死亡风险降低54%。该研究表明,氟唑帕利可为不同BRCA状态的铂敏感复发卵巢癌患者带来PFS获益。
此外,氟唑帕利的安全性良好,不良事件主要为1~2级;无论是血液学还是非血液学不良事件,≥3级事件很少,即使发生也是在可控制、可预期的范围内。且值得一提的是,PARP抑制剂可能导致骨髓增生异常综合征(MDS)或急性髓细胞白血病(AML)等严重并发症,此类并发症一旦发生则较难治愈,FZOCUS-2研究中期分析时尚未观察到该类并发症,足以说明氟唑帕利的高效、低毒。氟唑帕利在非血液学不良反应方面,≥3级不良反应谱较窄,仅0.6%患者出现恶心,1.2%患者发生乏力/虚弱,发生率极低,患者不受这些不良反应困扰后,生活质量会明显提高,给予临床医生的反馈也会更好。FZOCUS-2研究中,仅2例(1.2%)患者因AE终止治疗,这些数据和FZOCUS-3研究一脉相承,非常优秀,体现了患者对氟唑帕利的良好耐受性。患者对于药物的耐受性越好,代表着接受治疗的时间越长,也更能从维持治疗获益。氟唑帕利的安全性表现,体现出其是非常适合长期维持治疗的PARP抑制剂。
本例患者为BRCA未突变的IV期卵巢癌,二次复发伴肝脏、脾脏和胰腺转移,既往化疗过程中发生过IV度骨髓抑制,综合考虑患者病情,遂在其CA125达到正常后,推荐入组了临床试验,采用氟唑帕利维持治疗,显著延长了无铂间期,改善了预后,而且耐受性好,截至目前,患者生存期已超10年。本例患者作为受试者代表,其治疗过程充分验证了FZOCUS-2研究的结果,即氟唑帕利在铂敏感复发卵巢癌患者的维持治疗中兼顾疗效和安全性。本病例提示临床医生,对于复发卵巢癌患者,需要通过规范化治疗,有计划地为其提供个体化综合治疗方案。同时,针对其病情特征和发展情况,医患之间密切配合,这样才能为患者争取最长的生存时间和最好的生存质量。


