JMC封面:福州大学徐芃/李金宇/黄明东等发现2款老药可以靶向尿激酶受体,具有抗肿瘤新用途
时间:2023-05-03 06:24:17 热度:37.1℃ 作者:网络
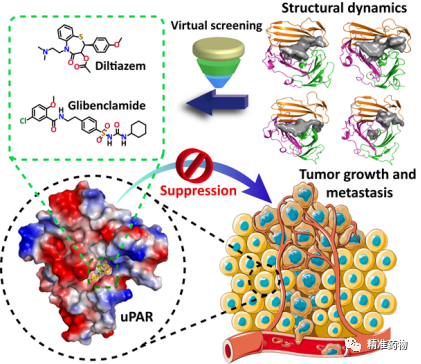
2023年4月27日,国际药物化学知名期刊JOURNAL OF MEDICINAL CHEMISTRY(IF: 8.039,中科院医学I区,Top期刊)在线发表了福州大学徐芃/李金宇/黄明东教授的最新研究成果“Structural Dynamics-Driven Discovery of Anticancer and Antimetastatic Effects of Diltiazem and Glibenclamide Targeting Urokinase Receptor”,该研究基于结构动力学虚拟高通量筛选,发现临床用药地尔硫卓和格列本脲可通过阻断尿激酶受体相关通路抑制肿瘤生长和转移。地尔硫卓和格列本脲分别是常用的降压药和抗糖尿病药,具有高度的安全性和已知的药代药效动力学性质。本研究拓展了这两种传统药物新的潜在临床应用。福州大学博士研究生周阳、宋美如(现为河南省科学院助理研究员)和硕士研究生谢道情为共同第一作者, 徐芃教授、李金宇教授和黄明东教授为文章的通迅作者。该文章被选为该期刊2023年66卷8期的封面文章(图1)。

尿激酶受体(uPAR),是一种膜锚糖蛋白,已被证实与癌症发展和转移密切相关。uPAR及其配体尿激酶型纤溶酶原激活剂(uPA)被发现在各种癌细胞表面过度表达,包括前列腺癌和乳腺癌细胞,但在大多数正常组织中却没有。在实验模型或临床前研究中,对肿瘤细胞表面的uPA-uPAR相互作用的干预被广泛认为可以抑制癌症的增殖和侵袭。因此,阻断uPA-uPAR相互作用的分子被认为是有效的抗癌和抗转移药物。虽然没有uPAR抑制剂被批准用于癌症治疗,但一种uPAR靶向肽示踪剂在临床试验二期中对前列腺癌患者的预后成像显示了令人振奋的结果(NCT02930724)。
uPAR与各种配体结合的晶体结构已经被大量报导,基于这些晶体结构,针对uPAR的uPA结合口袋的小分子抑制剂已经通过理性设计或筛选被开发出来。然而,研究团队(Nat Commun, 2022, 13:1665)以及其他课题组(J Biol Chem, 2012, 287:34304)发现无配体的uPAR(apo-uPAR)具有内在的高灵活性,并在几个具有不同结构特征的构象状态中动态平衡存在。与配体结合的uPAR(holo-uPAR)结构可能只代表无配体apo-uPAR的一种构象状态。因此,在基于结构的虚拟筛选活动中,有必要考虑uPAR的共存动态构象状态。
分子动力学模拟揭示apo-uPAR的不同构象
为了探索apo-uPAR的构型空间以进行抑制剂筛选,我们首先对apo-uPAR在水溶液中进行了长时间尺度(30μs)的分子动力学模拟,结果显示DI结构域决定了apo-uPAR的固有灵活性特征,并且得到了apo-uPAR的四个构象组合,占有率分别为45.9%、18.8%、17.8%和13.1%,同时观察到活性结合区域的变化从跨度可从423到857埃(图2)。
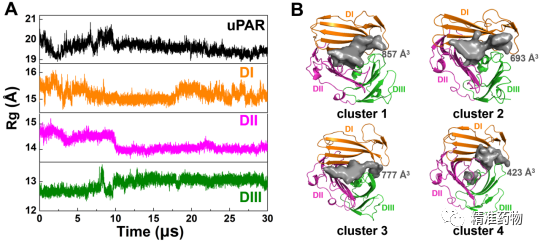
图2 apo-uPAR的分子动力学模拟
uPAR抑制剂的虚拟筛选和实验验证
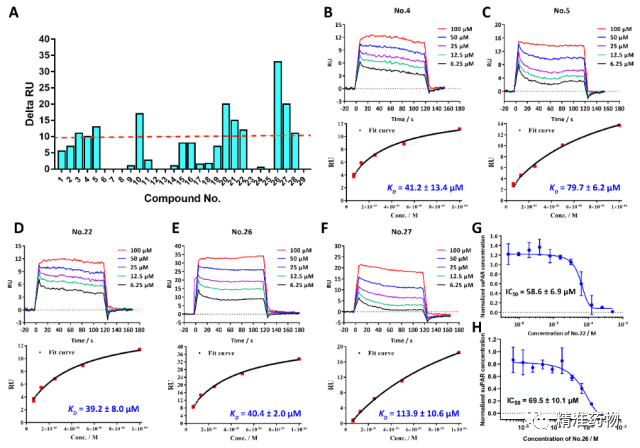
基于MD模拟的四个apo-uPAR构象,我们使用Discovery Studio 2017 R2 Client中的CDOCKER模块对TargetMol Drug Repurposing Compound Library L9200(包括4240个化合物,https://www.targetmol.com/all-compound-libraries)进行了基于多重对接的虚拟筛选,并在7个不同的评分函数上进行共识分析,对筛选出的化合物利用表面等离子体共振技术和ELISA实验进行验证评估(图3),最后筛选得到地尔硫卓(22)和格列本脲(26)两个良好uPAR抑制剂。
地尔硫卓和格列本脲抑制uPA-uPAR相互作用的分子机制
同时我们也利用对接和分子动力学模拟,揭示了地尔硫卓和格列本脲阻断uPA-uPAR相互作用的分子机制(图4)。在uPAR:22复合物中,22与R53和R137的侧链建立氢键。值得注意的是,22的苯环与由DI(L55和L66)和DII(L123、V125、L150和L168)的残基组成的疏水区形成疏水接触。格列本脲与uPAR形成了两个稳定的(G253的骨架和K50的侧链)和一个瞬时的(N259的侧链)氢键。此外,26的氯苯基与I261和H47的侧链之间分别观察到疏水和π堆积作用。26的结合因其中心苯环和E134的羧基之间的阴-π相互作用而得到进一步加强。
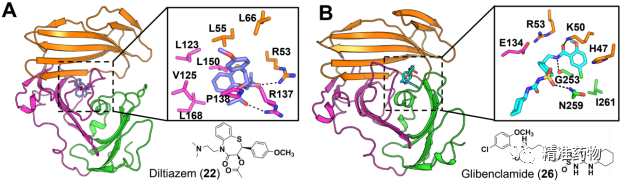
图4 分子动力学模拟预测的uPAR与地尔硫卓和格列本脲的结合模式
地尔硫卓和格列本脲在体内外通过作阻断uPA-uPAR相互作用抑制肿瘤的生长和转移
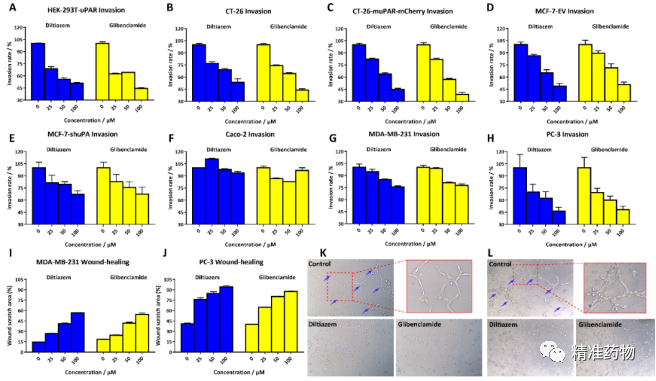
另外,我们也在细胞水平发现地尔硫卓和格列本脲能够抑制多种肿瘤细胞的侵袭和血管生成,且这种抑制侵袭的作用是通过uPAR介导的(图5)。动物模型也证明地尔硫卓和格列本脲在体内可以有效抑制肿瘤的生长和转移(图6)。尤其值得注意的是,地尔硫卓可在低于临床使用剂量的情况下达到抗癌和抗转移的效果,这一现象表明其潜在的临床研究价值。

总结:在这项研究中,为了提高筛选的准确性,研究团队进行了长时间尺度的分子动力学模拟,获得了四个代表性的apo-uPAR构象,并以这四个构象作为筛选的靶标结构。利用基于结构动力学的虚拟高通量筛选,结合实验验证,发现地尔硫卓和格列本脲这两种药物与uPAR有较强的结合,KD值在微摩尔范围内。此外,这两种化合物在体外和体内均能够以uPAR依赖的方式有效地抑制肿瘤的生长和转移,并且该抑制活性呈uPAR依赖性(图7)。这项工作不仅提供了两种有效的uPAR抑制剂,而且还报导了关于地尔硫卓和格列本脲潜在的标签外抗肿瘤和抗转移用途的概念验证性研究。
本研究得到了福建省自然科学基金(2021J06012, 2019J06007, 2021Y4008, 2019-WJ-17, 2021G02004和2020J05092)、国家自然科学基金(22173020, 22077016和82070142)、福建省教育科学研究项目(JAT190705)和福建省超级计算中心的支持。
通讯作者简介:
黄明东,福州大学化学学院教授, “生物药光动力治疗技术国家地方联合工程研究中心”主任。于1993年获得美国俄勒冈州立大学博士学位,曾在美国Scripps研究所和哈佛大学医学院工作,曾经以项目负责人身份承担了美国NIH的RO1和美国心脏协会SDG等研究项目。中科院“百人计划”国家基金委“杰出青年科学基金”,国家级百千万人才,国务院政府特殊津贴,福建省科技创新领军人才。学术研究方面,发表原创科研文章200余篇,七篇发表在《科学》和《自然》及子刊杂志上。作为项目负责人主持了国家基金委重点项目、国家基金委杰出青年项目、国家基金委重大国际合作项目、国家科技部863项目、科技部国家重点研发计划政府间/港澳台重点专项、福建科技厅重点项目等研究工作。应用研究方面,获得诺和诺德-中科院研究专项、海正制药集团、美国辉瑞制药等的研究经费支持。国际合作方面,组建了中国丹麦第一个双边研究中心《中国丹麦肿瘤和水解酶联合研究中心》(2008年-2014年),并联合培养博士研究生4名。此外,获得中法先进研究项目和中法蔡元培基金的资助,共同开展研究工作和研究生联合培养。作为会议主席,主办了三次国际会议。联系方式:[email protected]。
李金宇,教授、博士生导师,福州大学化学学院院长助理。2011年于荷兰阿姆斯特丹大学和法国里昂高等师范学院获化学与计算材料学双硕士,2015年于德国亚琛工业大学医学院获自然科学博士学位,同年于德国于利希研究中心先进模拟研究院从事博士后研究,2016年任福州大学化学学院教授、生物药光动力治疗技术国家地方联合工程研究中心PI。研究方向为蛋白质计算化学生物学理论方法开发与应用。已主持国家自然科学基金面上项目、青年项目、福建省自然科学基金杰出青年等国家及省部级研究项目5项,曾荣获福建省杰青、福建省闽江学者特聘教授,近五年以通讯作者(含共同)在Nat Chem Biol、J Med Chem、Eur J Med Chem、ACS Catal等期刊发表论文30余篇,以第一发明人申请发明专利4项、软件著作权1项。课题组诚聘人工智能药物发现、生物大分子模拟相关方向优秀青年教师,具体要求和待遇请联系:[email protected]。
徐芃,福州大学生物科学与工程学院教授,本科毕业于厦门大学化学系,硕士毕业于中科院福建物质结构研究所,导师为“国家杰青”黄明东研究员,博士毕业于丹麦奥胡斯大学分子生物学与遗传系,导师为Peter A. Andreasen教授。博士毕业后回到中科院物构所工作,任助理研究员和副研究员职位。其后,前往新加坡科技局分子与细胞生物学研究院从事博士后研究工作,合作导师为新加坡科学院院士Wanjin Hong教授。2020年8月以“闽江学者”特聘教授入职福州大学生物科学与工程学院。主要研究方向为凝血与纤溶系统的化学生物学研究及光动力治疗药物的设计与开发。以第一作者或通讯作者身份在Angew Chem Int Edit,J Med Chem, Food Chem,ACS Appl Mater Interfaces等知名SCI期刊上发表了20余篇具有国内外影响力的学术论文;申请国家发明专利了十余项,已授权五项;主持五项国家和省部级项目,累计主持纵向研究经费超过360万元人民币。联系方式:[email protected]。
原始出处:
Structural Dynamics-Driven Discovery of Anticancer and Antimetastatic Effects of Diltiazem and Glibenclamide Targeting Urokinase Receptor,J Med Chem (IF: 7.45; Q1) . 2023 Apr 27;66(8):5415-5426. doi: 10.1021/acs.jmedchem.2c01663


