Nature子刊:俞立团队揭示迁移体的新功能——促进血管生成
时间:2022-11-30 05:59:30 热度:37.1℃ 作者:网络
早在2014年,清华大学俞立团队在 Cell Research 发表论文【1】,发现了一种新的细胞器——迁移体(Migrasome)。细胞迁移过程中在后面留下的一些弹性纤维(收缩丝),在弹性纤维的顶端或交叉处会生长出一些囊泡,这些囊泡也就是迁移体。细胞迁移过程中会通过收缩这些纤维的管道,持续把一些胞内物质运输到迁移体中,随后收缩纤维断裂,迁移体被释放,继而被细胞外空间或周围的细胞所摄取。
研究表明,会动的细胞基本都有迁移体,但迁移体有哪些功能现在还不是很清楚。2021年5月,俞立团队在 Cell 发表论文【2】,发现在细胞外的迁移体中存在线粒体,并进一步揭示了迁移体的功能——轻度线粒体应激后,受损的线粒体会被转运到迁移体中,再被迁移体运送到细胞外。这一过程被命名为线粒体胞吐(Mitocytosis),是细胞对线粒体的一种质控过程,把受损的线粒体清理出去。
2022年11月28日,清华大学俞立团队在 Nature Cell Biology 期刊发表了题为:Monocytes deposit migrasomes to promote embryonic angiogenesis 的研究论文【3】。
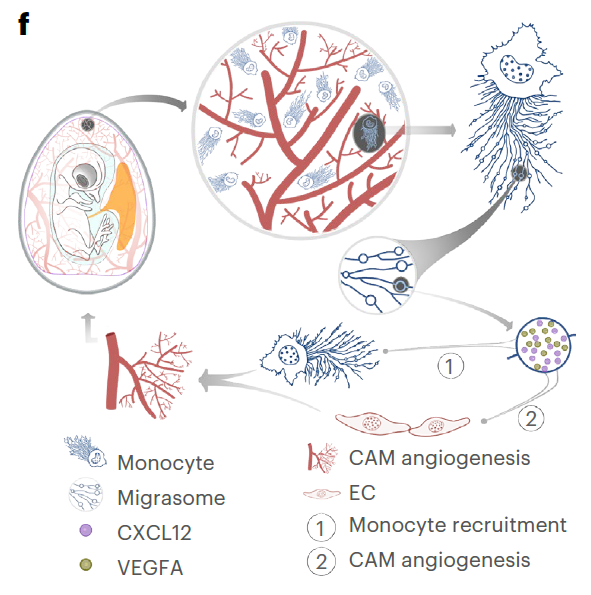
该研究在鸡胚绒毛尿囊膜(CAM)上发现有高度迁移的细胞(单核细胞),它们大量形成迁移体,该研究强调了单核细胞在胚胎发育过程中血管生成的重要性。基于这些发现,研究团队提出了一个血管生成的“先锋模型”,其中迁移的单核细胞作为先行者,通过沉积富含促血管生成因子的迁移体,为血管生创造有利微环境,促进血管生成。

血管系统的发育对胚胎发育至关重要。事实上,血管系统是胚胎发育的第一个有功能的器官。血管生成是由一系列血管生成蛋白驱动的,包括血管生成生长因子、趋化因子和细胞外基质蛋白。其中血管内皮生长因子(VEGF)起主导作用,这些因子通常由生长中的血管附近的细胞分泌,然后作用于内皮细胞(ECs)上的受体,通过与细胞外基质相互结合,保持较高的局部浓度,为血管新生创造微环境。
巨噬细胞和单核细胞在血管生成中的作用已被证实,例如,在对各种化学诱导剂的反应中,单核细胞外渗到肿瘤,并在肿瘤内部成熟为肿瘤相关的巨噬细胞,在那里它们通过分泌各种生长因子和细胞因子促进血管生成,包括VEGFA。在肿瘤发生过程中,巨噬细胞除了参与血管生成外,还通过分泌VEGFA促进桥血管化,在周围神经元再生中发挥重要作用。
迁移体(Migrasome)是俞立团队发现的一种新型细胞器,在细胞迁移时,许多称为收缩丝的结构从细胞的后缘拉出,在这些收缩丝的顶端或交叉处会生长出一些囊泡,这些囊泡也就是迁移体。迁移体的形成依赖于四次跨膜蛋白Tetraspanin(TSPAN4),这些蛋白质形成富含Tetraspanin的微结构域,然后组装成迁移体。迁移体被认为是细胞与细胞之间通讯的细胞器。
在这项研究中,研究团队发现由单核细胞形成的迁移体在鸡胚胎血管生成中起着重要作用。在鸡胚胎发育的第9天,观察到鸡胚绒毛尿囊膜(CAM)上高度迁移的细胞大量形成迁移体。通过单细胞测序和抗体染色,研究团队将这些高度迁移的细胞识别为单核细胞。单核细胞的减少导致毛细血管形成受损,这表明这些细胞在血管生成中发挥重要作用。此外,该研究还发现这些迁移体能够诱导体内血管生成和体外内皮细胞管的形成。
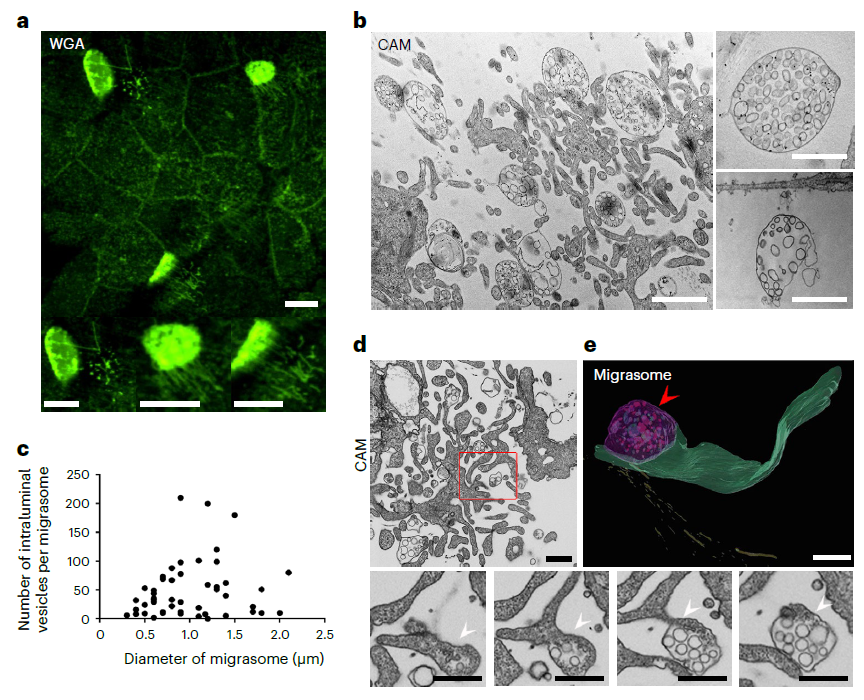
TSPAN4是斑马鱼和哺乳动物细胞中迁移体形成的关键基因,敲低或敲除TSPAN4会抑制迁移体的形成并阻碍血管生成,而这可以通过向野生型鸡胚绒毛尿囊膜(CAM)中添加纯化的迁移体来挽救。
此外,研究团队发现迁移体可以在体外和体内招募单核细胞,敲低或敲除TSPAN4可显著减少毛细血管形成区域的单核细胞数量。这种单核细胞募集的缺陷可以通过添加迁移体来修复。这些生理效应的机制基础是VEGFA和CXCL12在迁移体中富集。添加迁移体可以挽救VEGFA或CXCL12敲低所引起的表型。因此,迁移体分别通过释放CXCL12和VEGFA来实现招募单核细胞和促进血管生成的功能。
先锋模型
在上述研究结果的基础上,俞立团队提出了血管生成的“先锋模型”,在该模型中,单核细胞通过沉积富含VEGF等血管生成因子的迁移体,在血管生成之前准备了一个促血管生成的微环境。
论文链接:
1. https://www.nature.com/articles/cr2014135
2. https://doi.org/10.1016/j.cell.2021.04.029
3. https://www.nature.com/articles/s41556-022-01026-3


