Nature遗传学评论:药物基因组学当下挑战与未来趋势
时间:2023-07-18 23:17:29 热度:37.1℃ 作者:网络
2023年1月,英国人类医学委员会(CHM)主席、利物浦大学Munir Pirmohamed教授在Nature Reviews Genetics上发表了题为“Pharmacogenomics: current status and future perspectives” 的综述,就当下药物基因组学(PGx)遭遇的挑战和未来趋势做出了分析及预测。
摘要
个体之间存在药物反应的差异,无论是在药物的有效性还是安全性方面,这种差异非常普遍。特别是随着老年人口的增加,这个问题可能日益严重,对全球来说是一个重要的挑战。为了研究这种个体差异的原因,涉及基因组因素的领域被称为药物基因组学。
随着基因分型技术的广泛应用和成本的降低,药物基因组学已经成为被广泛认可的基因组医学领域的核心内容之一。它已经开始在临床实践中得到应用,并成为许多国家关注的重点。然而,实施药物基因组学所面临的主要挑战之一是向医疗卫生系统提供相应的服务,包括改变当前的临床路径和填补医疗卫生人员在药物基因组学领域的知识差距。
此外,药物基因组学在药物发现和开发方面也有广泛的应用。越来越多的证据表明,在临床开发过程中,基于基因组定义的靶点能够提高成功率。因此,药物基因组学在药物研发过程中具有重要的意义。
前言
对食物和药物的个体反应差异已经有数千年的认识——公元前570年至公元前495年的毕达哥拉斯描述了一些人在摄入蚕豆后出现红细胞溶血的现象。现在已经知道,这种溶血反应是由于G6PD基因突变导致葡萄糖-6-磷酸脱氢酶缺乏症引起的,这是世界上最常见的人类酶缺乏症,全球约有4亿人受影响。
术语“药物基因组学”通常与其前身术语“药物遗传学”互换使用,传统上被定义为研究个体的基因组对药物的反应(有效性和/或安全性)产生的影响。我更喜欢更广泛的药物基因组学定义,即研究基因组技术以实现新药的发现和开发,并优化个体患者的药物剂量和选择,以最大限度地提高疗效和最小化毒性。
不同药物的疗效率据报道可变范围为25%至80%。2003年,艾伦·罗斯(Allen Roses)曾声称:“绝大多数药物(超过90%)只对30%或50%的人有效。”最近的分析显示,在美国十种销售额最高的药物中,每帮助到1个人,就同时有3到24个人并无疗效。这类数据很多,当考虑到个别药物时,可能相对不够精确。此外,确定药物的疗效(以及这种疗效在个体之间是否有差异)是复杂的——本文不详细展开,读者可以参考其他文章。
在药物安全方面,成人药物不良反应(ADR)占住院患者比例约6.5%,在多重疾病患者比例超过15%。此外,约有15%的住院患者受到ADR的影响。虽然这些数据是英国的数据,但其他国家也报告了类似的频率。
药物疗效差或安全性问题不仅对患者的治疗结果产生不利影响,也增加了资源有限的医疗卫生系统的成本。遗传因素不能解释所有变异,而且遗传贡献不仅在不同药物之间有所不同,而且在个体患者之间也有所不同。从临床的角度来看,药物基因组学的目标是摆脱目前的“一种药适用于所有人”或“一种剂量适用于所有人”的策略,转向更个体化的药物选择和剂量,以满足个体患者的需求。
尽管在过去几十年里,药物基因组学主要是学术研究的焦点,但政策制定者现在越来越关注药物基因组学在改善患者结果方面的作用,这可能有助于将其应用于临床实践。此外,来自制药行业的越来越多关于基因组定义的靶点在提高药物研发成功率方面的价值的证据,将进一步增加对这一领域的兴趣和研究。
在本综述中,通过临床相关的药物-基因关联示例,概述当前药物基因组学领域的现状,然后回顾将药物基因组学应用于临床实践所需的步骤。考虑到药物基因组学在药物研发中的作用,进一步探讨未来可能对药物基因组研究产生影响的因素,包括生物样本库的使用、罕见变异和多基因得分。
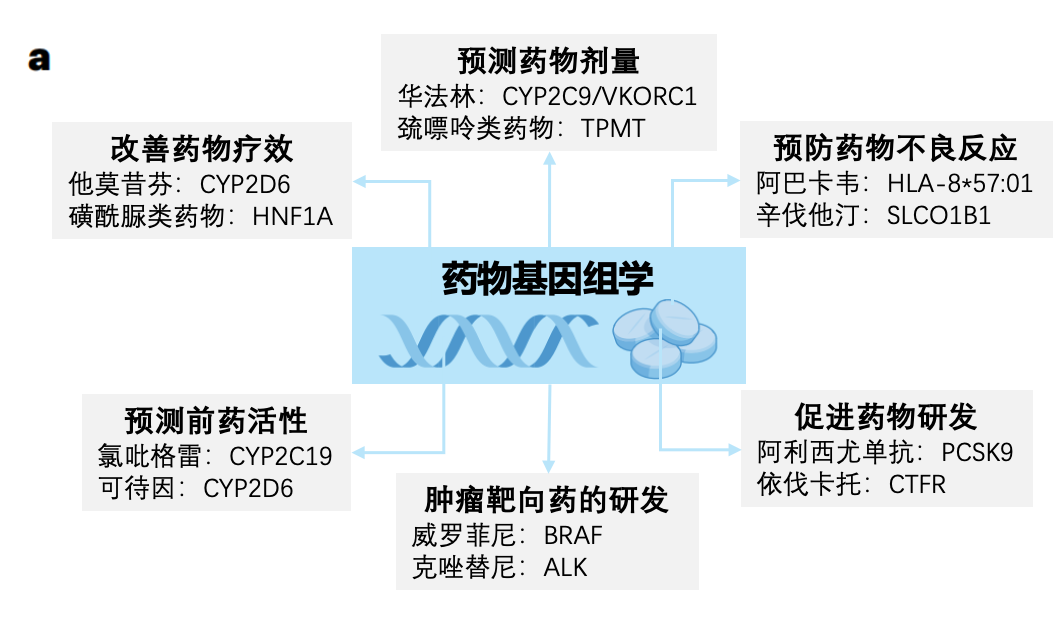
图1 药物基因组学前景展望
a、药物基因组学在以下方面具有重要意义:预测药物剂量(例如,基于硫酰胺甲基转移酶(TPMT)基因变异来预测硫嘌呤类药物(如6-巯基嘌呤)的剂量)、改善药物疗效(例如在罕见的HNF1A突变患者中使用磺酰脲类药物;也请参阅表3)、预测氯吡格雷和可待因等前药转化为活性代谢物的激活程度,以及通过对易感等位基因进行前瞻性基因分型来预防药物不良反应(例如,在使用辛伐他汀之前对SLCO1B1进行基因分型)。药物基因组学对药物发现和开发也具有重要意义,通过评估个体基因可遗传突变(Box 2)和体细胞遗传组(表1)来实现。
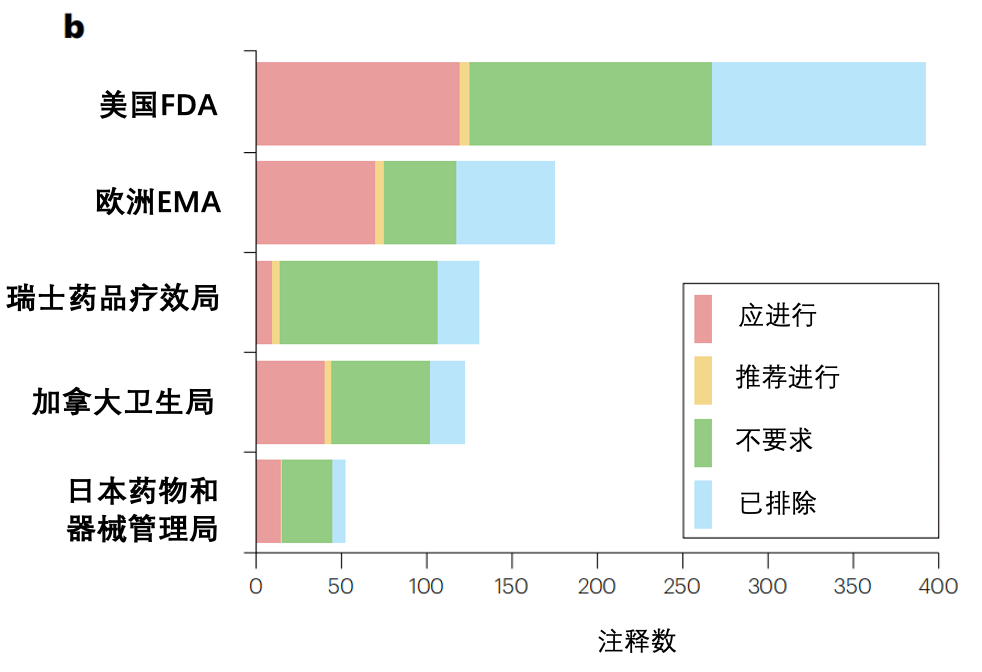
b、来自不同监管机构的药物标签中的药物基因组学信息。药物基因组学信息的数量以及药物标签中提供的指导意见因不同的监管机构而异。"testing required"和"testing recommended"指的是在某些情况下“应进行”或“应考虑”进行测试。"Actionable pharmacogenomics"意味着标签提供了有关药物-基因相互作用的信息,但不要求或建议进行基因分型。"Informative pharmacogenomics"指的是已排除药物-基因相互作用或其临床意义不大的药物,或者标签出现在FDA生物标志物列表中但不属于以上类别。注释计数来自2022年的药物基因组学知识库(PharmGKB)(https://www.pharmgkb.org/labelAnnotations;请注意,美国食品药品监督管理局、欧洲药品管理局和加拿大卫生局的数据将不断更新。瑞士疗效产品管理局的数据来自2019年。日本制药和医疗器械局的数据来自2016年)。b部分经PharmGKB授权修改使用。
药物基因的变异
参与决定药物反应的基因(即药物基因)的调控区域和编码区域中存在遗传变异,在人类群体中很常见(表1)。此外,受药物基因组变异影响的药物在临床实践中经常使用。例如,在美国,约50%的处方受到可操作的生殖系药物基因的影响。在英国,每年58%的患者至少被开具了一种受到药物基因多态性影响的药物。此外,随着年龄的增长,越来越多人容易患上需要药物治疗的疾病;因此,九成的70岁以上的老年患者将接受至少一种需要药物基因组指导的药物。
药物基因组知识库(PharmGKB)是一个全面的资源,提供关于药物-基因对的最新信息,包括药物标签注释和临床指南注释。
PharmVar是一个集中的数据存储库,提供关于药物基因变异的高质量数据。美国食品药品监督管理局(FDA)列有517个已包含在药物标签中的基因-药物关联,其药物基因组关联表列有121个药物-基因相互作用。然而,不同监管机构之间的药物基因组药物标签的协调尚不足够(图1b),这是由于对可操作性的不同看法以及法律法规和临床实践的差异。药物标签中的大部分内容仅供参考,而不是提供药物剂量或选择的指导;因此,临床医生开具处方时可能在很大程度上忽视这些信息。此外,尽管许多药物标签建议处方者避免药物间的相互作用,但往往不考虑可能导致与药物相互作用相同效果的药物-基因相互作用。例如,他莫昔芬(一种用于乳腺癌的雌激素受体调节剂)药物标签或产品特性摘要要求开具处方时避免可能与他莫昔芬相互作用并降低其效果的药物,但仅提供有关CYP2D6基因多态性的信息,而没有要求在使用药物之前对患者进行基因型分型。结果显示,约有10%的女性患者(即CYP2D6非功能性等位基因纯合子,即代谢能力差的人,海思医疗的产品学术资料称为“慢代谢者”),通过较少他莫昔芬使用剂量而获得更好的疗效。
基因与药物的关联基础
药物反应受药代动力学(机体对药物的作用)和药效动力学(药物对机体的作用)因素的共同影响。目前,我们对药代动力学决定的药物-基因相互作用的了解要比药效动力学决定的药物-基因相互作用的了解的更多,这反映了我们对药物药代动力学的了解要多于对药物作用机制的了解。在过去的50年中,在体外和体内研究了与药物药代动力学相关的四个主要过程——吸收、分布、代谢和排泄,并阐明了这些过程如何决定个体之间药物处理的变异。这些进展还表明,遗传因素在决定药物药代动力学方面起着重要作用。例如,对单卵和双卵双生子对的研究显示,美托洛尔和托瑞米特的药代动力学遗传学性状的遗传率分别为91%和86%。
在过去几十年中,基因分型和测序技术、统计遗传学分析方法和临床试验设计的进展推动了与药物反应相关的遗传变异的发现。药物基因组学数据主要来自于各种观察性研究,许多小型研究声称具有大效应,但结果在较大研究中并未没有得到复现。为了克服这个局限性,已经成立了许多联合组织(如国际华法林药物基因组学协作组织(IWPC)、二甲双胍基因组学(Met-Gen)和国际氯吡格雷药物基因组学协作组织(ICPC)),以增加样本量、共享数据开展合作分析。
随机对照试验(RCT)已被用于识别新的药物-基因关联,但这种方法不常见,通常是在完成主要试验后进行回顾性研究。RCT在确定基因-药物关联的临床应用价值方面的作用将在本文后面进行介绍。
全基因组关联研究(GWAS)是一种相对成本效益高且较为准确的方法,用于识别基因-药物相互作用,可能特别重要的是识别药效动力学的药物-基因相互作用,并为药物作用机制或毒性提供新的见解。然而,到目前为止,在GWAS目录中,仅有不到10%的研究了药物反应。此外,多年来,与复杂疾病GWAS中观察到的样本量增加不同,药物反应GWAS的样本量并未增加。这可能是由于定义药物基因组研究的准确表型、招募足够的样本量以及结果的复现等存在困难所致。尽管存在这些问题,但具有比复杂疾病更大规模效益, GWAS仍然是确定了药物基因组易感位点的主要技术手段。
剂量
剂量确定药物的疗效和安全性,而遗传因素在确定剂量方面起着作用。最好的例子是华法林,其代谢酶CYP2C9和受抑制酶VKORC1的多态性决定了每日或每周所需的剂量。这些基因的功能缺陷多态性与酶活性降低相关,因此需要较低的华法林剂量,以避免过度暴露并实现抗凝治疗。与抗癌药物剂量相关的遗传多态性也已被证实,例如TPMT和NUDT15基因与硫嘌呤类药物、DPYD基因与氟嘧啶类药物,以及UGT1A1基因与伊立替康等。在所有这些情况下,降低或去掉相关酶的活性的遗传多态性与抗癌药物代谢减少相关,导致全身过度暴露和剂量依赖性毒性,会引起骨髓抑制和/或严重腹泻等。
药物安全性
不良药物反应(ADRs)可以分为A型和B型反应,这两种反应都可能受到遗传因素的影响。在过去20年中,对ADRs的遗传易感因素的识别取得了很大进展。A型ADRs是药物药理作用的增强,表现出典型的剂量依赖性,减少剂量可以改善ADRs。前一节关于剂量的示例是A型ADRs的说明。
B型ADRs,有时称为特异反应,无法根据已知药物的药理学简单解释,不表现出明显的剂量依赖性,通常需要停药以改善ADRs。其中许多ADRs是免疫介导的。特别是在与HLA等位基因在易感这些反应中的作用方面取得了重大进展(表2)。事实上,一些关联与Mendelian疾病具有全基因组显著结果类似,例如与盐酸氟氯沙星肝炎和卡马西平过敏反应的关联分别在仅有51例和23例患者中发现。
阿巴卡韦过敏反应是转化性药物基因组学的典型代表。阿巴卡韦是一种抗HIV药物,可能引发严重甚至危及生命的过敏反应,与HLA-B57:01基因有关。与HLA-B57:01的关联已在全球范围内的观察性研究(包括前瞻性队列研究)和RCT中得到复现。全球的药物标签都包含了在开始使用阿巴卡韦之前进行基因型分型的建议:在实施HLA基因型分型后,HIV患者中使用该药物的阿巴卡韦过敏反应的发生率已接近于零。
HLA药物基因组学的进展已经产生了广泛的研究,以了解免疫介导的ADRs的机制(例如阿巴卡韦过敏反应)。新的发现表明,药物及其代谢产物与特定的HLA分子和T细胞受体相互作用,导致克隆性T细胞增殖和细胞因子分泌,进而引起组织损伤。
表1 携带至少一个可操作的药物基因组变异的人群比例

药物疗效
据估计,仅有15%的药物存在具有足够大效应的遗传预测因子。尽管这个数字可能低估了遗传因素对疗效的影响,但由于以下原因,确定药物疗效的遗传因素并不容易:研究设计不足,难以明确定义治疗效益;未充分考虑安慰剂效应;药物不依从性的影响;未充分评估不同参与者之间疾病表型的变异;统计功效不足,特别是当疗效由多个贡献较小效应的变异决定时。以下是一些关于遗传变异决定药物疗效的一致性证据的例子(见表3)。奥拉帕尼布与BRCA1和BRCA2基因突变之间的关联在上市之前就已经被发现,而其他例子则是在上市后发现的,其中有两个在下文中详细讨论。
氯吡格雷是一种抗血小板药物,对于缺血性心脏病和脑血管疾病患者具有疗效。氯吡格雷是一种前药,通过CYP2C19酶代谢为其活性形式,而约1/3的患者由于CYP2C19*2或CYP2C19*3等功能丧失变异,导致酶活性降低。携带这些基因变异的患者具有高度的血小板反应性和较高的缺血事件风险。关于在冠状动脉疾病患者中使用氯吡格雷前进行CYP2C19基因检测的争议较多,但现在逐渐形成共识,尤其在接受经皮冠状动脉介入治疗的患者中。在美国9家医疗中心进行的一项真实世界评估研究中,对3,342名携带CYP2C19功能丧失变异的患者进行了观察,结果显示与氯吡格雷不同的抗血小板药物可将主要动脉血栓事件降低了44%。在中风或短暂性脑缺血发作患者中,携带CYP2C19功能丧失变异的患者再发缺血事件的风险增加。实际上,在这些患者中使用替格瑞洛代替氯吡格雷可将90天内中风风险降低23%。
阿片类镇痛药可待因是一种前药,通过CYP2D6酶代谢为吗啡。CYP2D6基因是目前研究最广泛的药物代谢基因,具有约133个等位基因变异。个体根据代谢能力的不同可以分为弱代谢者、中间代谢者、正常代谢者和超快代谢者。由于该药物的镇痛活性主要是由吗啡产生而不是可待因本身,缺乏CYP2D6酶的弱代谢者将减少镇痛效果。不同种族群体中功能丧失变异的频率有所不同,西非人群约为0%,英国人群为12%。相比之下,约2%的英国人群是超快代谢者,阿尔及利亚人群则高达39.5%。超快代谢者在同一染色体上携带两个或更多基因副本,通常需要较高剂量的药物才能达到治疗效果。然而,在前药中,超快代谢者需要较低剂量的药物才能达到治疗效果,而使用标准剂量可能会导致药物过量毒性反应。例如,可待因转化为吗啡的增加会引起呼吸抑制。一些儿童,特别是那些患有阻塞性睡眠呼吸暂停的儿童,如果是超快代谢者,则在使用可待因时可能面临呼吸抑制的风险。由于CYP2D6基因检测在大多数国家并不常规,监管机构已经对18岁以下扁桃体切除术后使用可待因(以及12岁以下治疗咳嗽)做出了禁止使用的规定。
临床实践中的实施
将药物基因组学引入临床实践的进展较为缓慢,药物基因组检测仅限于某些专科中心。原因包括对临床效用的认知不足、无法获取基因分型测试、对成本效益的不明确、缺乏解读药物基因组测试结果和采取措施时的知识不足、担心干扰正常的临床路径以及对保密性问题的担忧。值得注意的是,一种基于药物代谢动力学模型的肾功能或肝功能不全导致剂量调整的概念被监管机构和临床医生所接受,但对于由基因变异引起的药物暴露差异,这种概念似乎不存在。当然,在实施药物基因检测之前,需要有临床效用的证据支持。然而,仅通过等待随机对照试验(RCTs)来确认其效用是不够的,因为RCTs处于证据层次的顶端。尽管某些药物-基因对需要RCTs,事实上已经进行了许多不同设计的试验,但由于多种原因,为许多药物-基因对进行试验可能很困难。首先,RCTs成本高昂,而且在许多情况下,涉及的药物是通用药物且已过专利期,可能无法获得资金支持。其次,由于严格的纳入和排除标准,许多试验的普适性不足。第三,在给已知功能性变异的参与者提供剂量时可能会涉及伦理问题。第四,考虑到联合用药(通常定义为≥5种同时使用的药物)和多病症患者的多个药物-基因关联以及老年患者的情况,试验设计可能很困难。最后,由于许多基因变异在人群中的等位基因频率较低,需要大样本量的试验,这可能因为成本和招募困难而难以实现。为了促进临床实施,应综合考虑和评估各种证据。此外,应在实际临床实践中进行持续监测,以不断完善实施过程,以优化患者效果。为了促进药物基因组学在英国国家医疗服务(NHS)中的实施,英国皇家内科医师学会和英国药理学学会制定了一份报告,其中包含一些关键建议;下面是一套适用于任何医疗系统的建议(Box 1)。

一个日益形成的共识是,实施需要采用预防性基因分型策略。在实践中,这种方法可能意味着对需要进行特定基因-药物对的药物基因检测的患者进行基因分型,使用包含多个变异体的药物基因组学Panel,并将数据存储在电子健康记录中,以备将来需要使用其他可能受药物基因组变异影响的药物时使用。这种策略已在包括圣裘德儿童研究医院、范德堡大学医疗中心和梅奥诊所在内的几家美国机构中采用。为了提供预防性基因分型实施的效用的高质量证据,欧洲药物基因组学联盟在七个欧洲中心进行了一项前瞻性研究,将近7,000名患者随机分配到标准治疗组或基因型指导治疗组。该试验中使用的药物基因Panel检测了与42种药物相关的12个基因中的44个变异体。主要结果指标是不良药物反应(ADR)的发生率。这项创新研究的结果显示,基因指导治疗可将ADR减少30%,提供了首个关于药物基因组学Panel测试效用的随机化证据。为了填补药物基因组学的知识空白,一些组织制定了指南,包括临床药物基因组学实施联盟(CPIC)、加拿大药物基因组学网络(CPNDS)、荷兰药物基因组学工作组(DPWG)和法国国家药物基因组学网络(RNPGx);目前有26个CPIC指南,随着新证据的出现,这个数量可能会增加。然而,值得注意的是,CPIC指南提供了关于已经进行药物基因组学数据分析的患者需要采取的措施建议,但不提供何时应对患者进行基因检测的建议。因此,任何医疗系统的实施也应制定关于谁应该进行检测以及何时进行检测的资格指南。鉴于卫生服务所面临的限制,药物基因组学测试的成本效益证据至关重要。幸运的是,有关个体药物基因组学测试的成本效益的证据正在增加,包括Panel测试的方法。药物基因检测的成本效益通常取决于感兴趣的变异等位基因的频率;例如,在用于痛风治疗的药物别嘌醇中,HLA-B*58:01的基因分型已被证明在亚洲人群中具有成本效益,可以预防严重的皮肤不良反应(该变异等位基因在某些亚洲人群中的频率为15-18%),但在欧洲人群中没有成本效益(该变异等位基因在1-2%的欧洲人群中存在)。然而,值得注意的是,这种方法有可能导致个体国家内出现不平等情况,某些人种群可能因为等位基因的群体频率较低而被拒绝进行基因分型,而其他人种群则可能被接受。
表2 与HLA等位基因相关的免疫介导的不良反应示例
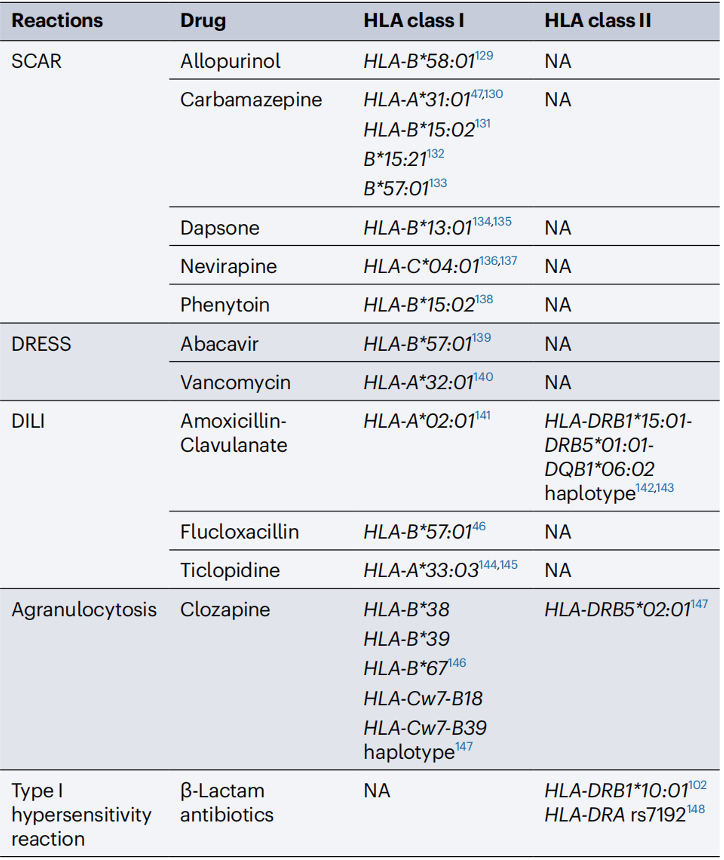
DILI,药物性肝损伤;DRESS,药物相关嗜酸性白细胞增多综合征;NA,不适用;SCAR,严重的皮肤不良反应(包括Stevens-Johnson综合征,中毒性表皮坏死松解和DRESS)。
药物研发和药物安全
新药研发是一项高风险且成本高昂的工作,总体失败率超过96%,将一种药物推向市场的估计成本约为13亿美元。使用基因组学数据已被证明能提高成功率。例如,选择基于遗传学支持的靶点使临床开发的成功率翻了一番。进一步的分析表明,在II期和III期试验中,基于遗传学支持的靶点更有可能取得成功。值得注意的是,2021年FDA批准的药物中,2/3主要用于肿瘤学领域,并具有支持的遗传证据。Open Targets是一个有用的开放获取数据库,提供了识别和优先选择基因组学支持的靶点的资源。Box 2提供了三个利用个体基因遗传差异数据开发新药的示例。

在肿瘤学中,测序技术使得在体细胞肿瘤基因组中鉴定驱动突变成为可能,从而导致开发能够针对这些突变的药物或药物组合(补充表1),并改善预后。例如,抑制BRAF的威罗菲尼和抑制ALK的克唑替尼就是两个例子(图1)。也许,目前开发的最成功的药物类别之一是酪氨酸激酶抑制剂,例如依马替尼,它针对慢性髓性白血病(CML)中的BCR-ABL1融合基因。这种药物对大多数患者的CML预后产生了改变,他们的预期寿命现在与一般人口中与年龄相配的个体相似。此外,一些持久分子反应的患者可以停用酪氨酸激酶抑制剂。在实体瘤中,靶向药物的效果可能比CML差,但起初至少可以导致戏剧性的反应,复发是由于产生新的突变。现在,在实体肿瘤中的挑战是确定针对异常途径的最佳治疗组合,以实现持久的无进展生存和总生存。
表3 | 具有因特定基因变异而导致疗效改变的药物示例
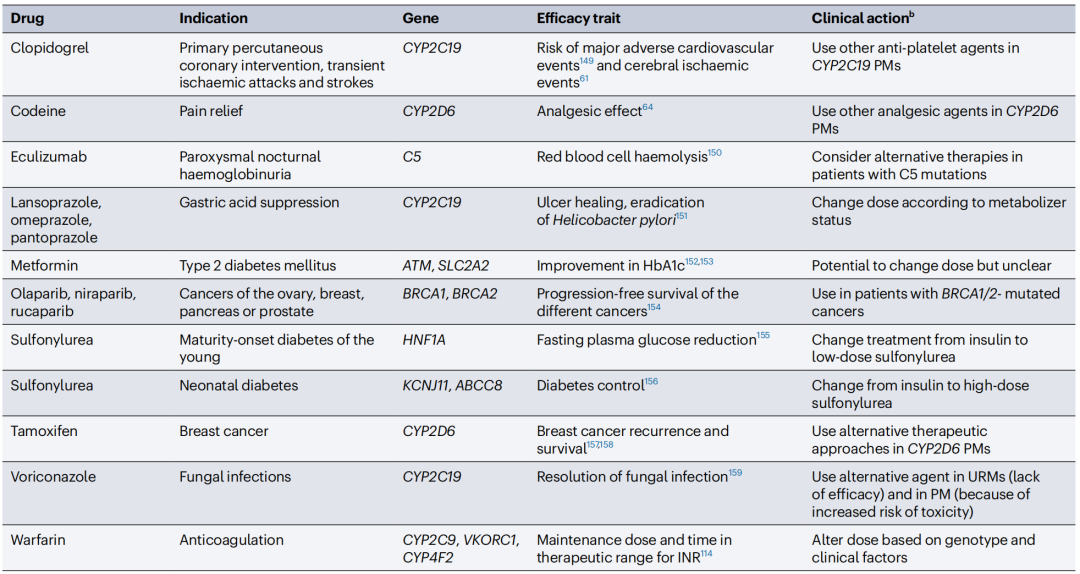
^a由于药物的药代动力学或药效学作用中涉及的基因变异而导致疗效改变。^b所建议的临床作用基于描述这些疗效特征和/或指南的原始文章。INR,国际标准化比值;PM,差异代谢者;URM,超快速代谢者。
个体遗传物质中的基因变异的证据还可以预测药物毒性,降低临床开发的风险。一个例子是抑制二酰甘油酰基转移酶1(DGAT1)作为治疗2型糖尿病和肥胖的潜在药物。在一项Ⅰ期临床试验中,AZD7687,一种可逆且选择性的DGAT1抑制剂,导致严重的腹泻,超过50%的参与者需要停用药物,这使得该药物不太可能继续进行下一阶段的开发。与此发现一致,DGAT1基因突变后来在一个亚维族犹太家族中被发现是导致严重腹泻的原因。对与DGAT1基因突变相关的表型的先前认识可能已经修改或阻止了DGAT1抑制剂的开发。
在一个药物上市多年后,基因评估也可以帮助确定因果关系。例如,有报道称他汀类药物如辛伐他汀会导致白内障,但因果关系尚不确定。一项对21项观察性研究的系统回顾和荟萃分析显示,他汀类药物与白内障的风险增加相关(OR 1.11,95% CI 1.02-1.21)。然而,在荟萃分析中所包含的不同研究之间存在较大的异质性,混杂可能解释了观察到的风险增加。英国生物银行的分析显示,HMG-CoA还原酶(HMGCR)基因低活性变异,作为HMGCR受他汀类药物抑制的代理,增加了白内障(OR 1.14,95% CI 1.00-1.29)和白内障手术(OR 1.19,95% CI 1.04-1.35)的风险,这提供了一些证据表明他汀类药物的使用可能与白内障形成有因果关联。有趣的是,PCSK9和NPC1L1的低活性变异,作为PCSK9抑制剂和NPC1L1受他汀类药物埃齐替米布抑制的替代品,没有增加白内障的风险,这为那些需要降低血脂的治疗但有白内障风险的患者提供了替代疗法的可能性。
未来展望
利用生物样本库/生物银行
随着越来越多的大型生物银行或样本库与基因组数据的关联,且可用性不断增加,为未来的药物基因组学研究提供了机会。与传统研究相比,生物库研究具有更大的样本量,这使得它们可能更具成本效益。例如,以BioVu为例,一项成本分析显示,传统研究的中位数成本超过130万美元,而生物库研究的成本约为7.7万美元,每位参与者每年的中位数成本约为传统研究的5倍。
然而,生物库研究也存在一些缺点:许多生物库建立的目的是为了盈利,因此编码准确性可能相对较差,即使生物库是为科学研究而建立的,表型也可能相对肤浅。例如,在评估对青霉素类抗生素引起的I型过敏反应(如过敏性休克)的研究中,深度表型分析发现HLA-DRB110:01(OR 2.92,95% CI 2.04-4.18)是易感位点。然而,在英国、爱沙尼亚和BioVu生物库进行的另一项研究,并使用23andMe样本进行验证,显示了HLAB55:01(OR 1.41,95% CI 1.33-1.41)与自报青霉素过敏表型的关联后,显示自报青霉素过敏的准确性在超过90%的病例中被证明是错误的。虽然这两个位点可能在易感于不同的青霉素过敏表型中具有重要作用,但不同的结果强调了表型研究的重要性,并需要在结果的背景下进行考虑。
显然,使用生物库数据具有巨大的优势,并且在这一领域的研究可能会增加。改进生物库中的表型将进一步加强生物库在药物基因组学研究中的实用性。然而,对于许多表型仍然需要传统研究,这两种方法应被视为互补而不是竞争。
罕见变异
药物反应表型的大部分遗传性尚不清楚,一项研究提供的估计值范围从0.05到0.59不等。由于大多数药物基因组学研究集中在常见变异上,可能有一部分遗漏的遗传性可能归因于罕见变异。对超过60,000个个体的外显子测序数据进行评估显示,在每个个体中携带的41个推测功能性变异中,罕见变异占了10.8%。随着人类基因组测序成本的降低和可用性的增加,药物基因组学面临的挑战将是评估罕见变异对药物反应表型的影响,并随后将这些信息纳入临床实施计划中。至少在开始阶段,集中于众所周知的药物基因组学将是重要的,但需要大样本量,可能只能通过拥有大规模、经过良好管理的生物库来实现,也需要新颖的研究设计,比如N-of-1试验等。罕见变异的另一个关键问题是它们的功能性,其中大多数被归类为具有不确定意义的变异。已经开发了用于预测功能性的基于计算机模拟的方法,包括使用人工智能进行药物基因组变异预测的方法。使用神经网络分析对长读取CYP2D6基因序列数据的分析显示,与传统方法相比,该模型能够解释79%的个体间变异性,而传统方法只能解释54%。在某些情况下,还需要进行功能基因组评估,使用高通量方法,如大规模平行报告基因测定和深度突变扫描。
多基因分数
使用多基因分数(也称为多基因风险评分)来预测疾病风险、疾病分层、预后和筛查的兴趣越来越大。多基因分数在药物基因组学中也具有潜在应用,事实上,华法林剂量算法就是多基因分数在临床效用方面的早期示例。已经报道了使用多基因分数来预防肌酸激酶抑制剂防治缺血性心脏病发作、β受体阻滞剂治疗心力衰竭和药物引起的肝损伤,但仍需要验证。对于大多数药物基因组学的多基因分数而言,一个主要问题将是需要大样本量,这可能也只能通过具有良好表型的生物库数据来实现。
使用多基因分数进行疾病风险分层可能会比仅使用临床风险因素更早地识别到受益于干预的人群。对没有心血管疾病史且未接受降脂治疗的306,654名英国生物库数据个体的分析显示,在中度风险(5-10%心血管风险)的个体中,使用多基因分数并开始使用他汀类药物治疗,可以防止每340个被筛查者中的额外心血管事件,与仅使用传统风险预测相比,可能预防7%更多的心血管事件。然而,这种方法是否具有成本效益将取决于医疗环境、多基因分数的预测准确性和基因分型的成本。将多基因分数纳入临床实践的实施比传统药物基因组标记更遥远,因为需要证明其临床效用,并且将多基因分数整合到临床路径中具有固有的复杂性。实际上,多基因分数在实施药物基因组学时将面临与上述药物基因组学实施相同的问题。
多样性
越来越多的人们认识到基因组研究具有高度欧洲中心性和缺乏民族多样性的问题,并且因此可能加剧已经存在的健康不平等现象。对现有GWAS数据的评估显示,97%的参与者为欧洲血统,亚洲血统约占2.2%,非洲血统和非洲裔美国人或非洲加勒比海地区血统约占0.02%。主要基于欧洲血统开发的多基因分数也存在问题,因为其在全球人群中的适用性较低。
药物基因组学研究中也存在着缺乏多样性的问题。例如,大多数华法林剂量算法基于CYP2C9*2和CYP2C9*3多态性,这些多态性在欧洲人群中较为普遍,但在非洲血统的人群中几乎没有。对更多在非洲人群中更为普遍的CYP2C9多态性的评估研究非常有限。在药物标签中也存在忽视民族多样性的问题。例如,多发性硬化症治疗药物西泮莫德的药物标签指示医生在开处方前对CYP2C9进行基因分型,对CYP2C9活性部分降低(CYP2C9*2*3,CYP2C9*1*3)的患者减少剂量50%,当活性降低到正常水平的10%时完全避免使用(CYP2C93*3)。然而,未提及对非洲特异性等位基因(如CYP2C9*5、CYP2C9*6和CYP2C9*11)进行测试,而这些变异也会降低CYP2C9的活性(多发性硬化症在非洲和欧洲人群中同样常见)。另一个重要的例子是DPYD基因分型以预防氟代嘧啶类抗癌药物的毒性。DPYD基因分型已于2020年底在欧洲大部分地区实施;在英国,目前每年进行约38,000次基因测试。然而,测试仅针对在欧洲血统人群中发现的四个变异体,许多非欧洲患者可能面临潜在可预防的氟代嘧啶毒性风险。
为了提高基因组数据的多样性,全球范围内已经启动了许多计划,例如H3Africa计划、卡塔尔基因组计划、亚洲基因组计划和中国卡多利生物库等。Trans-Omic for Precision Medicine(TOPMed)计划旨在为个体量身定制的治疗策略中,60%的18万测序参与者来自非欧洲血统。美国的"All of Us Research Program"计划从社区中招募100万名参与者,并注重确保招募过程中的多样性。在英国,"Our Future Health"计划旨在招募500万名个体,确保招募代表了英国的种族多样性。此外,全球生物库元分析计划是由24个拥有超过220万患者的生物库合作而成,旨在促进不同种族多样性人群中的基因发现。取得的进展是令人鼓舞的,但重要的是要注意,许多生物库缺乏连接民族特异性变异与药物基因组表型所需的细致数据。因此,需要专门设计的、有良好设计的研究,以优化全球人群的药物开发和使用。另一个关键问题是需要增加不同国家的能力,否则无法解决这些不平等问题。
结论
人类基因组计划完成以来,药物基因组学的研究已经增加,涵盖了从药物发现到临床实施的全过程。关于某些药物基因组关联的实用性的数据正在增加,但将这些实用性应用于临床实践却进展缓慢。药物基因组学的实施可能成为推动基因组学进入临床实践的主要推动因素。人类基因组数据的可用性的增加也对药物的发现和开发过程产生了重大影响,并已经显示可以提高成功率。基因组数据还将有助于在药物开发的早期阶段确定安全性,识别出通过临床前毒理学研究可能无法检测到的危险因素。药物基因组学只是个体化或精准医学发展的一部分。需要多模态算法,将临床因素(例如年龄、性别和体重)和基因因素(补充图1)、以及其他组学生物标志物结合起来。这些多模态算法的开发无疑将受益于数字工具的使用,这些工具由数字治疗领域蓬勃发展的产业开发。药物基因组学的发展面临着许多挑战,正如本文所述,但这些挑战并非不可逾越,通过协同研究努力克服这些挑战很可能会带来许多改善人类健康的机会(Box 3)。



