【Lancet Haematol】靶向时代的中国造血干细胞移植:现状、挑战和未来
时间:2022-12-05 20:05:31 热度:37.1℃ 作者:网络
造血干细胞移植
近十几年靶向治疗得到快速发展,TKI、贝林妥欧单抗、达雷妥尤单抗和CAR T 细胞等显著改善了血液恶性肿瘤患者的结局,但异基因造血干细胞移植 (HSCT) 仍是血液恶性肿瘤、重度再生障碍性贫血和遗传性疾病的治愈方法,且自体 HSCT 也是化疗敏感和免疫敏感的恶性和非恶性疾病患者的常规疗法。
据估计,1957年至2019年间,全球进行的异基因 HSCT 和自体 HSCT 手术数量超过150万例。1964年(北京大学人民医院完成首例骨髓移植)至2020年间,预计中国异基因和自体 HSCT 手术数量也超过80000例。
《Lancet Haematology》近期发表了关于中国细胞治疗的3篇系列论文,其中的一篇文章中,黄晓军、裴旭颖、常英军教授等总结了中国 HSCT 临床研究的现状、挑战和未来方向,也带来很多思考。

中国HSCT的现状
1964年,北京大学人民医院首次在亚洲采用同基因骨髓移植成功治疗1例重型再生障碍性贫血患者。1981年北京大学的研究人员完成我国首例白血病异基因骨髓移植。2000年,黄晓军教授等基于G-CSF和抗胸腺细胞球蛋白诱导的免疫耐受,完成首例非体外去T单倍型相合血液和骨髓移植治疗白血病。自2001年以来,单倍型相合异基因移植在适应症、预处理方案、供者选择以及移植前后的(复发和其他移植相关并发症)分层干预得以改善,2016年全球血液和骨髓移植网络 (WBMT) 开发了北京方案。我国其他新型移植技术也有多项进展,如在人类白细胞抗原(HLA)相合的同胞异基因移植中使用抗胸腺细胞球蛋白,以降低移植物抗宿主病 (GVHD) 的发生率,同时不增加白血病复发和间充质干细胞(用于难治性慢性 GVHD)。北京方案和其他移植技术在中国的广泛应用促进了异基因HSCT 的快速发展,2020年异基因移植达10042例,而2008年仅有1062例(图1A)。
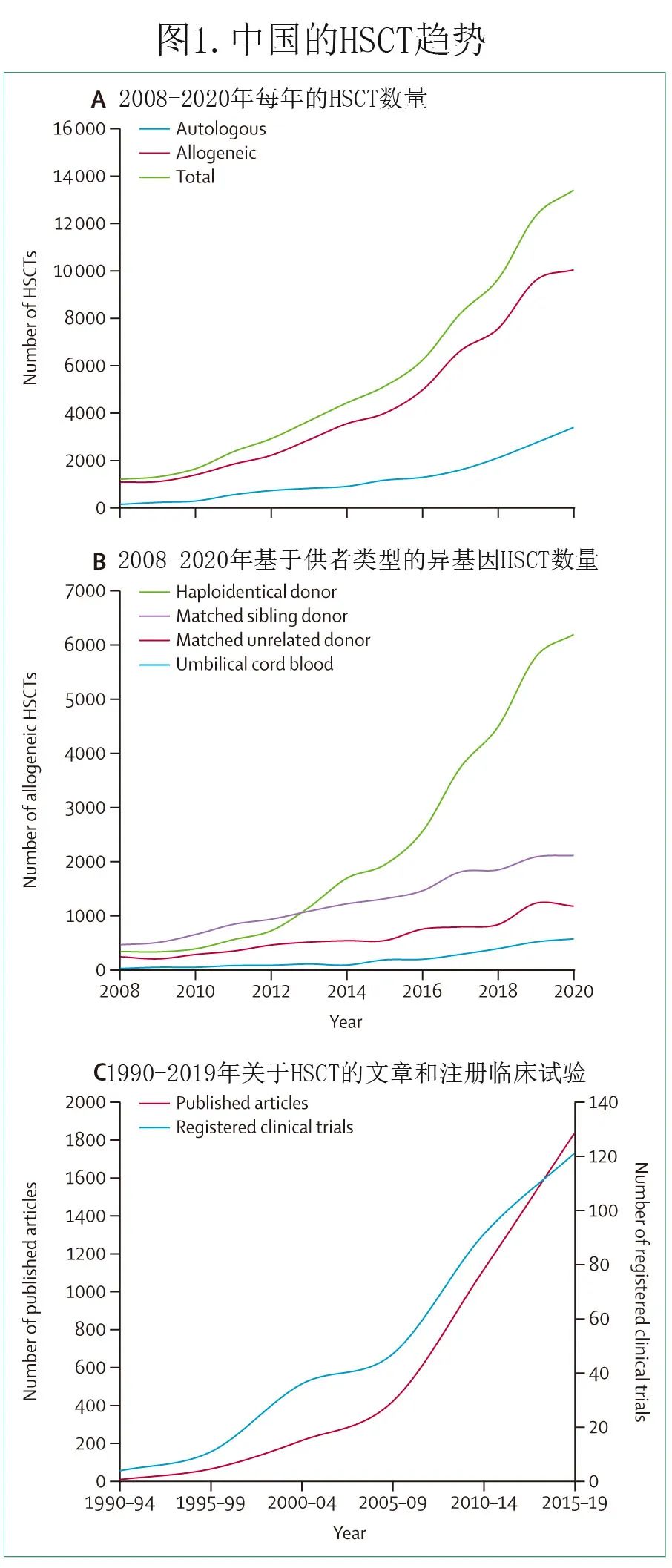
2008年至2020年间, 169家移植中心向中国血液和骨髓移植登记组 (CBMTRG) 报告了72329例HSCT,其中56661例 (78.3%) 异基因HSCT,包括单倍型相合供者HSCT(29860例 [52.7%])、HLA相合同胞供者移植(16 318例 [28.8%])或无关供者移植(7876例 [13.9%])以及脐带血移植(2607例 [4.6%];图1B),还有15659例 (21.6%) 自体HSCT。此外1990年至2019年间,关于 HSCT 的发表文章和注册临床试验数量也迅速增加(图1C)。
HSCT 最常见的适应症为急性髓系白血病(AML)(21554例 [29.8%])和急性淋巴细胞白血病(ALL)(15912例 [22.0%]),非恶性疾病中比例最高的是重型再生障碍性贫血(7161例 [9.9%];图2A)。在接受 HSCT 的患者中,年龄>60岁的比例2.9%(图2B),超过一半的受者为男性(图2C)。
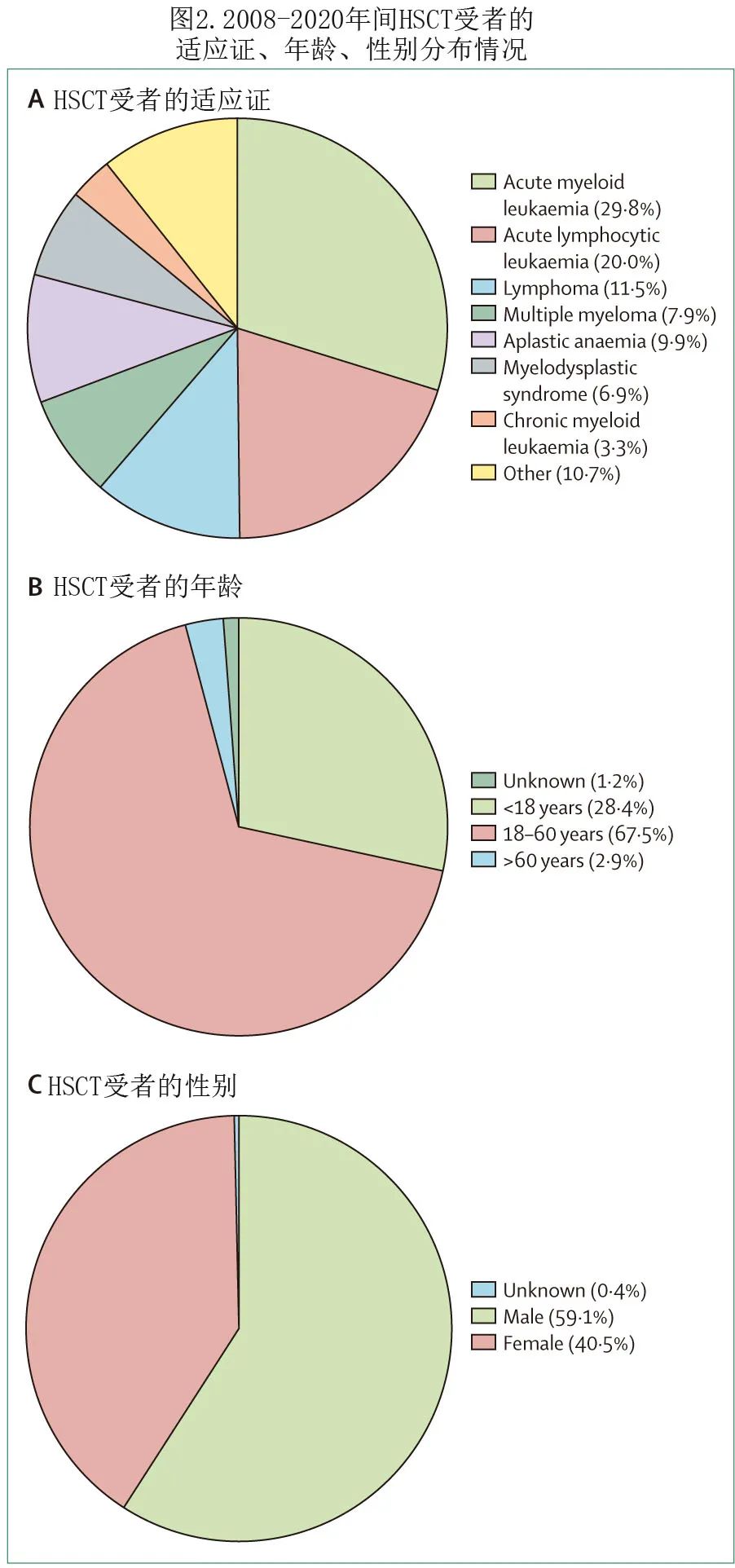
中国和台湾不同地区 HSCT 中心数量(图3A)和 HSCT 受者数量(图3B)显示,2020年有超过半数的 HSCT 中心位于北京、华东和华南,超过半数 HSCT 手术是在这些中心进行。总的来说,CBMTRG的年度报告反映了 HSCT 的现状,其中异基因移植呈现出如下趋势:(1)2008年至2020年间,异基因移植数量不断增加,增长率超过800%;(2) 自2013年以来,单倍型相合捐献已成为中国异基因 HSCT 最常见的干细胞来源,其比例高于欧洲和美国;(3) 非恶性血液病(如重度再生障碍性贫血)的比例增加;与美国和欧洲不同,在中国单倍体 HSCT 已成为重度再生障碍性贫血的一线治疗。
在中国,干细胞来源已从骨髓、脐带血或G-CSF动员的外周血干细胞转变为 G-CSF 刺激的骨髓干细胞和 G-CSF 动员的外周血干细胞混合物。自2020年以来,由于新冠肺炎大流行,更多的移植受者接受 G-CSF 动员的外周血干细胞移植,而非血液恶性肿瘤患者接受 G-CSF 刺激的骨髓干细胞和 G-CSF 动员的外周血干细胞混合。中国大多数移植候选者接受清髓性预处理方案,年龄>65岁的移植候选者和造血细胞移植特异性合并症指数高 (≥3) 的患者则接受降低强度的预处理方案。
截至2021年11月,中国骨髓捐献者计划登记的健康捐献者已超过三百万人,但仅有102106人申请匹配无关捐献者。原因之一在于中国的单倍型相合异基因移植发展迅速,导致亲缘供者移植多于相合无关供者移植(图1B),其他原因还包括不同移植类型治疗白血病和重度再生障碍性贫血的结局相当,以及相合无关供者移植复发时无法进行二次异基因移植和移植失败治疗。中国无关脐带血移植使用率低的原因包括:由于单倍型相合异基因移植非常成功,如果没有相合同胞供者和相合无关供者,大多数医生会选择单倍型相合异基因移植而非脐带血;非血缘脐带血移植只能成功用于儿童和低体重 (≤35 kg)成人,因为单单位脐带血的细胞剂量无法保证较高体重患者的造血植入成功(但脐血移植也有一定的优势,例如GVHD发生率较低);脐带血移植后无法进行二次异基因治疗疾病复发和移植失败治疗(但有可能进行单倍型相合供者移植)。未来体外扩增技术或可克服无关脐带血移植的局限性,提高其发展速度。
20世纪80年代以来,我国自体移植数量同样稳步上升。2008年至2020年间自体 HSCT患者人数为15659例,占中国 HSCT 患者总数 (n= 72329) 的21.6%,且从2008年的121例/年增加至2020年的3371例/年。中国自体 HSCT 最常见的适应症包括多发性骨髓瘤(MM)和非霍奇金淋巴瘤,这与欧洲和美国相似。但中国可用的移植病房数量仍不足,且几乎都在血液科;移植率尚无法满足血液学恶性和非恶性疾病患者的需求,因此限制了自体 HSCT 用于自身免疫性疾病,减缓了该领域的治疗发展,即使自体 HSCT 治疗自身免疫性疾病的适应证包括1型糖尿病、天疱疮、难治性狼疮性肾炎和系统性硬化症等。
2019年美国自体 HSCT 数量超过14000例,欧洲超过28000例,均显著高于中国的2723例。欧美自体 HSCT 的数量显著高于半相合HSCT,而中国半相合 HSCT 的数量显著高于自体HSCT(图1A)。地理差异的可能原因在于:首先,中国多数血液科医生认为,与自体 HSCT 相比,异基因 HSCT 具有抗白血病作用,从而导致移植后复发率较低,因此在中国急性白血病较少进行自体HSCT;其次,新型药物(如利妥昔单抗、维布妥昔单抗和贝林妥欧单抗)大幅改善了淋巴瘤患者的临床结局,从而阻碍了自体 HSCT 在中国的发展,因为大多数血液学家认为靶向治疗时代不需要移植;第三,对于MM患者,预处理方案中美法仑的缺乏制约了自体 HSCT 在我国MM的应用;此外,现有的移植病房无法满足自体 HSCT 候选者的需求。但随着经济的进一步发展、美法仑在中国可及(2018年以来),以及越来越多的移植病房和血液学家认识到自体 HSCT 在治疗MM、非霍奇金淋巴瘤和其他疾病中的重要性,自体移植的数量也会增加。
中国异基因HSCT的亮点
异基因HSCT用于白血病
谁是急性白血病患者的最佳供者?
根据中华医学会血液学分会 (CSH) 关于异基因 HSCT 供者选择的共识,中、高危AML和高危ALL患者应首选相合同胞供者。如果没有相合同胞者,则可以选择半相合供者,因为接受北京方案的AML或ALL患者结局与相合同胞供者移植的患者相似,且这一结果在美国和欧洲也得到证实。由于已发表文献中的争议,中国的数据不足以在选择供者时考虑是否存在克隆性造血,还需要进一步的前瞻性、多中心研究来回答供者克隆造血是否应纳入供者选择策略的问题。但单倍型相合供者移植和相合同胞供者移植治疗AML或ALL的结果相当,那么最佳供者是单倍型相合供者还是相合同胞?2017年和2020年有研究表明,对于 HSCT 前MRD阳性的急性白血病患者和高危AML患者,单倍型相合供者移植较相合同胞供者移植可获得明显更低的累积复发率和更好的无白血病生存率和总生存率。这些数据表明,对于 HSCT 前 MRD 阳性的急性白血病患者,单倍型相合供者的移植物抗白血病作用强于相合同胞供者,这主要是由于细胞凋亡减少和细胞毒性细胞因子分泌增加,包括肿瘤坏死因子、干扰素-γ (IFN-γ)、CD107a或穿孔素(T细胞或NK细胞分泌)。
在自体 HSCT 后复发的霍奇金淋巴瘤患者和ALL患者中,也观察到单倍型相合供者 HSCT 联合移植后环磷酰胺(Baltimore方案)具有更强的移植物抗白血病作用或生存优势,但需要前瞻性多中心研究来证实。因此,无论是北京方案还是Baltimore方案,单倍型相合供者的抗白血病活性均优于相合同胞供者,这一结果在急性白血病和非霍奇金淋巴瘤中均可观察到。因此CSH建议,对于 HSCT 前 MRD 阳性急性白血病患者,非相合同胞供者的家族单倍型相合供者可能是最佳选择。
将靶向治疗与HSCT相结合,以改善白血病治疗的结果
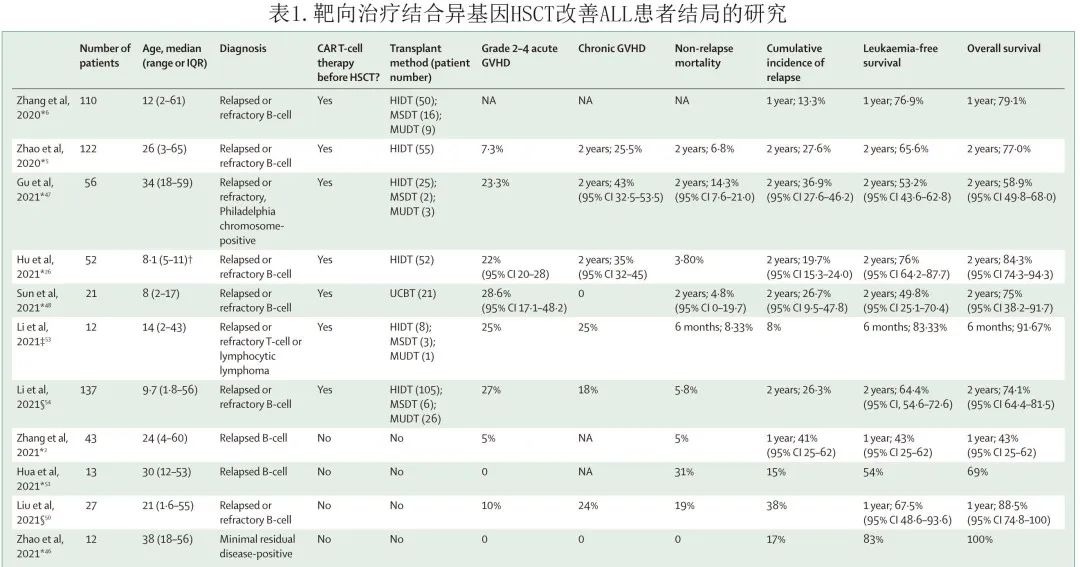
尽管 CAR-T 细胞疗法在复发或难治性(R/R) B-ALL、RRMM和R/R淋巴瘤患者中可达到较高的完全缓解率,但复发仍是亟待解决的问题。中国目前的趋势是将 CAR-T 细胞治疗作为这些R/R患者异基因或自体 HSCT 的桥接,因此CAR-T细胞疗法确实为移植提供了更多的机会,但并不排除移植的作用。在2021年的研究中,胡冠华教授等评估了 CAR-T 细胞疗法桥接至单倍体相合 HSCT 治疗费城染色体阴性R/R B-ALL的疗效和安全性 (n= 42),中位随访24.6个月的2年无事件生存率为76.0%,总生存率为84.3%,累积复发率为19.7%,因此将 CAR-T 治疗桥接至半相合 HSCT 可能是改善R/R B-ALL患者生存期的一种有效和安全的方法。中国13项研究也证实R/R B-ALL或 MRD 阳性患者 HSCT 前/后 CAR-T 治疗的疗效和可行性(表1)。总体而言,对于R/R B-ALL患者,CSH建议应用新型免疫治疗,尤其是 CAR-T 细胞治疗,然后桥接至异基因HSCT。
2020年,来自中国和欧洲两项独立随机试验的数据显示,异基因移植(包括半相合HSCT)后给予索拉非尼维持治疗,可预防 MRD 阳性和 MRD 阴性的 FLT3-ITD AML患者复发,有总生存期获益。Mathew 等发现,在异基因移植条件下,暴露于索拉非尼的 FLT3-ITD 阳性白血病细胞产生的高浓度白细胞介素-15可导致CD8+CD107a+IFN-γ+ T细胞增加、Bcl-2浓度升高、PD-1浓度降低,这些细胞亚群可以根除二次受者的白血病。因此HSCT后靶向治疗维持应是AML的新治疗手段;但还需要更多的研究来探索异基因 HSCT 后索拉非尼维持的最佳启动时间和持续时间,并阐明索拉非尼在异基因移植中活性的潜在机制。
除 TKI 和索拉非尼外,文献数据显示其他靶向治疗,如R/R ALL中靶向CD7、CD19或 CD22 的CAR-T 细胞治疗,以及R/R AML中靶向CD38、CLL1和 IL-10 受体的CAR-T 细胞治疗,联合异基因 HSCT 均可改善R/R急性白血病患者的结局,但需要多中心、前瞻性研究来证实。
复发性或难治性白血病的整体治疗
对于首次复发的AML患者,只有约10%的患者在治疗后有长期生存,包括其中接受异基因HSCT的18%患者,而半相合 HSCT治愈复发的几率更高。但无论如何,白血病复发仍然是接受异基因 HSCT 后复发患者的主要死亡原因。为了进一步减少 HSCT 后复发,黄晓军教授等建立了改良的供者淋巴细胞输注方案,包括引入 G-CSF 动员的外周血干细胞代替稳定的淋巴细胞输注,并应用短期免疫抑制剂(包括环孢素或甲氨蝶呤)来降低 GVHD 的发生率。改良供者淋巴细胞输注预防和相合同胞供者或半相合 HSCT后 MRD 导向干预复发的可行性和疗效已得到多项研究证实。
对于R/R白血病患者的治疗,黄晓军教授等设计了一种整体治疗(total therapy)策略。患者首先接受强化清髓性预处理方案,然后给予预防性改良供者淋巴细胞输注,后进行 MRD 检测和 HSCT 后 GVHD 引导的抢先改良供者淋巴细胞输注。在2020年的一项研究中,251例难治性急性白血病患者接受了序贯强化预处理,随后接受了预防性供者淋巴细胞输注和 MRD 或 GVHD 引导的改良供者淋巴细胞输注。HSCT 后中位随访20.3个月,单倍体相合供者的无病生存率为43%,相合同胞供者的无病生存率为39%。总体而言,现有数据表明,对于R/R白血病患者,整体治疗策略是一种有效、安全和有前景的方法。
异基因HSCT用于非恶性血液病
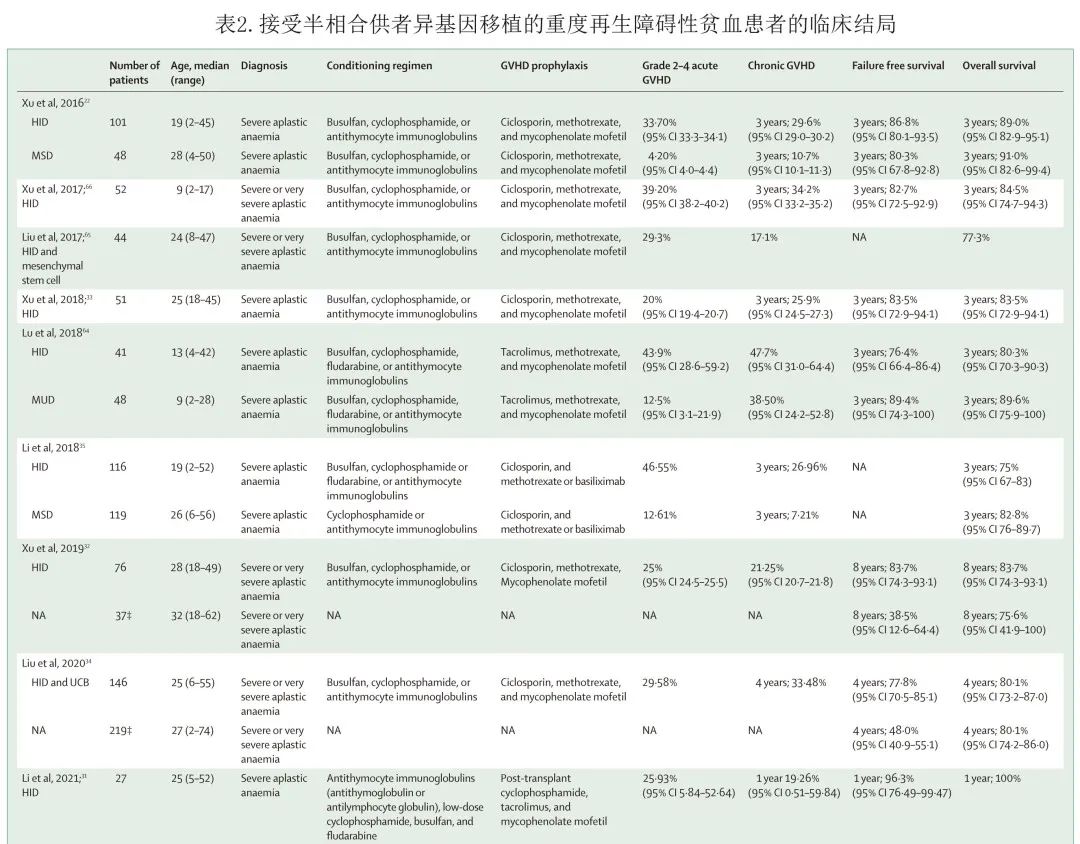
异基因 HSCT 还为非恶性血液病提供了一种治愈性策略,如重度再生障碍性贫血和遗传性疾病。许兰平教授等开展的一项多中心前瞻性研究纳入了101例严重再生障碍性贫血患者,这些患者既往免疫抑制治疗无反应,因此接受单倍体相合HSCT。中位随访18.3个月,接受单倍体相合 HSCT 治疗的患者的3年总生存率 (89.0% vs 91.0%,p= 0.555) 和无失败生存率 (86.8% vs 80.3%,P= 0.659) 与同期48例相合同胞供者移植患者相似。这些数据表明,半相合 HSCT 作为重度再生障碍性贫血的挽救治疗可行且结局较佳。另一项多中心登记数据库研究入组了来自中国12个中心的158例接受单倍体相合 (n= 89) 或相合同胞供者HSCT(n = 69) 的重度再生障碍性贫血患者,结果单倍型相合供者和相合同胞供者队列的3年总生存率(86.1%;相合同胞 HSCT 为91.3%,p = 0.358)和无失败生存率 (85.0% vs 89.8%,p= 0.413) 相似。表明半相合 HSCT 是治疗重度再生障碍性贫血的一种有效和安全的疗法,可用作一线治疗,尤其是在有经验的中心治疗结局较佳。中国、美国和欧洲的数据均支持半相合 HSCT 对重度再生障碍性贫血患者有效且安全(表2)。
在中国,重型地中海贫血是一种适用于异基因 HSCT 的遗传性疾病。来自广西医科大学的研究人员表明,相合同胞供者移植 (n= 184) 对重型地中海贫血具有良好疗效,3年总生存率为97.8%,无地中海贫血生存率为97.3%,无 GVHD 无复发生存率为89.5%。除相合同胞供者外,单倍体相合供者也成功用于重型地中海贫血患者。2018年珠江医院的学者发现,8例接受单倍体相合 HSCT 的重型地中海贫血儿童具有稳定的植入、不依赖输血的日常生活和长期无病生存期,该报道有力地表明,除相合同胞供者移植外,单倍体相合 HSCT 也是治疗重型地中海贫血的一种可行和安全的方法。2021年,深圳儿童医院学者发现,中位随访811天,73例接受单倍体相合脐带移植的重型地中海贫血儿童患者的总生存率和无输血生存率相同,均为95.26%。来自中国、美国和欧洲的已发表文献均支持将单倍体相合 HSCT 作为替代干细胞来源,但还需要多中心、前瞻性研究来确立单倍体相合 HSCT 作为治疗重型地中海贫血的一线疗法。
2019年中国有1253例重度再生障碍性贫血患者接受了异基因HSCT,512例重型地中海贫血患者也接受了异基因体HSCT,高于欧洲(749例重度再生障碍性贫血,342例重型地中海贫血);同年中国有超过50%的重度再生障碍性贫血患者接受了来自单倍型相合供者的异基因,大大超过了欧洲 (12%)。因此,在我国单倍体相合 HSCT 治疗重型再生障碍性贫血进展迅速的基础上,来自 CSH 的一个专家小组建议,对于年龄<50岁的新诊断重度再生障碍性贫血患者,家族单倍体相合供者和亲缘相合同胞供者均可作为一线治疗。
中国HSCT的挑战
自20世纪70年代以来,中国在异基因和自体 HSCT 中均取得很大进展,但也仍存在一些挑战,例如如何在靶向治疗时代重新定义 HSCT 的路线图、如何提高 HSCT 的疗效和患者生活质量、如何规范移植技术等。
如何在靶向治疗时代重新定义HSCT的路线图?
靶向治疗(包括通路抑制剂、单克隆抗体和细胞治疗)的应用大幅改善了临床结局,但在目标药物可及性低于欧美的中国,它们能否取代HSCT?如何以最佳方式将现有技术和新药与 HSCT 有机整合,以及如何重新定义 HSCT 的路线图,这些问题还必须解决。
是否进行HSCT
如果新诊断B-ALL成人患者达到完全缓解伴 MRD 阴性,中国建议行异基因HSCT,但欧美并非如此。因此在中国拥有贝林妥欧单抗和伊珠单抗奥唑米星等的靶向治疗时代,对于首次完全缓解且 MRD 阴性的 B-ALL患者,是否应继续进行异基因HSCT?对于 MRD 阴性、CAR-T治疗后完全缓解的R/R B-ALL患者,中国的数据表明异基因 HSCT 的患者的结局优于未移植患者,但来自欧洲和美国的学者并没有观察到相同人群中异基因HSCT 对R/R B-ALL患者的获益。因此还需要进行前瞻性、多中心、随机试验,来确定异基因 HSCT 在MRD 阴性的ALL患者中的优缺点。
何时进行HSCT
异基因 HSCT 前首次或后续完全缓解患者的 MRD 状态对移植结局具有重要意义。但对于 HSCT 前 MRD 阳性患者,关于最佳移植时间仍存在争议,他们是应该接受靶向治疗(尤其是 CAR T 细胞治疗和双特异性 T 细胞衔接抗体)以便在 HSCT 前获得阴性 MRD 状态,还是先接受HSCT?此外超过70%的MM患者在达雷妥尤单抗诱导治疗后可达到 MRD 阴性 (≤10–5),对于 MRD 阴性或 MRD 复发的MM患者,是否应早期进行自体 HSCT 也存在争议。
如何改善生活质量和重返社会状态?
随着我国移植结局的大幅改善,以下问题也亟待解决。首先,心理困扰、健康相关生活质量和功能缺陷会继续降低长期生存率;其次,良好的重返社会状态是 HSCT 后的一个主要问题。为了应对这些挑战,应采取若干战略。移植技术需要标准化,如最佳供体选择、不同诊断和不同疾病状态患者的个体预处理方案、GVHD预防和治疗以及 MRD 引导的复发干预。标准化将实现这些技术在中国的推广,以降低移植相关发病率和死亡率,并改善功能缺陷和健康相关生活质量。临床医生应考虑进行心理咨询和促进功能恢复,尤其是对于儿科患者,为 HSCT 受者提供良好的重返社会状态。此外还需要对移植医生进行持续教育,以获得新的临床技术和技能。
CBMTRG如何促进国家和国际合作?
国际血液和骨髓移植研究中心 (CIBMTR) 和欧洲血液和骨髓移植学会 (EBMT) 成立于20世纪80年代,他们每年对 HSCT 进行一次调查,其中包括全球信息和结局登记研究。而在 CBMTRG 的一项全国性考察中,中国研究人员仅完成了2008年至2019年间自体和异基因 HSCT 的全面信息,由于缺乏个体移植受者的结局登记而无法分析移植结局、结局风险因素和其他问题。此外CBMTRG考察的缺陷也阻碍了CIBMTG、EBMT和 CBMTRG 患者之间结局的比较,例如三个数据库中没有数据可比较北京方案和Baltimore方案治疗血液恶性肿瘤或非恶性肿瘤患者的优缺点;因此个体结局数据的登记研究以及美国、欧洲和中国之间这些数据的比较是下一步的重要工作。此外,CBMTRG需要改善患者报告结果、结果风险因素和生活质量评估的整合,并将细胞治疗的结局(如供者淋巴细胞输注和间充质基质细胞)纳入登记数据中。此外CBMTRG 还必须在领导和开展研究以及向研究人员提供教育、指南、培训和统计专业知识方面加以改进,最终促进国家和国际合作
未来方向
我国自1964年开展HSCT,此后血液系统恶性肿瘤和非恶性血液病的单倍体相合 HSCT 均迅速增加,未来20-30年HSCT在治疗多种血液恶性肿瘤和遗传疾病中的作用将继续存在。首先,将 HSCT 与其他靶向治疗相结合的生物标志物导向(例如MRD)精准医疗会进一步改善白血病和移植适应症患者的结局。其次,现有移植技术的标准化和新技术的建立将进一步提高我国不同中心的移植率。第三,CBMTRG在未来3-5年内对个体患者进行的结局登记将允许比较CBMTRG、CIBMTR和 EBMT 之间的移植结局,为制定全球 HSCT 建议或指南提供机会。此外,进一步降低慢性 GVHD 和其他长期并发症的发生率可能会进一步改善接受北京方案治疗的患者的健康相关生活质量。综上所述,我国 HSCT 的发展将最终促进世界其他地区 HSCT 的发展。
参考文献
Ying-Jun Chang, Xu-Ying Pei, Xiao-Jun Huang. Haematopoietic stem-cell transplantation in China in the era of targeted therapies:current advances, challenges, and future directions.Lancet Haematol . 2022 Dec;9(12):e919-e929. doi: 10.1016/S2352-3026(22)00293-9.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


