《Blood》R2方案治疗老年、虚弱、初治DLBCL的2期研究
时间:2023-07-20 21:16:54 热度:37.1℃ 作者:网络
R2治疗虚弱DLBCL
弥漫性大B细胞淋巴瘤(DLBCL)患者中约1/3的年龄超过75岁,因为年龄相关合并症和副作用耐受性差,老年患者的预后仍较差,存在未满足的治疗需求。
老年评估 (geriatric assessment,GA) 已纳入老年肿瘤患者的初始评估中,可评估身体和认知功能、合并症、社会经济、营养和心理状态、老年综合征的存在和重复治疗的给药。GA 的目的是提供老年患者健身状态的准确表征,从而根据其特征量身定制治疗强度,其中虚弱(frail)患者的生存较差,也不太可能接受治愈性治疗。
FIL_ReRi研究是一项2期研究,在 GA 评估为虚弱的老年初治DLBCL患者中研究了来那度胺-利妥昔单抗联合治疗 (R2) 的疗效和安全性。研究结果近日发表于《Blood》。

要点
1、利妥昔单抗和来那度胺联合治疗是可行的,在老年虚弱 DLBCL 患者的一线治疗中具有适度活性。
2、FIL_ReRi研究代表了未来 DLBCL 虚弱患者研究的基准。
研究方法&结果
FIL_ReRi是一项前瞻性、多中心、两阶段、单臂、II期研究。主要纳入标准包括:既往未接受过治疗、年龄70岁以上、经组织学证实的DLBCL、GA评估为虚弱、ECOG PS≤3、CT扫描显示至少有一个二维可测量病灶且较大直径≥1.5 cm。
患者按以下方案接受4-6个28天/周期的R2方案:第1周期,第1、8、15天静脉注射利妥昔单抗375 mg/m²,第1、8、15、22天口服地塞米松 5mg 以减轻肿瘤负荷,第2-22天口服来那度胺15mg,1次/d。第2-4周期,给予利妥昔单抗375 mg/m²静脉给药(第1天)和来那度胺 20 mg 口服给药(第2-22天),每日一次。可根据血液学毒性调整来那度胺剂量,而不调整利妥昔单抗剂量,必要时延迟治疗。4个周期后达到部分缓解(PR) 或完全缓解(CR) 的患者再接受2个周期。第4周期或6周期后≤PR的患者停止研究治疗,并由医生酌情管理。6个周期后≥PR的患者在28天/周期的第1-21天接受口服来那度胺 10 mg/天维持治疗,直至最多12个周期(包括诱导)、疾病进展或出现不可接受的毒性,以先发生者为准。
主要终点为第6周期后的总缓解率 (ORR,要求最终分析时最少34例缓解);共同主要终点为3-4级血液学外毒性的发生率。次要终点包括CR率、PFS、OS、DoR、脱落率和因毒性/耐受性导致的停药率。
研究结果
患者和治疗
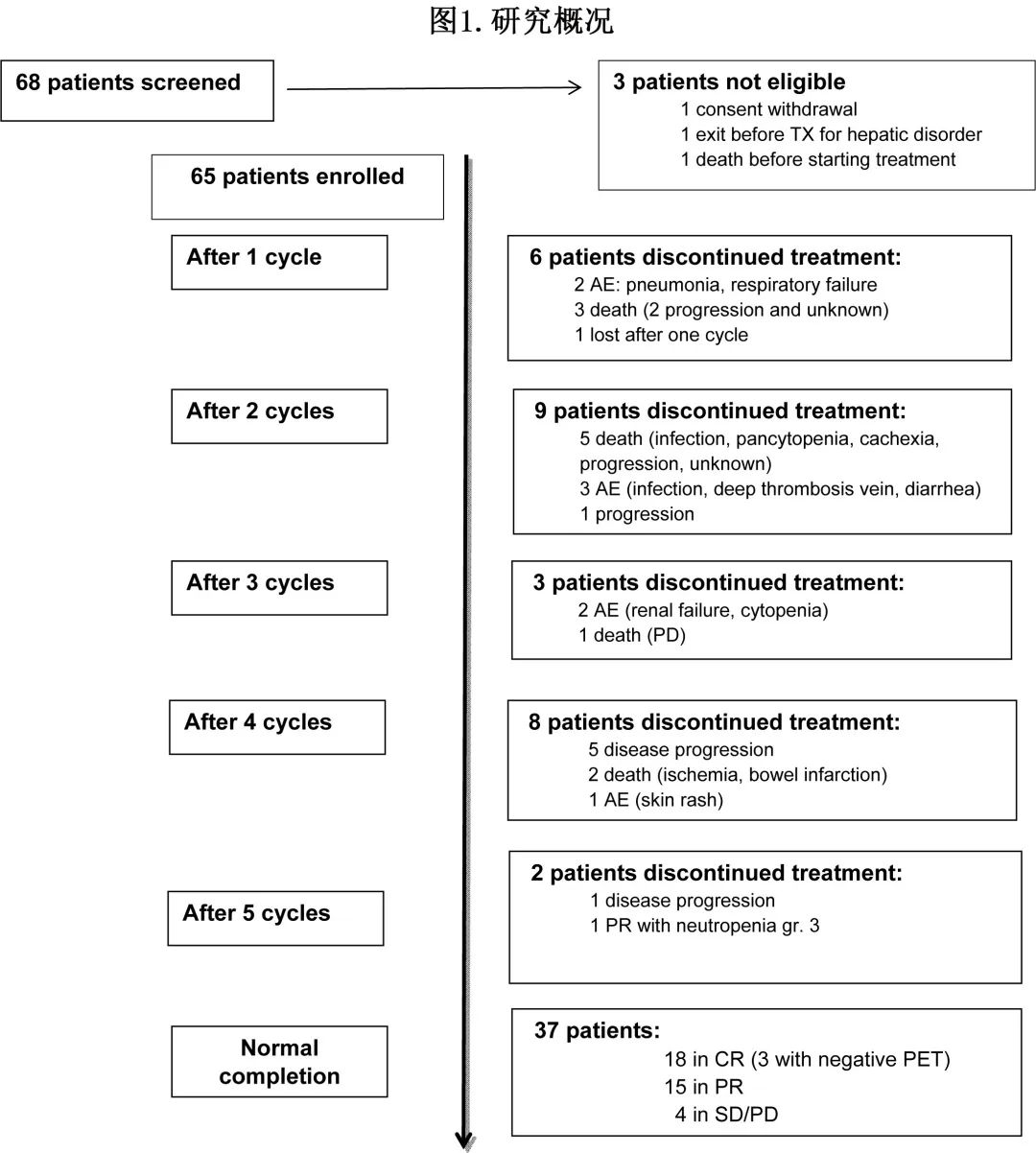
入组了68例患者(图1),排除3例患者后65例患者证实合格并开始治疗。患者特征见表1。
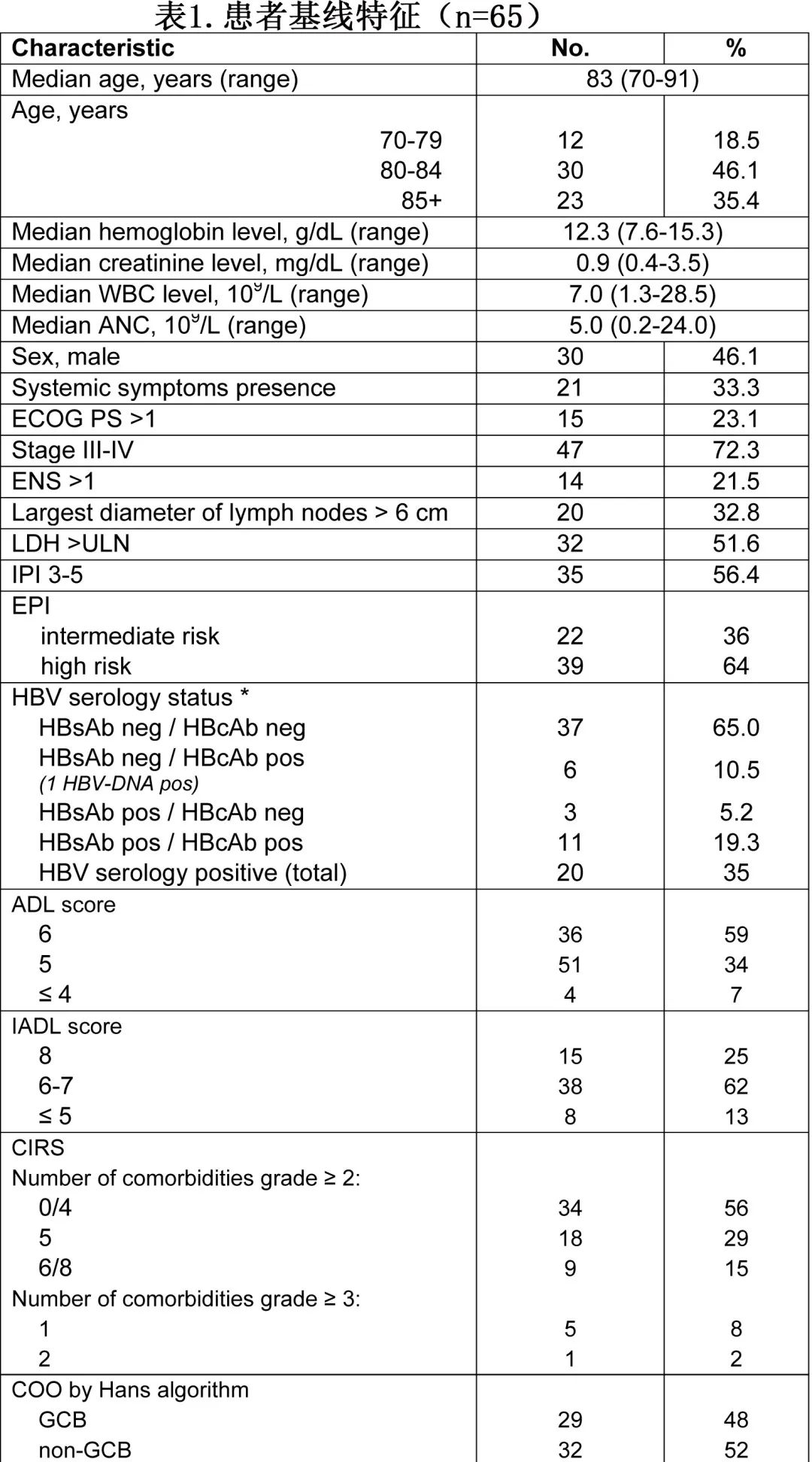
给予的诱导治疗周期中位数为6,维持治疗也是6。22例患者 (33.8%) 接受了一年的全部治疗。第1、8和15天利妥昔单抗的平均剂量强度分别为0.988、0.998和0.999。第1周期、2-6周期和维持治疗期间来那度胺的中位剂量强度分别为0.943、0.750和1.00;具体而言,在第一个周期中,21%和74%的患者接受了50-75%和>75%的计划来那度胺剂量;在2-6周期中,34%和52%的患者接受了50-75%和>75%的来那度胺剂量;在维持治疗期,93%的患者接受了>75%的来那度胺剂量。开始诱导治疗的27/65例患者 (41.5%) 和接受维持治疗的19/31例患者 (61.2%) 在诱导期间发生治疗延迟。中位延迟为额外7天(相对于计划的治疗方案)。
期中分析
研究第1阶段所需的前23例患者的招募于2017年12月完成,并进行了计划的期中分析。12例患者在CT扫描中达到缓解,ORR大于无效下限(11例);记录了13例血液学外CTCAE≥3级AE,低于15例相关毒性事件无效的上限。该研究随后于2018年7月重新开放入组,直至登记够计划的68例患者。
疗效
37例患者 (56.9%) 完成诱导治疗。诱导期结束 (EOI) 时33例患者达到缓解:18例 (27.7%) 患者CR,15例患者PR(1例患者在5个周期后达到),ORR为50.8%。根据 Koyama-Chen 法的 ORR 点估计值为58.4%(90%CI,43.7-67.1%,p=0.075,零假设=45%)。诱导治疗期间报告的脱落率为43.1%(28例患者),原因包括:因淋巴瘤进展(7例)、非血液学毒性(5例)、血液学毒性(2例)、第1周期后患者失访(1例)或死亡(共13例,感染1例,进展2例,感染/进展1例,全血细胞减少症/心力衰竭1例,恶病质/疾病进展2例、动脉缺血3例、肾癌1例、脱水1例、未知原因1例)。仅因毒性导致的治疗中止率为21.5%,相当于所有脱落的一半。
诱导治疗后,31例患者接受来那度胺维持治疗,最长治疗持续时间为12个周期;EOI时 PR/CR 的2例患者未接受维持治疗,1例是由医生决定,另1例是PR,原因是周期5后研究中断。维持治疗后,11例患者 (35.5%) 报告CR,6例患者 (19.3%) 报告PR;维持治疗后2例患者从 CR 转为PR,而所有其他患者均维持 EOI 的缓解
中位随访24个月,记录了36例 PFS 事件(23例 PD 和13例全因死亡),2年 PFS 为40.5%,中位 PFS 持续时间为14.0个月(图2)。中位DoR未达到,2年 DoR 为64.6%(图3)。记录了32例死亡, 2年 OS 为48.2%,中位OS为23.2个月(图4)。主要死亡原因为淋巴瘤进展,共14例患者(所有死亡中43.8%)。

在 ReRi 研究启动时,尚未出现Elderly Project Index(EPI),但61例患者具有计算指数所需的参数,结果中危和高危 EPI 组患者的 OS 和 PFS 无差异。61例患者可用于 COO 分析:non-GCB 和GCB分别有52%和48%,ORR 分别为16/32(50%) 和14/29(48%)(p=0.900), CR 分别为11例 (34%) 和6例 (21%)(p=0.266)。此外PFS 和 OS 均不受 COO 影响(对数秩检验,分别为p=0.660和p=0.632)。
安全性
整个人群中分别有46%和10%的患者报告≥3级中性粒细胞减少症和≥3级感染。在诱导期间,30例患者 (46%) 报告了至少1剂预防性G-CSF。表2为记录的毒性事件:总体而言,分析的65例患者中有34例 (52.3%) 发生至少1起≥3级非血液学毒性事件,大多数涉及呼吸、全身和皮肤/皮下组织疾病(各7起事件)、心脏和血管疾病(各6起事件)和感染 (5)。总体而言,在36例合格患者中记录了37起SAE 和13起SUSAR。

总结
本研究在根据GA定义为虚弱的老年初治DLBCL患者人群中评估了R2联合治疗的活性和安全性。证实R2是可行的,尽管未达到主要目标(34例缓解),但R2的活性仍有价值,ORR和 CRR 分别为50.7%(n=33)和23.1%。此外,估计中位 PFS 为14个月,中位 OS 为22个月,在至少达到 PR 的患者中有利的2年 DoR 为63.8%。34例患者发生≥3级非血液学毒性。
该研究结果令人鼓舞,因为82%的入组患者为80岁以上,均因虚弱而无法接受常规积极治疗。FIL_ReRi研究是在不适合常规细胞毒治疗的 DLBCL 患者中评估无化疗一线治疗的活性和安全性的首批研究之一,在相当大比例的病例中观察到R2联合治疗的活性。虽然还需要在这类患者中进一步探索无化疗方案,但作者认为,本研究结果可能构成未来研究的新基准。
参考文献
Gini G,et al. Lenalidomide plus rituximab for the initial treatment of elderly frail patients with DLBCL: the FIL_ReRi Phase 2 Study.Blood . 2023 Jul 7;blood.2022019173. doi: 10.1182/blood.2022019173.


