【专家述评】| 乳腺癌前哨淋巴结活检术的发展历史及研究进展
时间:2023-07-23 15:24:06 热度:37.1℃ 作者:网络
[摘要] 乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)是一项兼具诊断及治疗目的的外科技术,是近年来乳腺外科领域具有里程碑意义的重大进展之一。作为一种腋窝微创外科术式,在乳腺癌综合治疗效果不断提高的背景下,SLNB在近40年的发展呈现出降阶梯趋势,也从侧面反映出乳腺癌作为一种全身性疾病的生物学本质。首先,米兰SLNB185、NSABP-B32等一系列前瞻性随机对照临床试验证实,SLNB可以作为临床腋窝淋巴结阴性早期乳腺癌准确的腋窝分期手段。ACOSOG Z0011、IBCSG 23-01等临床试验结果则进一步丰富了腋窝外科手术降阶梯的概念,前哨淋巴结(sentinel lymph node,SLN)阳性的患者手术范围缩小,即SLN低肿瘤负荷患者中,SLNB可以安全替代腋窝淋巴结清扫(axillary lymph node disp,ALND)。随后,SLNB以及由此衍生而来的标记淋巴结活检将腋窝微创手术的可行性人群范围进一步扩展到了新辅助治疗的患者。近年来,以EUBREAST-061为代表的回顾性研究及有限的前瞻性研究数据初步证实了腋窝降阶梯治疗在新辅助治疗患者中的肿瘤安全性。未来相关研究将聚焦在筛选寻找有望豁免SLNB的特定低危早期乳腺癌或者新辅助治疗后腋窝成功降期的超级反应者,有待于相关高质量临床研究如SOUND、BOOG 2013-08等临床试验长期随访数据的公布。本文就乳腺癌SLNB的发展历史、最新进展及未来展望进行综述,旨在为广大临床工作者提供参考。
[关键词] 乳腺癌;前哨淋巴结活检;进展
乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)是一项兼具诊断及治疗目的的外科技术,是近年来乳腺外科领域具有里程碑意义的重大进展之一。作为一种腋窝微创外科术式,在乳腺癌综合治疗效果不断提高的背景下,SLNB在近40年的发展中呈现出降阶梯趋势,也从侧面反映出乳腺癌作为一种全身性疾病的生物学本质。本文拟就乳腺癌SLNB的发展历史、最新进展及未来展望予以综述,以期为广大临床工作者提供参考。
1 SLNB的发展起源
早在18世纪初,Sappey首次绘制了乳腺的淋巴管图。19世纪,基于Virchow首次提出的淋巴液滤过淋巴结理论,Gilchrist在1940年发现,含碳物质注射后,碳会流动并停留在局部淋巴结,这成为SLNB重要的技术基础。在1960年,前哨淋巴结(sentinel lymph node,SLN)的概念应运而生,由Gould在头颈部肿瘤中提出并使用,SLN定义为原发肿瘤中最先接受淋巴引流、最先发生癌细胞转移的区域淋巴结。1977年,SLNB被Cabanas成功地应用于阴茎癌外科治疗中[1-2]。
与此同时,乳腺癌的外科治疗理念也发生了一系列变革。20世纪初期,由Halsted提出的乳腺癌渐进学说,认为乳腺癌细胞首先通过淋巴管扩散至区域淋巴结,然后出现全身转移,基于此理论,乳腺癌根治术,扩大根治术以及改良根治术成为当时乳腺癌的标准外科治疗方式。然而手术范围的增大似乎并没有为乳腺癌患者带来显著的生存获益。基于肿瘤转移的机制学说,Fisher首先提出乳腺癌发病时即为全身性疾病,该观点的诞生进一步推动了保乳手术作为早期乳腺癌标准治疗的变革。而后Qiute在综合Halsted和Fisher的观点后提出乳腺癌发病时并不是全身性疾病,而随着疾病发展即成为全身性疾病,即淋巴结转移往往是乳腺癌全身转移的先兆,针对此类已发生区域淋巴结转移的乳腺癌患者,腋窝淋巴结清扫(axillary lymph node disp,ALND)的外科治疗有望达到根治的目的。如何通过微创的手术方式评估腋窝淋巴结是否已发生转移,则可进一步促进SLNB在乳腺癌外科治疗中的应用[3-4]。
基于以上理论基础及研究问题,Krag和Alex等于1993年首次在乳腺癌中通过注射放射性核素并利用射线检测的方法证实了乳腺癌中SLN的存在,随后在1994年,Giuliani等报道可以采用染料蓝染示踪法来检测乳腺癌中的SLN。自此,SLN的概念逐步引入乳腺癌外科临床研究中,SLNB也成为早期乳腺癌的标准术式,在临床中推广应用[2,5]。SLNB的发展历史时间轴见图1。
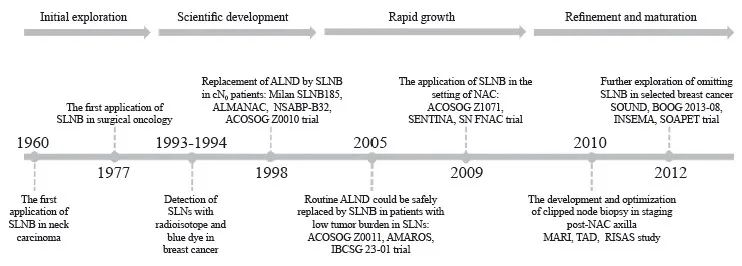
图1 SLNB发展历史时间轴
Fig. 1 A timeline of the development history of SLNB in breast cancer
SLNB: Sentinel lymph node biopsy; ALND: Axillary lymph node disp; NAC: Neoadjuvant chemotherapy; MARI: Marking metastatic lymph node with radioactive iodine seeds; TAD: Targeted axillary disp; RISAS: Radioactive iodine seed placement in the axilla with SLNB.
2 SLNB在早期乳腺癌中的临床应用
腋窝淋巴结的病理学状态是乳腺癌患者预后预测及制订辅助治疗方案的重要因素。在乳腺癌外科治疗从“最大耐受”向“最小有效”转变的发展背景下,在传统的标准乳腺癌改良根治术中,尽管ALND能够提供准确的腋窝分期信息和充分的区域淋巴结控制,但是不可否认的是,作为常规术式的ALND也为乳腺癌患者带来了一系列问题。随着乳腺癌筛查的普及,早期乳腺癌中临床腋窝淋巴结阴性患者的比例提高导致腋窝淋巴结病理学检查结果为阳性患者的比例降低,不必要的ALND反而会增加该部分患者淋巴水肿、肢体疼痛麻木及上肢活动受限等术后并发症的发生概率。正如前所述,SLN作为最早接受肿瘤转移的第一站淋巴结,SLNB在乳腺癌中的应用无疑在很大程度上可避免术后并发症的发生,且对患者远期预后无明显不良影响。
来自意大利的米兰SLNB185前瞻性临床研究[6]证实了SLN阴性患者中SLNB可以安全替代ALND,该试验前瞻性入组了516例临床分期为T1N0的早期乳腺癌患者,随机分为SLNB组及ALND组,其中SLNB组中,SLN阴性患者仅行SLNB,SLN阳性则转为ALND。中位随访64.6个月的结果显示,乳腺癌相关事件包括腋窝淋巴结复发、远处转移及死亡的发生率在SLNB和ALND组中差异均无统计学意义。而随后开展的ALMANAC、NSABP-B32和ACOSOG Z0010等一系列前瞻性、多中心、大样本临床试验[7-9]均证实SLN阴性患者实施SLNB与ALND后具有相同的区域复发率、无病生存(disease-free survival,DFS)率和总生存(overall survival,OS)率,以上研究结果进一步奠定了SLNB在腋窝淋巴结临床阴性早期乳腺癌患者中的标准治疗地位。
基于以上高级别循证医学证据,2005年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)乳腺癌指南和2007年St. Gallen乳腺癌会议专家共识都推荐将SLNB作为临床腋窝淋巴结阴性的早期乳腺癌患者腋窝淋巴结分期的标准处理方法[10-11]。基于CBCSG-001试验结果,2011年起,国内文献[12-13]报道也将SLNB作为早期乳腺癌的标准手术方式。因此, SLNB变革了早期乳腺癌的腋窝外科管理方式,明显降低了乳腺癌术后并发症发生率,显著改善了乳腺癌患者术后生活质量。
早期乳腺癌(Ⅰ期~ⅡB期)腋窝外科管理临床实践流程见图2。
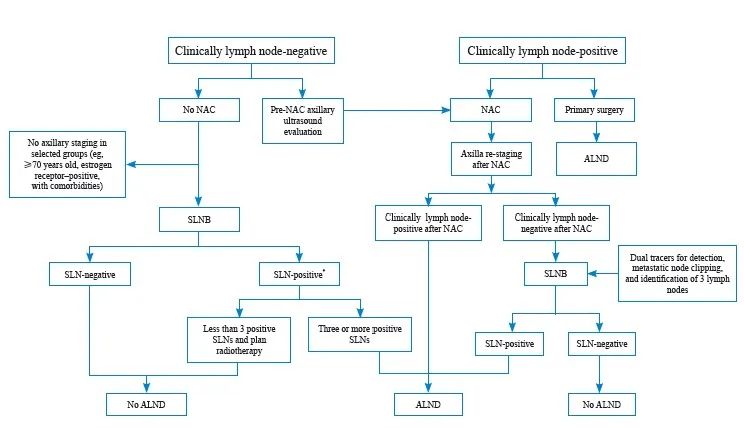
图2 早期乳腺癌(Ⅰ期~ⅡB期)腋窝外科管理临床实践流程图
Fig. 2 Algorithm for the management of the axilla in patients with early-stage (stage Ⅰ to stage ⅡB) breast cancer
*: In rare circumstances, such as T1aN1 stage, it is possible to avoid radiation. NAC: Neoadjuvant chemotherapy; SLNB: Sentinel lymph node biopsy; ALND: Axillary lymph node disp; SLN: Sentinel lymph node.
3 SLNB低肿瘤负荷外科处理模式的转变
随着乳腺癌放疗区域控制理念的不断深入以及系统治疗技术的快速进步,腋窝的外科处理模式也得到了“降阶梯”的进一步推进和发展。如前所述,许多指南[10-11,13]均推荐,SLN阴性的患者可以安全豁免ALND,SLN阳性患者则需要实施ALND。然而,大量临床研究显示,40%~70%乳腺癌患者腋窝清扫的标本中,SLN是唯一出现肿瘤转移的淋巴结,即对于该部分患者,仅需要实施SLNB就已经达到腋窝肿瘤完全切除的目的。针对以上问题,许多医学中心设计了融合多个临床病理学因素的数学模型以预测非SLN转移概率,进而在SLN阳性的患者中筛选出非SLN转移的低危患者,使其免于ALND,其中认可度较高的为美国纪念斯隆凯特林癌症中心(Memorial Sloan Kettering Cancer Center,MSKCC)模型和SOC模型[14-15]。然而,所有预测模型都是基于回顾性数据而建立,且纳入临床因素较多,临床的可推广性和外推性受到很大限制,亟待高级别循证医学数据探索该部分SLN低肿瘤负荷乳腺癌患者的最佳腋窝处理模式,在保证区域控制效果的同时最大程度地提高患者术后的生活质量。
在以上研究背景下,ACOSOG Z0011临床试验评估了临床分期为T1-2N0、1~2枚SLN阳性的接受保乳治疗的乳腺癌患者,将符合以上入组条件的患者随机分组为ALND和SLNB两组,所有患者均常规接受术后全乳放疗,中位随访近10年的结果显示,这两组患者在局部复发率、DFS率以及OS率方面的差异无统计学意义[16]。而同期开展的AMAROS试验旨在探索SLN阳性的早期乳腺癌患者中腋窝区域放疗替代ALND的长期安全性,该研究入组了临床腋窝淋巴结阴性的早期乳腺癌患者,共1 425例腋窝SLN活检阳性的患者随机分为ALND以及腋窝放疗组。最新随访数据显示,ALND组以及单独放疗组的10年累积腋窝复发率分别为0.93%(7/744)和1.82%(11/681),两组的10年DFS率和OS率差异无统计学意义。而放疗组的上肢淋巴水肿发生率也显著低于ALND组[17]。以上两项临床研究的结果提示,在早期乳腺癌SLNB阳性的患者中,可以考虑区域放疗替代ALND。随后开展的IBCSG23-01临床试验则将研究重点聚焦于仅SLN微转移的腋窝低肿瘤负荷患者,符合以上条件的患者随机分为ALND组和非ALND组,中位随访10年的结果证实,非ALND组在区域控制及总体生存方面并不劣于ALND组[18]。
以上3项大型临床试验的结果均显示对于SLN低肿瘤负荷的早期乳腺癌患者,单纯的SLNB完全可以控制患者的局部和远处复发,在不影响生存率的基础上进一步缩小手术范围,提高患者术后的生活质量。必须指出的是,良好的腋窝区域控制必然是以包括全身治疗和放疗在内的综合治疗方案为重要基础的。
4 新辅助治疗后SLNB的应用
新辅助治疗最初用于局部晚期和无法手术切除肿瘤的乳腺癌患者,主要目的在于使肿瘤降期以获得手术机会。近些年来,新辅助治疗越来越多地应用于早期乳腺癌患者,除通过降低肿瘤学分期以达到更高的保乳手术率的目的外,还能通过新辅助治疗来评估治疗反应性,进一步提高病理学完全缓解(pathological complete response,pCR)率,通过个体化指导后续升阶梯治疗策略来最大化提高患者的临床获益。针对那些初始腋窝淋巴结阳性的乳腺癌患者,新辅助治疗能够使得部分患者最终达到腋窝pCR,围绕新辅助治疗后腋窝降期的最佳外科管理策略这一问题,很多研究者进行了一系列的探索。
研究者们首先考虑的是对于上述乳腺癌患者,新辅助治疗后实施SLNB是否可以准确地评估腋窝淋巴结病理学状态。然而,肿瘤细胞阻塞淋巴管或者新辅助化疗导致的纤维化都有可能影响原有淋巴引流通道,同时部分患者腋窝淋巴结对新辅助治疗的反应异质性,都有可能影响新辅助治疗后SLNB的准确性。针对这一问题,3项多中心前瞻性临床试验评估了新辅助化疗后SLNB在初始腋窝淋巴结阳性患者中应用的可行性和准确性。ACOSOG Z1071研究主要纳入了初始临床分期为N1期的患者,SLNB的检出率为92.9%,假阴性率为12.6%;SENTINA研究结果也显示,cN1期降至cN0期的病例中,SLNB的检出率为80.4%,假阴性率为14.2%[19-20]。类似研究设计的SN FNAC研究中,SLNB的假阴性率为13.3%,均没有达到传统设定的SLNB假阴性率 ≤10%的预设目标[21]。因此,以上3项临床试验结果均不支持SLNB作为新辅助治疗后腋窝淋巴结的常规评估方法。另一方面,以上临床试验的探索性分析为降低新辅助化疗后SLNB假阴性率提供了重要参考。SENTINA研究结果显示,单用放射性核素的SLNB检出率为77.4%,假阴性率为16.0%,当使用核素与美兰的联合示踪方法时,SLNB检出率增高至87.8%,假阴性率降至8.6%;检出1枚及2枚SLN时的假阴性率分别为24.3%和18.5%,而取得2枚以上SLN时,假阴性率进一步降至4.9%[19]。ACOSOG Z1071研究则基本上重现了以上结果,应用双示踪技术时SLN的检出率达93.8%,高于单使用染料或者放射性核素的情况,假阴性率也会相应降低至可接受水平[22]。
不仅如此,新辅助化疗前可以将金属夹放置于活检确认转移的腋窝淋巴结中,以利于新辅助化疗后对该标记淋巴结进行评估,提高腋窝评估的准确性。ACOSOG Z1071研究证实,该方法可以将淋巴结活检的假阴性率降至6.3%[23]。另外一项采用放射性碘粒子标记转移腋窝淋巴结的方法(marking axillary lymph nodes with radioactive iodine,MARI)的荷兰小样本研究也证实了类似方法的准确性,假阴性率为7%[24]。美国得克萨斯大学安德森癌症中心(University of Texas MD Anderson Cancer Center)进一步改进该方法并联合SLNB,将其命名为“靶向腋窝清扫术” (targeted axillary disp,TAD),其假阴性率可以进一步降低至2%[25-26]。近期,荷兰前瞻性多中心临床试验-前哨淋巴结活检腋窝放射性碘粒子植入术(radioactive iodine seed placement in the axilla with sentinel lymph node biopsy,RISAS)研究的入组患者在新辅助治疗前均放置125I粒子,新辅助治疗后采用MARI联合SLNB的活检技术进行腋窝评估并进行ALND,以验证该方法的准确性[27]。该研究中,共227例成功接受了RISAS手术,即SLNB联合标记阳性淋巴结切除,该方法成功率为98.2%(223/227),假阴性率约为3.5%,阴性预测值约为92.8%。以上结果均显示,将SLNB与标记淋巴结切除相结合与单纯SLNB或单独切除标记淋巴结相比,成功率和准确率都得到了显著提高。基于以上研究结果,该方法也被最新的ASCO指南所推荐[28]。值得注意的是,两项分别基于美国及荷兰乳腺癌患者人群的大型研究[29-30]结果均显示,近年来新辅助治疗后实施ALND的患者比例显著降低,总体上腋窝外科处理模式也呈现出“降阶梯”的趋势。综上,SLNB的淋巴结个数≥3个、双示踪剂淋巴显像及新辅助治疗前标记转移淋巴结的腋窝活检技术,均可有效地降低新辅助治疗后SLNB的假阴性率。除此之外,新辅助治疗期间的正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)以及空芯针活检、术前的靶向细针抽吸细胞学检查(targeted fine-needle aspiration,TFNA)和术中的细胞学印片检查等也能帮助指导TAD的个体化实施[31-34]。
尽管新辅助治疗后实施SLNB或者TAD的可行性已经被广泛证实,但其长期安全性尚缺乏高级别的询证医学证据。不论是回顾性数据还是小样本前瞻性临床研究数据均证实,新辅助治疗后豁免ALND的区域复发率均处于较低的水平,美国梅奥诊所(Mayo Clinic)和MSKCC的单中心数据显示,豁免ALND的患者腋窝复发率分别仅为0.4%以及0.6%[35-36]。而一项来自于欧洲多中心的前瞻性干预研究显示,新辅助治疗后仅行SLNB的10年DFS率和OS率分别为79%和89%[37]。2022年美国圣安东尼奥乳腺癌会议(San Antonio Breast Cancer Symposium,SABCS)上国际多中心回顾性临床研究EUBREAST-06的初步结果显示,新辅助治疗豁免ALND后腋窝淋巴结达到pCR的患者的3及5年腋窝复发率分别为0.65%(95% CI:0.29%~1.30%)和1.00%(95% CI:0.49%~2.00%)。与此对应,本中心85例新辅助化疗后仅实施TAD的患者的3年腋窝复发率以及无复发生存率分别为0.0%和98.8%[38]。
5 SLNB豁免的探索
在乳腺癌手术方式一直进行“减法”变革的发展趋势下,尽管SLNB带来的并发症发生率较ALND显著降低,但是对于腋窝淋巴结未转移的患者,豁免SLNB在降低术后并发症、提高患者生活质量方面依然具有重要意义。早期的回顾性研究聚焦在低危高龄乳腺癌人群,该部分人群实施SLNB的生存获益有限。因此,2019年St. Gallen乳腺癌会议专家共识推荐年龄>70岁的cT1N0期且拟接受内分泌治疗或存在基础性疾病的Luminal A型乳腺癌患者,可考虑选择性地豁免SLNB[39]。近年来影像学诊断准确率的提升也为筛选部分早期临床腋窝淋巴结阴性患者以豁免SLNB提供了很好的契机,SOUND、BOOG 2013-08、INSEMA和SOAPET等诸多前瞻性研究也正在进行中,期待这些临床试验能对SLNB豁免这一问题给予解答[40]。
此外,部分接受新辅助治疗的早期乳腺癌患者同样也是豁免SLNB评估的潜在人群。3项基于大型新辅助治疗队列的回顾性研究均显示,初始肿瘤负荷较低(cT1-2N0期)且分子分型为人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性型乳腺癌或三阴性乳腺癌,在接受标准新辅助治疗后乳房原发灶达到pCR的情况下,其腋窝pCR率高于98%,理论上达到豁免腋窝外科评估的水平[41-43]。不仅如此,近期一项多中心的临床研究通过人工智能机器学习算法,利用患者、影像学、肿瘤和真空辅助活检的变量,可以准确地预测新辅助化疗后残余肿瘤病灶的存在,有望筛选可豁免手术的pCR患者[44]。然而该部分特定患者是否可以免除SLNB完全保留腋窝功能,未来仍然需要更多的前瞻性临床试验来验证。
6 SLNB未来发展的展望
作为乳腺癌外科手术发展史上的里程碑之一,SLNB已经在早期乳腺癌患者中广泛应用。在SLNB进入乳腺癌地临床实践的40年里,SLNB首先被证实可以准确地评估腋窝状态,随后到SLN阴性患者中安全替代ALND,然后到SLN低瘤荷转移患者豁免ALND,再扩展至新辅助治疗腋窝降期后SLNB的应用,最后到现阶段对于豁免SLNB的进一步探索与验证。在乳腺癌综合治疗手段持续更迭、治疗效果不断提高的背景下,乳腺癌SLNB降阶梯的发展趋势不可逆转,未来需要临床医师综合考虑不同乳腺癌区域复发风险以及辅助治疗(系统治疗及放疗)强度以确定个体化腋窝外科治疗策略,最终实现乳腺癌腋窝淋巴结的精准区域治疗。
[参考文献]
[1] 马春雷, 斋 登. 乳腺癌前哨淋巴结活检现状及研究进展[J]. 疾病监测与控制, 2017, 11(5): 380-382.
MA C L, ZHAI D. Current status and research progress of Sentinel lymph node biopsy in breast cancer [J]. Dis Monitoring Control, 2017, 11(5): 380-382.
[2] 周 嵘, 曾繁余. 乳腺癌前哨淋巴结活检术的研究现状及展望[J].世界最新医学信息文摘, 2019, 19(43): 68-70.
ZHOU R, ZENG F Y. Research status and prospect of sentinel lymph node biopsy for breast cancer [J]. World Latest Med Inform Digest, 2019, 19(43): 68-70.
[3] 段学宁. 乳腺癌手术治疗百年历史回顾与启示[J]. 中国实用外科杂志, 2018, 38(11): 1227-1231.
DUAN X N. Centennial review and enlightenment of breast cancer surgery[J]. China Ind Econ, 2018, 38(11): 1227-1231.
[4] 王金礼, 陈登峰. 乳腺癌前哨淋巴结活检术的研究进展[J]. 河南医学研究, 2017, 26(7): 1206-1208.
WANG J L. CHEN D F. Research progress of sentinel lymph node biopsy in breast cancer [J]. Henan Med Res, 2017, 26(7): 1206-1208.
[5] KRAG D N, ANDERSON S J, JULIAN T B, et al. Technical outcomes of sentinel-lymph-node rep and conventional axillary-lymph-node disp in patients with clinically node-negative breast cancer: results from the NSABP B-32 randomised phase Ⅲ trial[J]. Lancet Oncol, 2007, 8(10): 881-888.
[6] VERONESI U, PAGANELLI G, VIALE G, et al. A randomized comparison of sentinel-node biopsy with routine axillary disp in breast cancer[J]. N Engl J Med, 2003, 349(6): 546-553.
[7] MANSEL R E, FALLOWFIELD L, KISSIN M, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC trial[J]. J Natl Cancer Inst, 2006, 98(9): 599-609.
[8] PROF, DAVID N, KRAG, et al. Sentinel-lymph-node rep compared with conventional axillary-lymph-node disp in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(10): 927-933.
[9] HUNT K K, BALLMAN K V, MCCALL L M, et al. Factors associated with local-regional recurrence after a negative sentinel node disp: results of the ACOSOG Z0010 trial[J]. Ann Surg, 2012, 256(3): 428-436.
[10] LYMAN G H, GIULIANO A E, SOMERFIELD M R, et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J]. J Clin Oncol, 2005, 23(30): 7703-7720.
[11] GOLDHIRSCH A, WOOD W C, GELBER R D, et al. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007[J]. Ann Oncol, 2007, 18(7): 1133-1144.
[12] 王永胜, 欧阳涛, 王启堂, 等. 中国前哨淋巴结活检多中心协作研究CBCSG-001最新资料报告[J]. 中华乳腺病杂志 (电子版), 2009, 3(3): 8-12.
WANG Y S, OUYANG T, WANG Q T, et al. Chinese joint multi-center study of sentinel lymph node biopsy (CBCSG-001): latest news[J]. Chin J Breast Dis Electron Version, 2009, 3(3): 8-12.
[13] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040.
The Society of Breast Cancer China Anti-Cancer Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2021 edition)[J]. China Oncol, 2021, 31(10): 954-1040.
[14] VAN ZEE K J, MANASSEH D M E, BEVILACQUA J L B, et al. A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy[J]. Ann Surg Oncol, 2003, 10(10): 1140-1151.
[15] KOHRT H E, OLSHEN R A, BERMAS H R, et al. New models and online calculator for predicting non-sentinel lymph node status in sentinel lymph node positive breast cancer patients[J]. BMC Cancer, 2008, 8: 66.
[16] GIULIANO A E, BALLMAN K V, MCCALL L, et al. Effect of axillary disp vs no axillary disp on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (alliance) randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926.
[17] BARTELS S A L, DONKER M, PONCET C, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer: 10-year results of the randomized controlled EORTC 10981-22023 AMAROS trial[J]. J Clin Oncol, 2023, 41(12): 2159-2165.
[18] GALIMBERTI V, COLE B F, VIALE G, et al. Axillary disp versus no axillary disp in patients with breast cancer and sentinel-node micrometastases (IBCSG 23-01): 10- year follow-up of a randomised, controlled phase 3 trial[J]. Lancet Oncol, 2018, 19(10): 1385-1393.
[19] PROF, THORSTEN, KUEHN, et al. Sentinel-lymphnode biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study[J]. Lancet Oncol, 2013, 14(7): 609-618.
[20] BOUGHEY J C, SUMAN V J, MITTENDORF E A, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial[J]. JAMA, 2013, 310(14): 1455-1461.
[21] BOILEAU J F, POIRIER B, BASIK M, et al. Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven nodepositive breast cancer: the SN FNAC study[J]. J Clin Oncol, 2015, 33(3): 258-264.
[22] BOUGHEY J C, SUMAN V J, MITTENDORF E A, et al. Factors affecting sentinel lymph node identification rate after neoadjuvant chemotherapy for breast cancer patients enrolled in ACOSOG Z1071 (Alliance)[J]. Ann Surg, 2015, 261(3): 547-552.
[23] BOUGHEY J C, BALLMAN K V, LE-PETROSS H T, et al. Identification and rep of clipped node decreases the false-negative rate of sentinel lymph node surgery in patients presenting with node-positive breast cancer (T0-T4, N1-N2) who receive neoadjuvant chemotherapy: results from ACOSOG Z1071 (alliance)[J]. Ann Surg, 2016, 263(4): 802-807.
[24] DONKER M, STRAVER M E, WESSELING J, et al. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure[J]. Ann Surg, 2015, 261(2): 378-382.
[25] CAUDLE A S, YANG W T, MITTENDORF E A, et al. Selective surgical localization of axillary lymph nodes containing metastases in patients with breast cancer: a prospective feasibility trial[J]. JAMA Surg, 2015, 150(2): 137-143.
[26] CAUDLE A S, YANG W T, KRISHNAMURTHY S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: implementation of targeted axillary disp[J]. J Clin Oncol, 2016, 34(10): 1072-1078.
[27] SIMONS J M, VAN NIJNATTEN T J A, VAN DER POL C C, et al. Diagnostic accuracy of radioactive iodine seed placement in the axilla with sentinel lymph node biopsy after neoadjuvant chemotherapy in node-positive breast cancer[J]. JAMA Surg, 2022, 157(11): 991-999.
[28] BRACKSTONE M, BALDASSARRE F G, PERERA F E, et al. Management of the axilla in early-stage breast cancer: Ontario health (cancer care Ontario) and ASCO guideline[J]. J Clin Oncol, 2021, 39(27): 3056-3082.
[29] VUGTS G, MAASKANT-BRAAT A J, DE ROOS W K, et al. Management of the axilla after neoadjuvant chemotherapy for clinically node positive breast cancer: a nationwide survey study in the Netherlands[J]. Eur J Surg Oncol, 2016, 42(7): 956-964.
[30] CAUDLE A S, BEDROSIAN I, MILTON D R, et al. Use of sentinel lymph node disp after neoadjuvant chemotherapy in patients with node-positive breast cancer at diagnosis: practice patterns of American Society of Breast Surgeons Members[J]. Ann Surg Oncol, 2017, 24(10): 2925-2934.
[31] WU S Y, WANG Y J, ZHANG N, et al. Intraoperative touch imprint cytology in targeted axillary disp after neoadjuvant chemotherapy for breast cancer patients with initial axillary metastasis[J]. Ann Surg Oncol, 2018, 25(11): 3150-3157.
[32] WU S, WANG Y, LI J, et al. Subtype-guided 18F-FDG PET/ CT in tailoring axillary surgery among patients with nodepositive breast cancer treated with neoadjuvant chemotherapy: a feasibility study[J]. Oncologist, 2020, 25(4): e626-e633.
[33] WU S Y, LI J W, WU H L, et al. Accuracy of ultrasound-guided targeted fine-needle aspiration in assessing nodal response in node-positive breast cancer after neoadjuvant chemotherapy: prospective feasibility study[J]. Br J Surg, 2022, 109(12):
1194-1197.
[34] WU S Y, LI J W, ZHANG Y, et al. Repeated core needle biopsy and targeted fine-needle aspiration to optimize axillary surgery after neoadjuvant chemotherapy in node-positive breast cancer: a prospective clinical study[J]. Br J Surg, 2023: znad106.
[35] PILTIN M A, HOSKIN T L, DAY C N, et al. Oncologic outcomes of sentinel lymph node surgery after neoadjuvant chemotherapy for node-positive breast cancer[J].Ann Surg Oncol, 2020,27(12): 4795-4801.
[36] BARRIO A V, MONTAGNA G, MAMTANI A, et al. Nodal recurrence in patients with node-positive breast cancer treated with sentinel node biopsy alone after neoadjuvant chemotherapy-a rare event[J]. JAMA Oncol, 2021, 7(12): 1851-1855.
[37] MARTELLI G, BARRETTA F, MICELI R, et al. Sentinel node biopsy alone or with axillary disp in breast cancer patients after primary chemotherapy: long-term results of a prospective interventional study[J]. Ann Surg, 2022, 276(5): e544-e552.
[38] WU S Y, LI J W, WANG Y J, et al. Clinical feasibility and oncological safety of non-radioactive targeted axillary disp after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: a prospective diagnostic and prognostic study[J]. Int J Surg, 2023. Online ahead of print.
[39] BURSTEIN H J, CURIGLIANO G, LOIBL S, et al. Estimating the benefits of therapy for early-stage breast cancer: the St. Gallen International Consensus Guidelines for the primary therapy of early breast cancer 2019[J]. Ann Oncol, 2019, 30(10): 1541-1557.
[40] JATOI I, KUNKLER I H. Omission of sentinel node biopsy for breast cancer: historical context and future perspectives on a modern controversy[J]. Cancer, 2021, 127(23): 4376-4383.
[41] TADROS A B, YANG W T, KRISHNAMURTHY S, et al. Identification of patients with documented pathologic complete response in the breast after neoadjuvant chemotherapy for omission of axillary surgery[J]. JAMA Surg, 2017, 152(7): 665-670.
[42] BARRON A U, HOSKIN T L, DAY C N, et al. Association of low nodal positivity rate among patients with ERBB2-positive or triple-negative breast cancer and breast pathologic complete response to neoadjuvant chemotherapy[J]. JAMA Surg, 2018, 153(12): 1120.
[43] FAYANJU O M, REN Y, THOMAS S M, et al. The clinical significance of breast-only and node-only pathologic complete response (pCR) after neoadjuvant chemotherapy (NACT): a review of 20 000 breast cancer patients in the national cancer data base (NCDB)[J]. Ann Surg, 2018, 268(4): 591-601.
[44] PFOB A, SIDEY-GIBBONS C, RAUCH G, et al. Intelligent vacuum-assisted biopsy to identify breast cancer patients with pathologic complete response (ypT0 and ypN0) after neoadjuvant systemic treatment for omission of breast and axillary surgery[J]. J Clin Oncol, 2022, 40(17): 1903-1915.


