Cell:人类和黑猩猩干细胞遗传依赖性的比较图谱揭示人类细胞演变过程中的关键变化
时间:2023-07-24 21:20:08 热度:37.1℃ 作者:网络
导读
长期以来,针对人类和黑猩猩的比较研究一直试图确定人类独特特征的进化起源。在700万年的时间里,人类进化出许多独有的生理特征,从两足行走到大脑皮层扩张了3倍。随着现代分子生物技术的高速发展,人们分析了许多“进化”了的编码基因,但基因的准确表达离不开非编码调控序列,即“遗传依赖性”,迄今为止针对非编码调控序列的研究却十分少见。人类特定的遗传变异和基因表达变化众多,其中多数突变为中性或低效应,因此将个体突变与进化的人类特征联系起来仍有挑战性。
近日,美国麻省理工学院Whitehead生物医学研究所、加州大学旧金山分校的研究团队合作在Cell上发表了题为“Comparative landscape of genetic dependencies in human and chimpanzee stem cells”的文章。研究团队建立了一个比较功能缺失的方法来评估人类细胞是否表现出不同的遗传依赖性,并绘制了人类和黑猩猩干细胞中遗传依赖性的比较图谱。通过在人类和黑猩猩多能干细胞(PSC)中进行全基因组CRISPR干扰(CRISPRi)筛选,共鉴定75个对细胞增殖具有物种特异性影响的基因;在神经祖细胞和脑类器官中,人类对CDK2和CCNE1缺失的特异稳健性持续存在。

文章发表于Cell
为实现基于CRISPR的比较基因筛选,研究人员首先在两个人类PSC细胞系(PSC细胞系WTC11、ESC细胞系H1)和两个黑猩猩PSC细胞系(iPSC细胞系C3649、Pt5-C)的CLYBL基因位点上设计了CRISPRi机制;并构建了慢病毒全基因组hCRISPRi-v2 sgRNA库,使用CRISPRi技术进行检测(图1)。结果显示,在四个PSC筛选中,靶向常见必需基因的sgRNA大量缺失,靶向增殖抑制基因的sgRNAs大量富集;人类和黑猩猩之间共享约82.9%-92.6%的常见必需基因。
此外,为鉴定对细胞增殖具有物种特异性的基因,研究人员利用MAGeCK并开发了一种基于自举法(Bootstrapping)的方法,鉴定了583个候选物种特异性必需基因和202个特异性增殖抑制基因(图1D)。
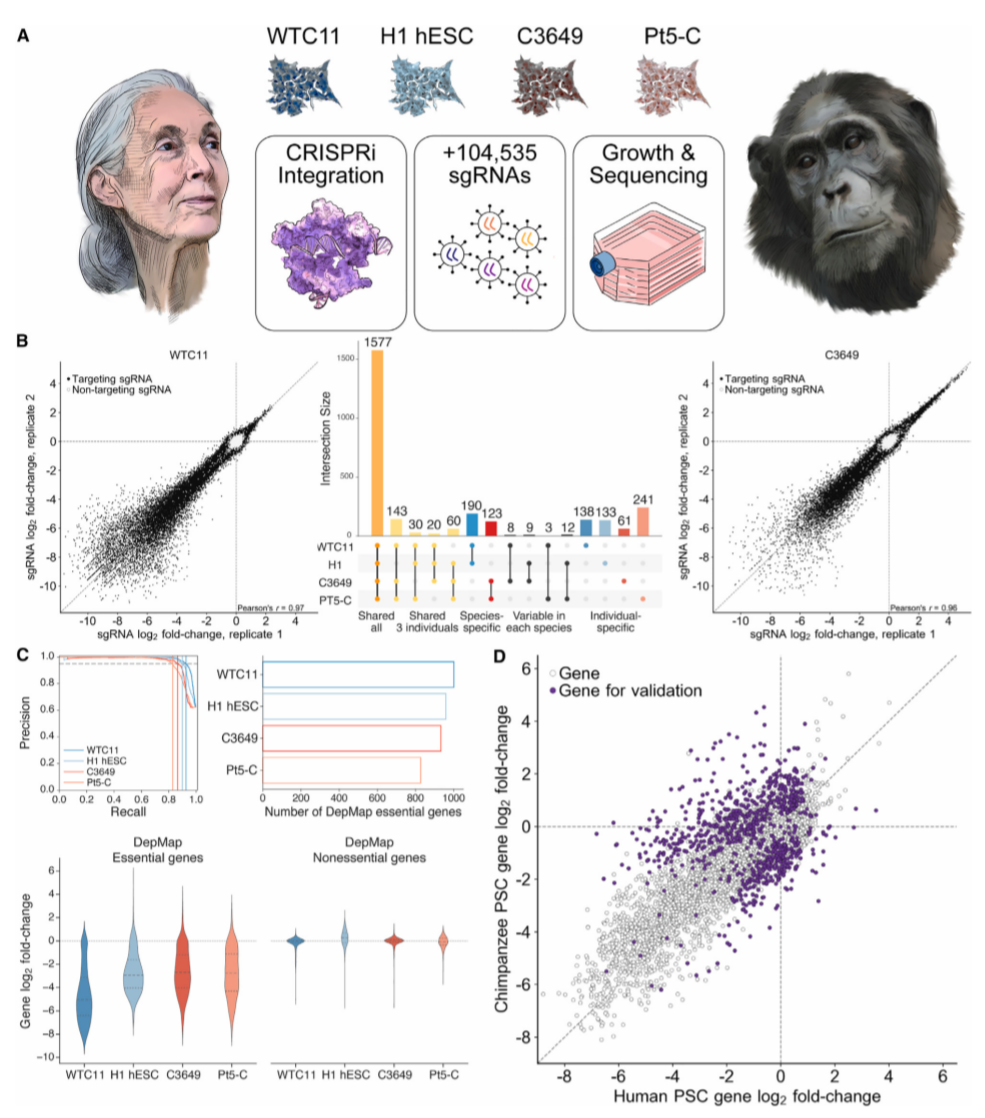
图1. 人类和黑猩猩干细胞全基因组CRISPRi筛选。来源:Cell
为验证人类和黑猩猩PSC之间的物种差异,研究人员从4个人类和4个黑猩猩个体中设计了新的CRISPRi干细胞系,构建了一个比较基本验证文库(CEV-v1),进行了16次CRISPRi验证筛选(图2)。结果表明,通过sgRNA图谱的相似性,可区分所有人类和黑猩猩的个体;主要的变异轴与sgRNA表达随时间的共享变化(PC1)和物种特异性变化(PC2)有关。上述研究结果表明,人类和黑猩猩的干细胞可以通过其对基因扰动的反应来区分。
研究人员还鉴定了人类和黑猩猩sgRNA图谱差异的基因,并检测了对细胞增殖具有不同影响的sgRNA。结果显示,共确定了1,133个物种之间存在差异的sgRNA、75个物种特异性基因,这些发现揭示了人类和黑猩猩进化中一系列的物种特异性遗传依赖性。

图2. 在人类和黑猩猩个体中验证了物种的遗传依赖性。来源:Cell
研究团队探讨了物种特异性遗传依赖性是否与靶基因自身的编码序列或调节的变化有关。分析结果表明,对于人类和黑猩猩干细胞而言,编码序列及其调控序列的变化并不主导物种发育差异化,由遗传背景驱动的多种间接影响才是造成遗传依赖性差异的主要原因。
接下来,研究人员分析了物种特异性遗传依赖性是否涉及已知相互作用的基因组(图3)。结果显示,功能相关基因在每个物种中均以一致的减少或富集模式出现;蛋白质互作和几个已确定生物学过程的组分出现富集。值得注意的是,人类PSC对细胞周期调节因子的缺失具有较强的抵抗力,即细胞周期蛋白依赖性激酶2(CDK2)、细胞周期蛋白E1(CCNE1)和细胞周期蛋白依存性激酶4(CDK4)。
研究人员检测了sgRNA介导的抑制对候选基因(CDK2、CCNE1和RBL1)的影响。qRT-PCR 结果显示,两个物种的敲除率均>90%,表明增殖差异不是由一个物种的不完全敲除效率驱动的。
ATP6AP1/2是V-ATP酶的两种辅助蛋白,研究人员研究了人类对ATP6AP1和ATP6AP2缺失的特异性敏感性。与预期一致,V-ATP酶的核心亚基对人类和黑猩猩都是必需的;人类ATP6AP1缺失后,pS6水平下降最为明显,表明人类干细胞更依赖于ATP6AP1介导的mTORC1信号通路。
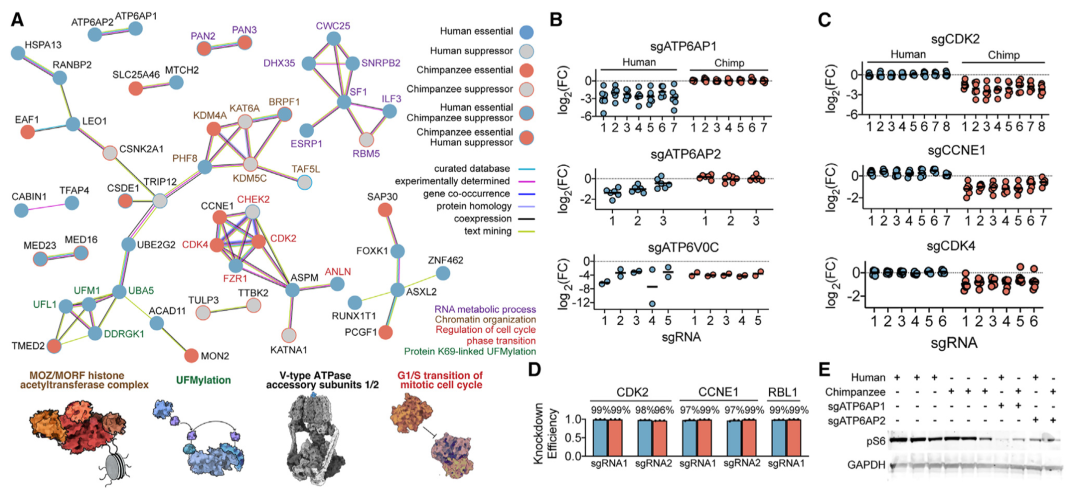
图3. 物种依赖性的核心。来源:Cell
研究人员探究了黑猩猩对细胞周期基因缺失的特异敏感性是否与这些基因被抑制后细胞周期进程的变化有关(图4)。在敲除CDK2或细胞周期蛋白E1后,黑猩猩PSC中G1期细胞积累增加了2倍,人类PSC无明显影响,表明细胞周期蛋白E1-CDK2 在黑猩猩G1/S期转变中具有较大的控制作用,人类PSC在G1/S期转变中对其依赖性较小。
进一步,研究人员分析了细胞周期调节因子RBL1、FAM122A对人类和黑猩猩细胞周期的影响。在两个物种中,RBL1的抑制导致了更快的细胞生长和G1期细胞比例的减少;RBL1对黑猩猩细胞影响更大。FAM122A的缺失会导致CDK2的缺失,进而促进黑猩猩PSC中G1细胞的积累,人类PSC无影响。在两个物种的PSC中,FAM122A缺失均促进了对CHK1抑制剂prexasertib的耐药性。
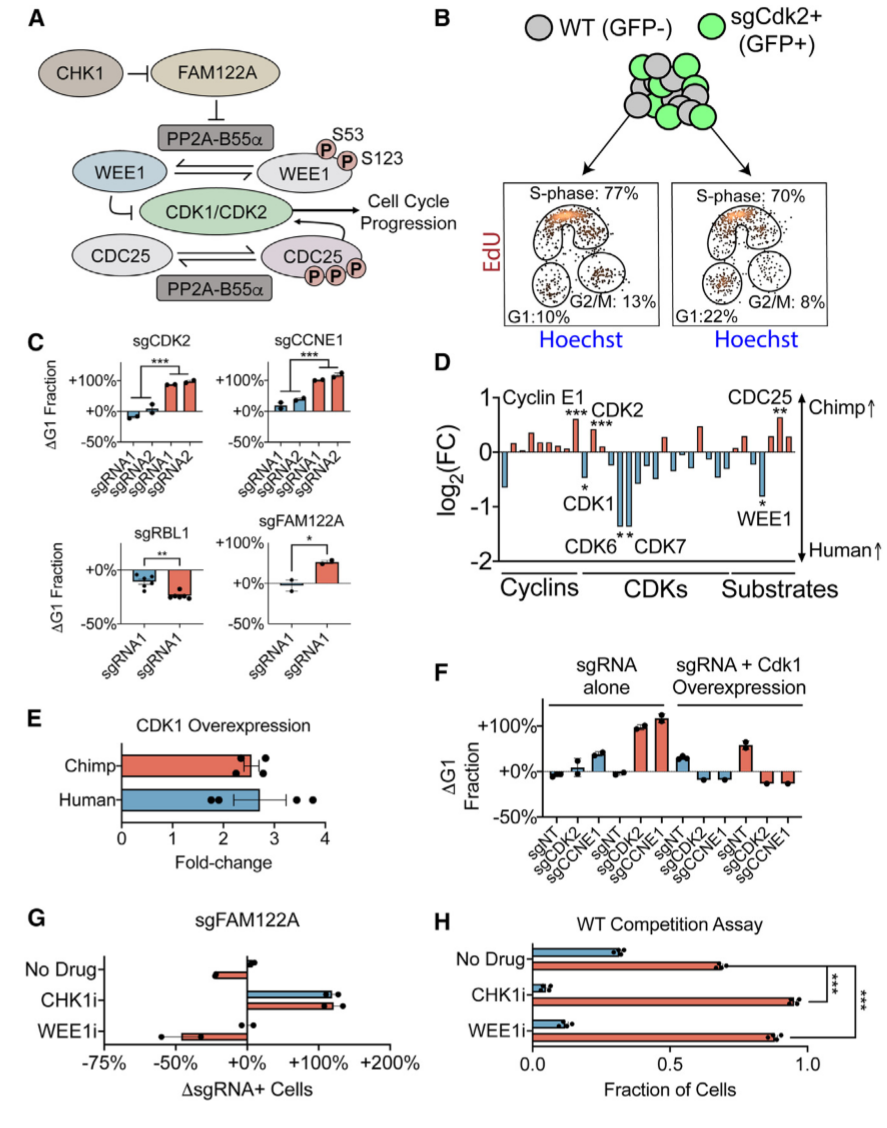
图4. 人类和黑猩猩细胞周期进程的不同调控。来源:Cell
研究人员通过CRISPRi获得了人类和黑猩猩神经上皮祖细胞(NPC),并评估了周期蛋白E1、CDK2、RBL1和FAM122A的缺失如何影响细胞周期进展(图5)。结果显示,CDK2或周期蛋白E1的敲除会导致黑猩猩NPC在G1期额外积累,人类NPC则无影响;RBL1敲除降低了人类和黑猩猩G1细胞的比例;FAM122A的缺失导致黑猩猩NPC在G2/M期积累。
进一步,研究人员检测了脑类器官对基因扰动的物种特异性反应。结果显示,人类类器官发育对CDK2、CDK4或CCNE1缺失的稳健性较强,对ATP6AP1缺失较敏感。CDK2的缺失会导致黑猩猩类器官中较大比例的细胞处于G1期,而在人类类器官中没有观察到这种影响。上述结果表明,人类NPC对G1/S期进展调节因子缺失的增强稳健性可能会使人类细胞偏向增殖分裂。
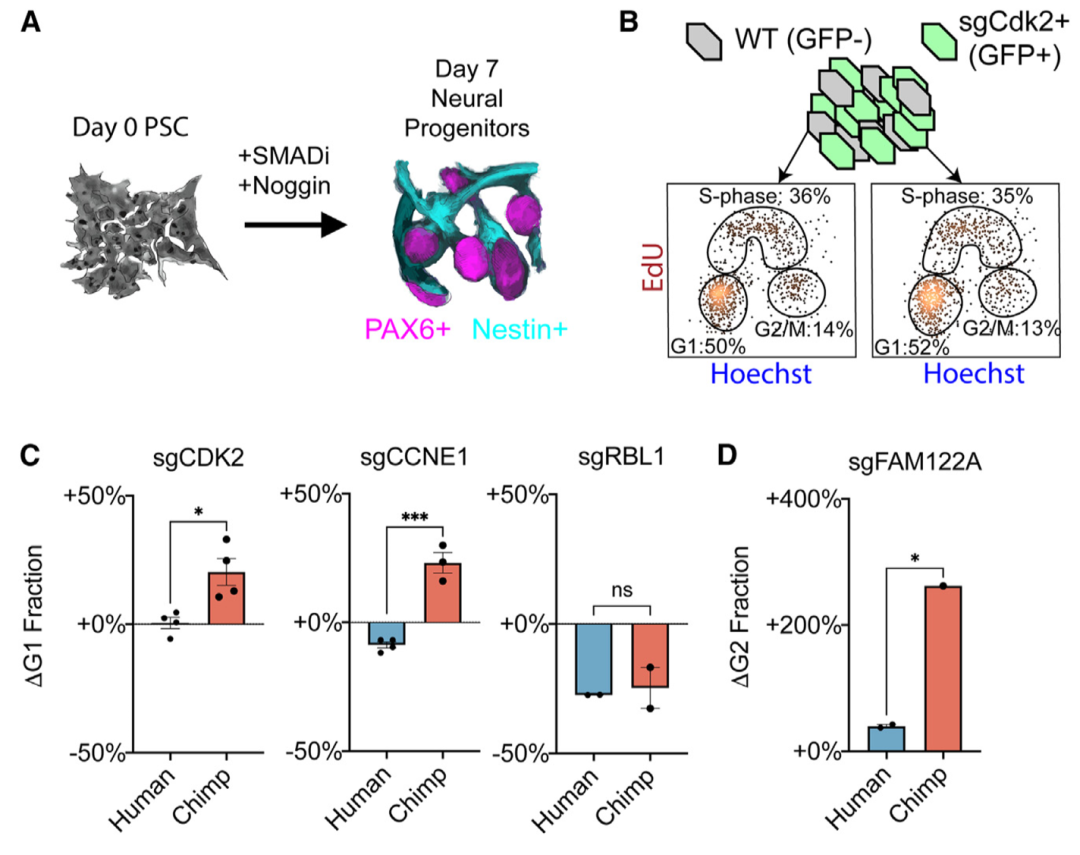
图5. 细胞周期扰动改变NPC扩增。来源:Cell
为确定人类和黑猩猩特定基因依赖性的进化起源,研究人员将比较研究扩展到猩猩PSC中(图6)。在黑猩猩和猩猩PSC中,靶向CDK2的sgRNA表达细胞在10天内显著减少,而人类PSC中未出现这种情况。研究观察到人类PSC对CDK4和细胞周期蛋白E1的抑制无明显影响;黑猩猩或猩猩PSC中ATP6AP1的敏感性并不相同。因此,研究人员推断,人类和黑猩猩的遗传依赖性具有差异,人类对G1/S期转变的稳健性是沿着人类谱系进化的。

图6. 猩猩PSC表明物种遗传依赖性的进化起源。来源:Cell
综上所述,人类和黑猩猩的PSC在细胞形态、对体外分化的反应和一组核心必需基因方面相似。研究团队通过配对的全基因组CRISPRi筛选,发现了人类和黑猩猩的PSC具有不同的遗传依赖性,并确定了75个在控制细胞增殖方面具有不同作用的基因。该研究表明,人类细胞的进化变化重塑了必需基因的表达,并为系统地揭示物种之间潜在的细胞和分子差异建立了一个平台。
参考文献:
She R, Fair T, Schaefer NK, et al. Comparative landscape of genetic dependencies in human and chimpanzee stem cells. Cell.


