【Biomarker Research】提高CAR-T持久性的策略
时间:2022-12-19 17:59:22 热度:37.1℃ 作者:网络
CAR-T持久性
CAR-T细胞疗法显著改善了难治性或复发性 B 细胞淋巴瘤患者的预期寿命,而对于 B 细胞急性淋巴细胞白血病 (B-ALL),尽管主要缓解率较高,但早期复发风险也高,从而导致单独使用 CAR-T 细胞疗法的长期生存不足。其中一个主要挑战是 CAR-T 细胞的持久性有限。为了进一步优化 CAR-T 细胞的临床效果,已有许多研究集中于修饰 CAR 结构和调节 CAR-T 细胞分化。
近日《Biomarker Research》杂志发表了新桥医院张曦教授等关于CAR-T 细胞持久性的一篇综述,作者总结了几种调节 CAR-T 细胞代谢和分化以提高 CAR-T 持久性的策略,包括选择合适的细胞来源(自体或异基因CAR-T细胞)、改善体外培养条件、CAR-T细胞与常规药物结合、应用基因工程等,旨在为 CAR-T 细胞治疗后的复发和难治性问题提供方法或线索。

选择CAR‑T治疗的合适细胞来源的策略
自体还是异基因CAR-T细胞
T细胞的质量和特性对于 CAR-T疗效至关重要。根据 T 细胞的来源将 CAR-T 细胞分为自体和异基因(autoCART和alloCAR-T),但两者均有独特的益处和挑战尚未解决。
autoCAR-T是从患者体内分离出 T 细胞,因此不会发生免疫排斥,但肿瘤微环境 (TME) 中的长期浸润会降低细胞毒性并诱导 T 细胞耗竭,可能导致 autoCAR-T 细胞对肿瘤的治疗效果不足;此外从细胞收集到细胞输注耗时较长,对于重症患者来说可能过于冗长。并且CAR-T细胞治疗的成本太高,无法广泛应用。
而AlloCAR-T 细胞有可能克服这些问题。它可以提前收集和准备,然后立即给予患者;与患者的 T 细胞相比,健康供体 T 细胞具有更大的细胞毒性,且这些细胞的多次和系统生产可能会降低平均成本,也更容易进行。但应用 alloCAR-T 细胞的最大障碍是宿主与移植物抗宿主病 (HvGD) 和移植物抗宿主病 (GvHD),需要通过 TCR 和人类白细胞抗原 (HLA) 的基因工程来克服,也可以通过 TALEN 和 CRISPR 系统来完成。
实际应用方面,最近发表的临床结果显示 autoCAR-T 细胞比 alloCAR-T 细胞治疗效果更好。与 alloCAR-T 细胞相比,autoCAR-T细胞在最近的临床试验中几乎在所有方面都性能更优,尤其是在持久性方面。无论如何,alloCAR-T细胞的核心优势,即其“现成”的性质仍不容忽视,意味着可以大规模系统生产的显著效益。此外,CRISPR基因组编辑工具可实现对 alloCAR-T 细胞进行简单的操作,这在未来的肿瘤免疫治疗研究中值得探索。
T细胞亚群
细胞亚群也影响 CAR-T 细胞持久性和治疗疗效。常规的 CAR-T 细胞疗法主要得到CD4+ 和CD8+ T细胞两个亚群,但CD4/CD8 比值在患者或供者中并不恒定。CD4+ 和CD8+ T细胞亚群均能够有效杀伤肿瘤细胞,在体外和体内均可表现出协同抗肿瘤作用。此外CD4+ 和CD8+ CAR-T细胞区隔对有效抗肿瘤活性极为重要。
由于 CAR-T 免疫疗法的巨大成功,其他类型的免疫细胞改造创新 CAR也得以研究,包括NKT、γδT(可通过穿孔素-颗粒酶 B 途径、Fas-FasL途径和抗体依赖性细胞介导的细胞毒途径杀死靶细胞)、调节性 T 细胞 (Treg) 和一系列不常见的 T 细胞亚群也是免疫细胞治疗的潜在候选者。
优化CAR‑T体外细胞培养条件的策略
T 细胞分化影响CAR‑T细胞效率
T 细胞亚群的分化在调节 CAR-T 细胞抗癌活性中同样起着很大的作用,且分化状态也因个体和培养平台而异。根据细胞表面标记物的表达可将 T 细胞细分为5个主要和典型亚群,对于每个 T 细胞亚群来说,不同的表型提示其功能特征和多样性,对于开发和理解 CAR-T 细胞治疗的新策略至关重要。
初始 T 细胞(TN):具有较高的繁殖和存活能力,但无法避免在 CD3/CD28 抗体刺激和活化的扩增阶段 TN 比例急剧下降;经 CD3/CD28 抗体和细胞因子刺激和活化后,TN细胞可快速分化为记忆 T 细胞和效应 T 细胞。干细胞记忆 T 细胞(TSCM):处于比记忆 T 细胞更早的分化阶段,TSCM细胞能快速对抗原刺激作出反应,并保持较强的自我更新能力,表明其在过继性 T 细胞治疗中具有巨大的潜力,尽管细胞比例极低。中央记忆 T 细胞(TCM):TCM和 TSCM细胞的比值已成为评估 CAR-T 治疗效果的关键性能指标,对两个记忆 T 亚群的进一步比较发现,TSCM细胞比 TCM细胞可以保留更高比例的初始表型,表明自我更新能力更强;效应记忆 T 细胞(TEM):与 TSCM 和 TCM 细胞相比缺乏 CCR7 和 CD62L 表达,从而阻止了这些细胞归巢到淋巴结,但它们可以进入靶组织,一旦细胞遇到抗原,效应功能迅速产生以及分泌一系列细胞因子,如TNF-α、IFN-γ和穿孔;终末效应 T 细胞(TEFF):抗癌细胞的主要 T 细胞亚群,但寿命较短,几乎没有任何自我更新能力,在解决慢性感染或杀死癌细胞后,TEFF细胞不可避免地失去效应功能,变得耗尽。
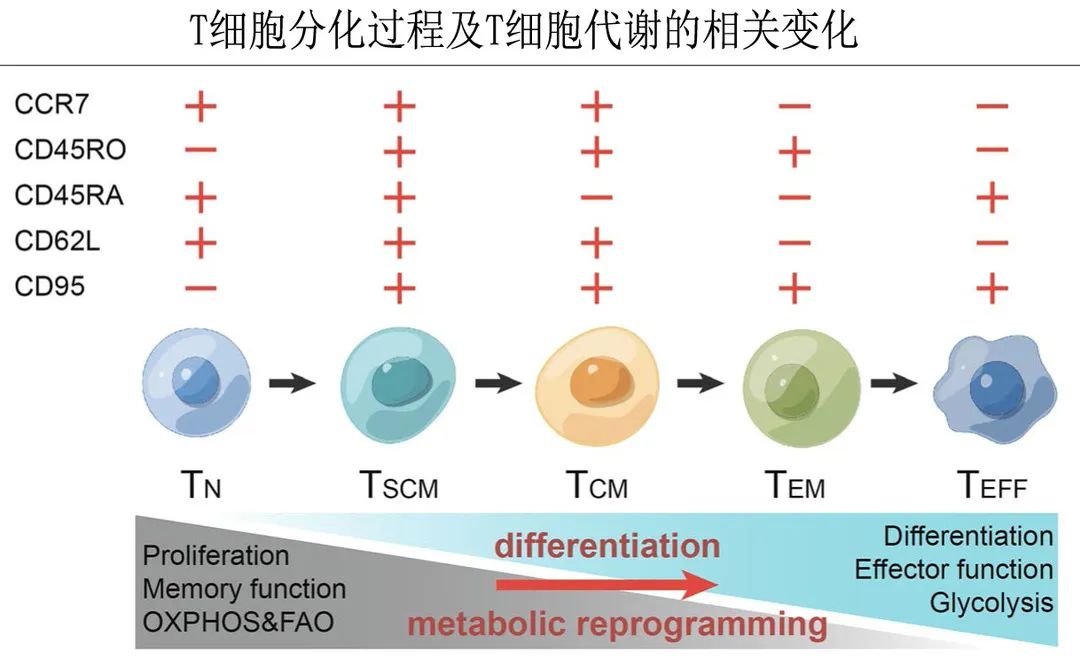
5个分化的 T 细胞亚群在增殖能力和抗肿瘤作用方面具有多样性特征,对 CAR-T 细胞的临床疗效有实质性贡献。与传统 CAR-T 细胞相比,来源于 TSCM 细胞或高比例记忆 T 细胞的 CD19 CAR-T 细胞表现出长期持续性和应答。因此TSCM和 TCM细胞在体内比 TEM 和 TEFF 细胞具有更好的持久性和抗肿瘤活性。因此研究人员将重点放在改变 T 细胞分化的策略上,在体外诱导更多的TSCM和 TCM细胞。
培养条件影响CAR‑T细胞分化和功能
除了表面标志物和功能的差异外,5个 T 细胞亚群之间的代谢需求也是多样的。T细胞代谢重编程与 T 细胞活化同时发生,是过继治疗的另一个关键组分。TN 细胞主要的代谢途径和能量获取方法是线粒体中的氧化磷酸化 (OXPHOS) 和脂肪酸氧化 (FAO),作为对 CD3/CD28 抗原刺激信号的响应,TN细胞加速代谢以满足增加的生物合成需求 。PI3K-AKT-mTOR 通路被激活,随后促进有氧糖酵解(Warburg效应)。这种代谢重编程还导致 TN 细胞转化为 TEFF 细胞。TSCM和 TCM 细胞的代谢模式与 TN 细胞相似,主要依赖于 OXPHOS 和低水平糖酵解。
为介导 T 细胞分化,提高 CAR-T 细胞扩增阶段的 TSCM 和 TCM 比值,从而影响持久性和临床性能,对培养条件和操作步骤已进行了深入探讨。这些策略优化培养条件的核心机制与通过增加 OXPHOS 和在体外适当抑制糖酵解来调节 T 细胞代谢有关,结果是高百分比的 TSCM 和 TCM细胞,最终是 CAR-T 免疫治疗优越的寿命和抗肿瘤潜力。
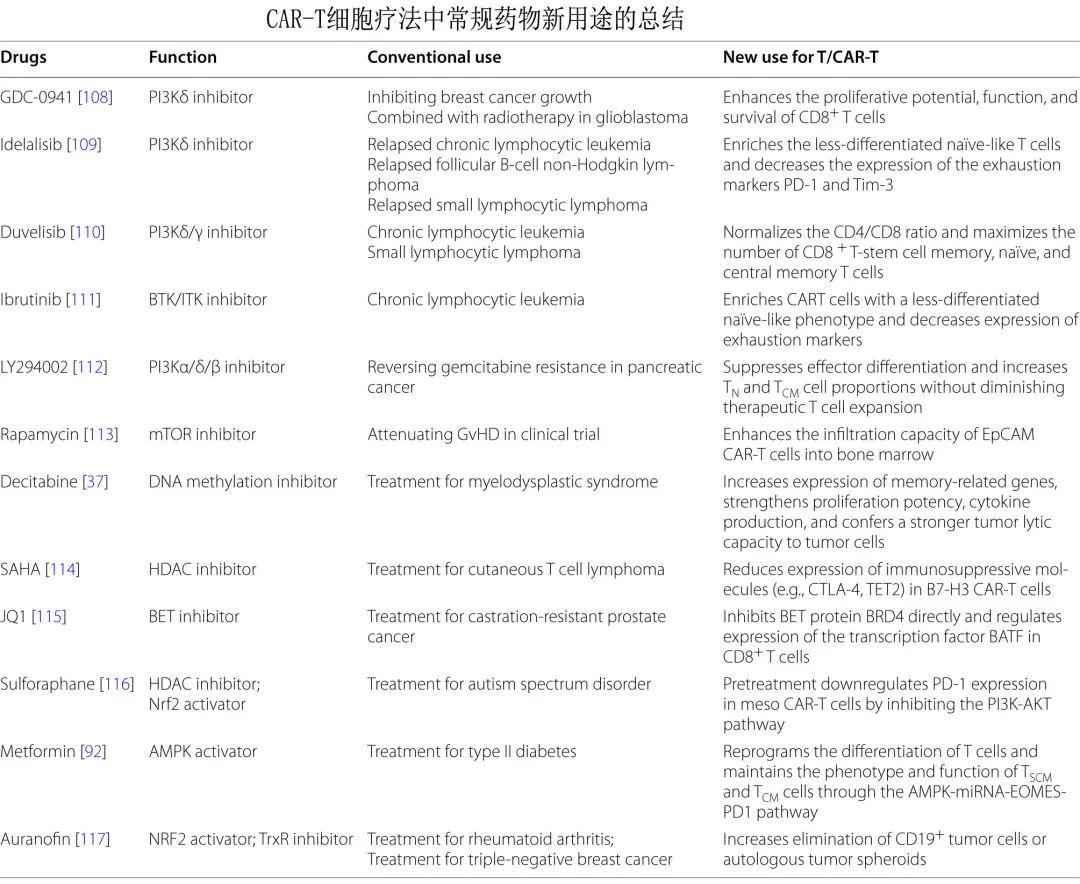
CAR‑T细胞扩增阶段常规药物的新型应用策略
多种靶向代谢途径的激活剂和抑制剂,甚至用于治疗其他疾病的常规药物也与CAR‑T细胞一起使用,可提高免疫治疗。重点关注这些临床分子和可能调节代谢和 T 细胞分化的药物作为新型 CAR-T 佐剂的应用。
通过基因工程增强CAR‑T细胞功能的策略
遗传工程已广泛应用于生物科学和医学领域,特别是成簇的规则间隔短回文重复序列 (CRISPR) 相关蛋白 9 (CRISPR/Cas9) 系统是下一代基因组编辑技术,已得到广泛应用。该系统代表了对各种疾病功能基因组研究的革命性创新,包括单基因疾病、多基因疾病和癌症,可用于免疫治疗。
通过CRISPR/Cas9增强CAR-T细胞功能的方式包括通过 CRISPR/Cas9 生成alloCAR‑T细胞、通过 CRISPR/Cas9 提高CAR‑T细胞效率和通过激活因子共表达提高CAR‑T细胞效率。
新发现的寿命更长、效率更高的CAR‑T细胞靶点
大量研究集中在利用 CRISPR 介导的基因敲除或异位过表达改善 CAR-T 免疫治疗,这些基因中的大多数已被验证在抗肿瘤免疫应答中发挥一定的功能。
上述提高 CAR-T 细胞长期持久性和抗肿瘤性能的优化策略汇总于下图。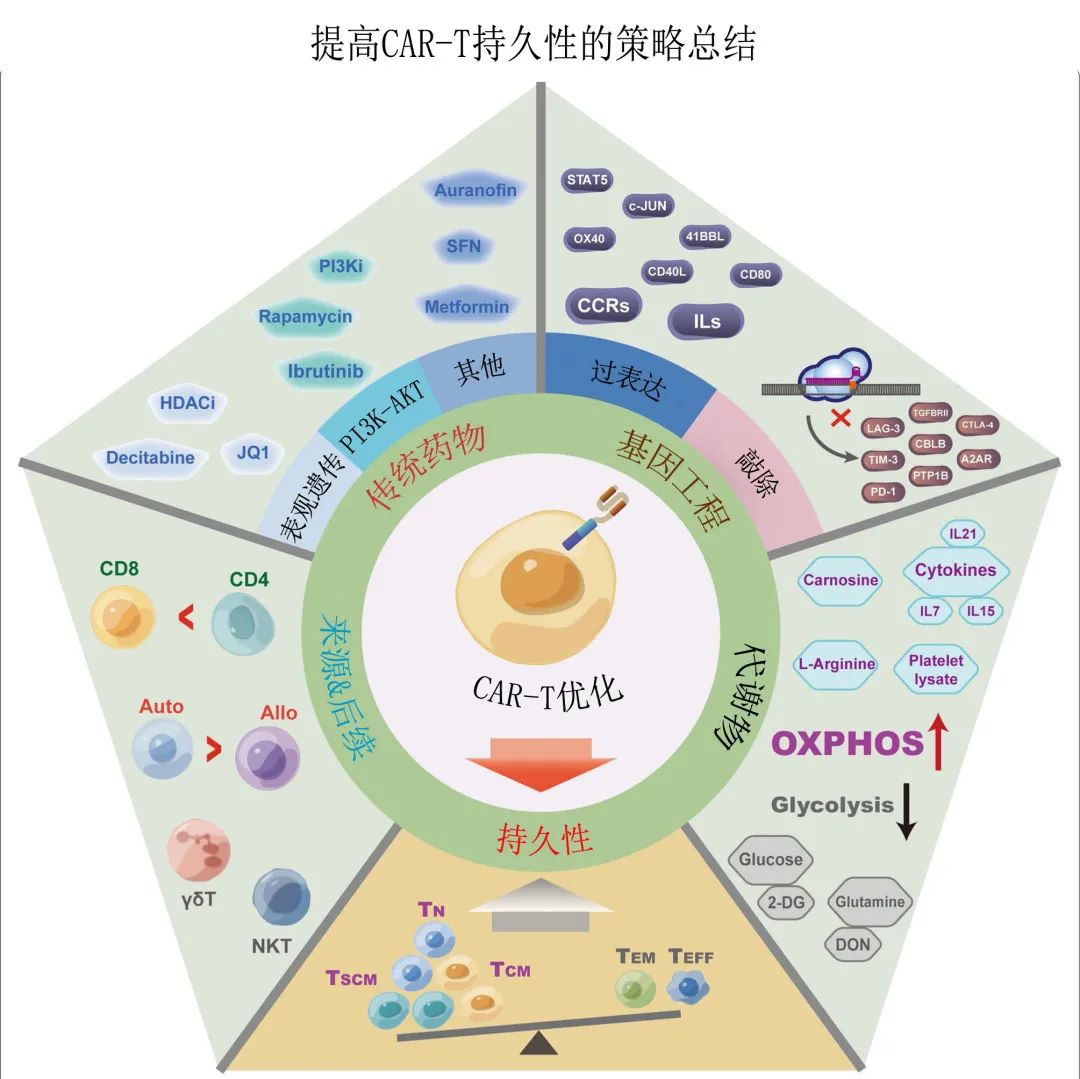
参考文献
Yue Liu, Lingna An, Ruihao Huang ,et al.Strategies to enhance CAR-T persistence.Biomark Res . 2022 Nov 23;10(1):86. doi: 10.1186/s40364-022-00434-9.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


