CDD | 浙江大学白雪莉/梁廷波发现靶向泛素特异性蛋白酶8使胰腺癌的抗程序性死亡配体1免疫疗法敏感
时间:2022-12-26 11:59:59 热度:37.1℃ 作者:网络
程序性死亡受体1(PD-1)及其配体程序性死亡配体1 (PD-L1)帮助肿瘤细胞逃避免疫监测,被认为是抗肿瘤免疫治疗的重要靶点。PD-L1翻译后修饰在免疫抑制方面具有潜在价值。
2022年12月20日,浙江大学白雪莉及梁廷波共同通讯在Cell Death & Differentiation(IF=12)在线发表题为“Targeting ubiquitin-specific protease 8 sensitizes anti-programmed death-ligand 1 immunotherapy of pancreatic cancer”的研究论文,该研究表明靶向泛素特异性蛋白酶8能够使胰腺癌的抗程序性死亡配体1免疫疗法敏感。该研究发现泛素特异性蛋白酶8 (USP8)去泛素化PD-L1。胰腺癌组织中USP8水平明显高于正常组织。临床上,USP8的表达在多个胰腺癌患者来源的队列中显示出与肿瘤-淋巴结转移阶段的显著相关性。同时,USP8缺失可以免疫依赖性地减少肿瘤侵袭迁移和肿瘤大小,提高抗肿瘤免疫原性。
USP8抑制剂预处理减少了肿瘤发生,USP8敲除肿瘤的免疫功能正常小鼠表现出延长的生存期。此外,USP8与PD-L1正向相互作用,并通过抑制胰腺癌中泛素化调控的蛋白酶体降解途径上调其表达。USP8抑制剂和抗PD-L1联合治疗通过激活细胞毒性T细胞有效抑制胰腺肿瘤生长,抗肿瘤免疫主要依赖于PD-L1途径和CD8 + T细胞。总之,该研究结果强调了靶向USP8的重要性,它可以使PD-L1靶向的胰腺癌对免疫治疗敏感,并可能代表未来治疗胰腺肿瘤患者的一种新的治疗策略。

胰腺癌最常见的诊断形式是胰导管癌(PDAC),其发病率和死亡率较高,且PDAC患者预后较差。近年来,免疫治疗策略的进展提高了人们对改善治疗结果的期望,特别是对重要的免疫检查点蛋白程序性死亡蛋白-1 (PD-1)及其配体程序性死亡配体-1 (PD-L1)的靶向治疗。PD-L1/PD-1通路抑制策略已在多种类型的癌症中获得批准,如乳腺癌、黑色素瘤和非小细胞肺癌。然而,PDAC具有强大的免疫抑制肿瘤微环境,这可能是PD-L1/PD-1阻断疗法反应降低的主要原因。因此,揭示PD-L1的调控机制对于提高以PD-L1为基础的联合治疗的临床疗效至关重要。
PD-L1的翻译后修饰(PTMs)已被证明在调节癌细胞免疫抑制中发挥关键作用。最近的研究表明,靶向PD-L1 PTMs,包括磷酸化、N-糖基化和泛素化可以调节PD-L1增强抗肿瘤免疫反应,从而提供潜在的治疗方案。PD-L1通过E3连接酶和去泛素化酶被泛素/蛋白酶体通路调控,这表明靶向PD-L1泛素化可能降低肿瘤免疫抑制。一项研究表明,COP9信号体5 (CSN5)可以将NEDD8泛素样修饰物(NEDD8)从cullin-NEDD8中解聚,从而对泛素酶活性起负面作用。作者已经证明了nima相关激酶2 (NEK2)可以在T194和T210位点磷酸化PD-L1,从而抑制泛素化调控的蛋白酶体介导的PD-L1降解,增强免疫逃避能力。此外,作者的另一项研究表明,泛素特异性蛋白酶22(USP22)可以去泛素化PD-L1以稳定蛋白质,导致肝癌免疫抵抗。因此,上述研究表明PD-L1泛素化修饰在癌症治疗中发挥着潜在的重要作用,靶向该PTM可能在胰腺癌中产生有前景的抗肿瘤作用。
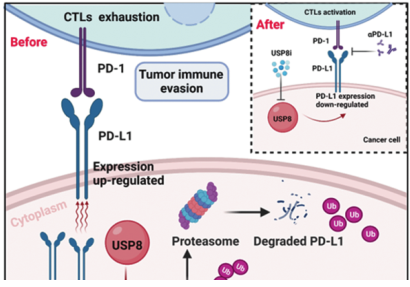
USP8在胰腺癌中对PD-L1稳定性的调控(图源自Cell Death & Differentiation)
USP8是一种去泛素化酶(DUB),可以催化泛素的释放来保护蛋白质不被降解。USP8在细胞增殖、细胞周期、蛋白质表面定位等方面具有重要作用。值得注意的是,越来越多的证据表明,USP8上调或突变可通过影响不同类型肿瘤的多种信号通路,包括但不限于肺癌、胃癌和乳腺癌,从而导致癌症进展、转移和生存不良。然而,目前尚无USP8在胰腺癌中的作用研究报道。特别是,USP8在抗肿瘤免疫治疗中的生物学作用尚不清楚。
综上所述,该研究发现USP8是一种新型的PD-L1去泛素化酶,它通过抑制泛素化调控的蛋白酶体降解途径上调PD-L1水平,从而通过免疫逃避促进胰腺肿瘤的生长。USP8抑制剂和αPD-L1的联合治疗降低了PD-L1蛋白水平,导致细胞毒性T细胞的激活。总的来说,靶向USP8与其他抗肿瘤药物联合可能是癌症免疫治疗改善患者预后的潜在策略。
原文链接:
https://www.nature.com/articles/s41418-022-01102-z


