Nature子刊 | 牛津大学冷厚甫等揭示骨髓瘤骨病治疗新策略
时间:2022-12-26 12:00:00 热度:37.1℃ 作者:网络
多发性骨髓瘤是一种无法治愈的浆细胞恶性肿瘤,患者经常发生骨溶解性骨病变,严重影响生活质量和临床结果。Eliglustat是一种美国食品和药物管理局批准的葡萄糖酰神经酰胺合成酶抑制剂,在骨髓瘤临床前体内模型中减少破骨细胞驱动的骨质丢失。
2022年12月22日,英国医学科学院院士、英国牛津大学终身教授Katja Simon团队(冷厚甫为第一作者)在Nature Communications 在线发表题为“Modulating glycosphingolipid metabolism and autophagy improves outcomes in pre-clinical models of myeloma bone disease”的研究论文,该研究描述了糖基神经酰胺合酶抑制阻止TRAF3自噬降解以减少破骨细胞形成的机制,并强调了eligustat治疗骨髓瘤骨病的临床转化潜力。
本研究锁定了鞘糖脂(glycosphingolipids)是戈谢病向骨髓瘤进展的重要因素,阐明了鞘糖脂能加剧骨髓微环境中癌细胞所导致的“肿瘤恶性循环”, 整合了鞘糖脂代谢通路能调控细胞自噬(autophagy)而改变干细胞分化的分子机制,提出了依利格鲁司 (eliglustat) 通过抑制特定鞘糖脂代谢阻碍关键蛋白TRAF3通过自噬途径降解,验证了eliglustat在骨髓瘤和意义未明的单克隆丙种球蛋白病等疾病的临床前模型中具有显著疗效,揭示了骨髓瘤骨病转化治疗新策略;为今后治疗癌症骨转移提供了新的临床治疗思路。

多发性骨髓瘤(Multiple Myeloma)是一种无法治愈的浆细胞恶性肿瘤,患者经常因“肿瘤恶性循环”(vicious cycle)机制而发生溶骨性骨病变, 严重增加病痛并影响生活质量。依利格鲁司 (Eliglustat, Cerdelga)是一种美国FDA于近年批准的葡糖神经酰胺合成酶抑制剂,能特异性地阻止鞘糖脂和神经节苷脂的合成,目前用以治疗成人 1 型戈谢病(Gaucher Disease)——一种影响糖脂循环的遗传性代谢病。
鞘糖脂是细胞膜的正常成分,以不同的比例和组合表达。戈谢病患者患有骨质疏松症/骨质减少症,减少与该疾病相关的鞘糖脂或许能减轻骨质流失。有趣的是,戈谢病患者罹患骨髓瘤和意义未明的单克隆丙种球蛋白病(Monoclonal gammopathy of undetermined significance)等疾病的风险增加 6-50 倍。值得注意的是,戈谢病病人在使用eliglustat后向骨髓瘤发展明显趋缓或停滞,且骨破坏显著降低。然而,骨破坏症状的减轻是否由戈谢病的治疗所导致,还是eliglustat 能直接调控骨髓瘤的骨骼代谢仍有待确定。由此,作者提出eliglustat 或许有转化应用于治疗骨髓瘤骨病的可能性。
由于骨髓瘤骨病主要是由具有骨溶解性的破骨细胞(osteoclast)数量增加和过度激活引起的,因此抑制破骨细胞活动的化合物具有关键的临床治疗意义。本研究从转化医学角度出发,揭示eliglustat能在生理和多种疾病包括骨髓瘤以及意义未明的单克隆丙种球蛋白病的状态下有效抑制造血干细胞(Hematopoietic stem cell)来源的破骨细胞形成并增加骨量(bone volume)。进一步研究发现,eliglustat可以与现行临床使用的唑来膦酸(一种治疗骨髓瘤骨病的双膦酸盐)联合使用产生累加效应。这一发现有助于在临床上减少唑来膦酸的大剂量使用从而减轻该药导致的颌骨坏死等副作用,因而开展这项研究具有重要临床转化意义。
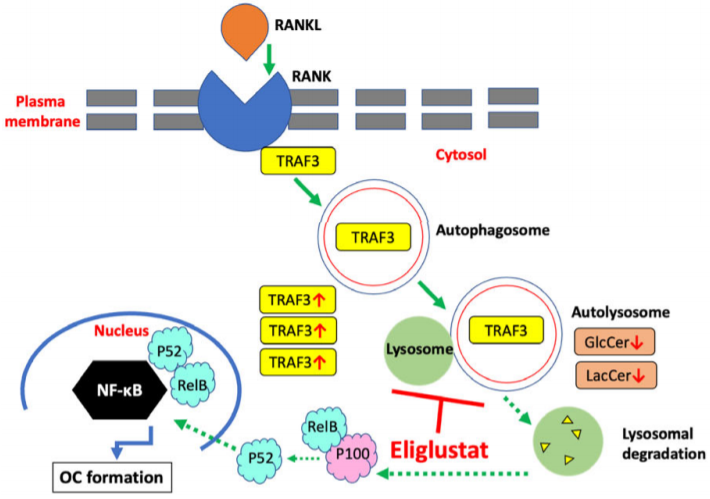
骨髓瘤细胞分泌因子,包括核因子 kappa-B 配体 (RANKL) 的受体激活剂,可增强破骨细胞的形成。NF-κB 通路受肿瘤坏死因子受体相关因子 (TRAF) 的调节。特别的,RANKL 能激发TRAF6 诱导的破骨细胞生成 ,而TRAF3 是抑制性的 。RANKL 通过经典和非经典 NF-κB 通路触发破骨细胞形成。在经典 NF-κB 通路中,衔接蛋白 TRAF6 的激活导致蛋白酶体介导的 IκBα 降解,然后是 p65 和 p50 的核转位;在非经典 NF-κB 通路中,衔接蛋白 TRAF3 在自噬体/溶酶体依赖性机制中降解 ,从而诱导 p52 和 RelB的核转位。作者证明了eliglustat 能使TRAF3 积累,表明 eliglustat 阻断了由 RANK 激活引起的 TRAF3 溶酶体降解,但却不调节TRAF6 介导的经典 NF-κB通路。为了证实 TRAF3 在体内介导 eliglustat 对细胞的抑制作用,作者使用来自LysM-Cre+、TRAF3fl/fl 小鼠的骨髓供体细胞生成了骨髓嵌合子小鼠,这些小鼠具有骨髓特异性 traf3 缺失。经过一些列实验,作者进一步证实 eliglustat是以 TRAF3 依赖性方式抑制破骨细胞形成。
自噬通过降解和回收细胞废物(包括蛋白质聚集体和受损细胞器)来维持细胞稳态 。RANKL 诱导的破骨细胞形成中 TRAF3 的降解由自噬机制介导 。因此,作者通过测定LC3-II和P62的蛋白含量,并应用GFP-LC3报告系统和串联标记的 RFP-GFP-LC3 报告系统确定eliglustat 为新型自噬抑制剂,并可能是在自噬溶酶体的步骤中发挥作用。此外,透射电子显微镜也显示 eliglustat 积累了单膜自噬溶酶体而不是双膜自噬体。
文章模式图(图源自Nature Communications )
为了进一步研究 eliglustat 处理后的 TRAF3 分布,作者使用溶酶体分离试剂盒并证明 eliglustat 显着增加了LAMP1+ 溶酶体富集层中 TRAF3 的数量。此外,观察到 eliglustat 显着增加了溶酶体标记物 LAMP2 的面积,表明溶酶体和/或自溶酶体增加。为了更准确地研究 eliglustat 对 TRAF3 转运和积累到细胞中溶酶体的影响,通过共聚焦显微镜在前破骨细胞中进行 TRAF3 亚细胞定位,作者观察到TRAF3 在 eliglustat处理后与溶酶体共定位 。总之,这些发现支持 eliglustat 作为自噬抑制剂的作用,其能通过抑制自噬溶酶体降解来阻断自噬通量。
自噬对破骨细胞生成至关重要,神经节苷脂等参与自噬体生物合成 。接下来作者假设 eliglustat 可防止神经酰胺转化为自噬所需的鞘糖脂。为了评估细胞膜上的整体脂质变化,作者通过光谱成像评估了 eliglustat 处理的细胞,发现质膜的流动性更高,这表明包括自噬体膜或溶酶体膜在内的内膜整体流动性可能以类似的方式受到影响。为了分析特定的鞘糖脂组成,作者应用了LTQ-ESI-MS 并证明eliglustat 处理的细胞显示出葡萄糖神经酰胺 (GlcCer) 、乳糖神经酰胺 (LacCer)、总体鞘糖脂均显着减少。为了研究外源性 GlcCer 或 LacCer 是否足以挽救 eliglustat 诱导的自噬缺陷,作者将LacCer(C16 和 C24)和 GlcCer(C16)作为补充外源性的LacCer 和 GlcCer,结果显示它们能逆转由eliglustat所导致的LC3II和TRAF3蛋白累积,并能挽救细胞的正常分化。
总的来说,TRAF3 的自噬降解是破骨细胞分化的关键步骤,作者们发现eliglustat为新型自噬抑制剂,并通过改变细胞GlcCer和LacCer的组成来阻断破骨细胞中的TRAF3 蛋白自噬降解,从而减少破骨细胞生成的机制。最后,作者把以上发现在骨髓瘤患者骨髓样本中进行了验证,取得了相同结果。结合之前的临床前模型的疾病验证,充分展现了这项工作具有重要临床转化价值。
文章第一作者、英国牛津大学医学院Translational Medicine Fellow冷厚甫医学博士表示:自六年前总结临床病例时发现戈谢病病人在使用eliglustat后向骨髓瘤进展明显趋缓的表型后,我们立足疾病、解码机理;面向临床、制定方案。“问题从病人中来,方案回病人中去”,有幸能把心无旁骛、潜心钻研所取得的丰盈收获在今朝转化成为极具潜力、缓解病痛的治疗策略,倍感振奋。
尤为令人感动的是,该项研究在疫情期间得到了上海交通大学医学院病理生理学系主任、细胞分化与凋亡教育部重点实验室主任、上海交通大学光启讲席教授钟清研究员;上海交通大学医学院附属瑞金医院血液内科行政副主任、多发性骨髓瘤亚专科负责人、主任医师糜坚青教授;苏州大学生物医学研究院李云森教授和王艳萍教授;复旦大学人类表型组研究院执行院长田梅教授等的精心指导和倾力支持。
参考消息:
https://www.nature.com/articles/s41467-022-35358-3


