AM(IF=32)| 武汉大学孙志军/张军杰/西南大学许志刚开发了一种联合治疗策略,促进细胞焦亡引发抗肿瘤免疫反应
时间:2022-12-26 12:00:01 热度:37.1℃ 作者:网络
免疫检查点阻断(ICB)疗法对恶性肿瘤治疗成效显著。然而,肿瘤免疫原性不足和免疫抑制肿瘤微环境被认为是ICB临床应用的两个主要障碍。
2022年12月22日,武汉大学孙志军、张军杰和西南大学许志刚共同通讯在Advanced Materials 在线发表题为“Dual-Responsive STAT3 Inhibitor Nanoprodrug Combined with Oncolytic Virus Elicits Synergistic Antitumor Immune Responses by Igniting Pyroptosis”的研究论文,该研究报告了一种联合治疗策略,将肿瘤微环境活性氧(ROS)/pH双响应的信号转导因子和转录激活因子3(STAT3)抑制剂纳米前药纳米颗粒(MPNPs)与溶瘤单纯疱疹病毒1(HSV-1)的病毒疗法相结合,协同促进细胞焦亡以增强免疫治疗。
MPNPs表现出一定程度的肿瘤积累,降低肿瘤细胞干性,增强了抗肿瘤免疫应答。此外,同时应用溶瘤病毒赋予MPNPs更高的肿瘤渗透能力和gasdermin E介导的显著焦亡,从而重塑肿瘤微环境,将“冷”肿瘤转化为“热”肿瘤。这种“免疫燃烧”策略成功地激活了强T细胞依赖性抗肿瘤反应,增强了临床前“冷”小鼠三阴性乳腺癌和同系口腔癌模型中对局部复发和肺转移的ICB作用。总得来说,该工作为溶瘤病毒与纳米药物的癌症免疫治疗相结合带来了新机遇。

以免疫检查点阻断(ICB)疗法为代表的癌症免疫治疗通过调动宿主抗肿瘤免疫来发挥作用,为恶性肿瘤治疗带来了彻底的变革。然而,免疫原性较差、T细胞衰竭、肿瘤干细胞和免疫抑制肿瘤微环境(TME)等导致ICB疗法临床应用受阻。因此,开发诱导更强抗肿瘤免疫反应的新方法意义重大,如促进细胞毒性T淋巴细胞浸润和逆转免疫抑制TME,同时降低全身毒性。细胞焦亡由gasdermin蛋白家族成员介导,其在被激活后能够靶向细胞膜并诱导穿孔,继而破坏细胞内渗透压,导致细胞肿胀、质膜起泡和细胞焦亡过程中肿瘤相关抗原的释放会引发强烈的抗原特异性免疫反应。
细胞焦亡诱导的强免疫刺激在临床前肿瘤模型中产生了高效、持久的抗肿瘤反应,呼应了细胞焦亡“星星之火,可以燎原”的比喻。然而,水溶性差、肿瘤穿透性不足和药物生物利用度低阻碍了小分子诱导细胞焦亡的实现。此外,全身给药也会诱导正常细胞的焦亡,导致强烈的全身毒性。纳米药物结合溶瘤病毒的出现扭转了这一局面。
Talimogene laherparepvec是一种基于溶瘤病毒(OV)1型单纯疱疹病毒(HSV-1)的病变部位递送的溶瘤免疫治疗药物,用于无法切除的恶性黑色素瘤的临床治疗。HSV-1具有如下优势:(1)HSV-1被认为是一种潜在的广谱抗癌药物;(2)通过相关的基因改造技术可以有效地改良HSV-1的特性;(3)一旦观察到不可接受的毒性,HSV-1可以用抗疱疹药物有效灭活。与传统的抗肿瘤疗法相比,OVs在肿瘤细胞中有效复制,诱导肿瘤细胞溶解并减少肿瘤负荷。随后释放的肿瘤相关抗原和危险信号分子进一步刺激适应性抗肿瘤免疫。OVs可以刺激细胞焦亡以将抗肿瘤免疫功效最大化。此外,通过局部肿瘤内注射施用OVs有效地消除了传统药物对正常组织的脱靶效应,同时突破传统药物难以穿透的致密肿瘤屏障。虽然OVs治疗引发高效的抗肿瘤免疫,但同样具有由乳酸积累和髓源性抑制细胞浸润建立的免疫抑制TME以及无法根除转移肿瘤等缺陷,是病毒免疫治疗的重大障碍。因此,需要更合适的治疗策略来解决上述问题。
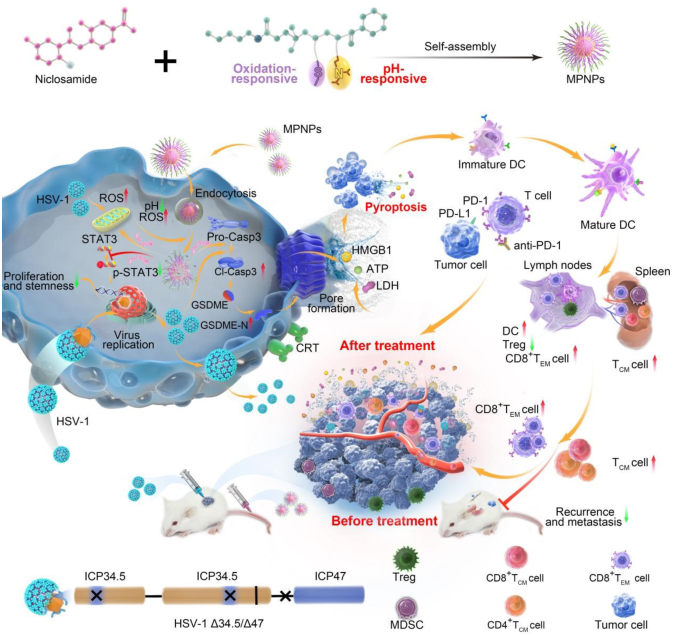
双重响应STAT3抑制剂纳米前药与溶瘤病毒联合引发抗肿瘤免疫反应(摘自Advanced Materials )
该研究提出联合应用纳米药物和OVs加强肿瘤免疫治疗。基于肿瘤相关的生化特性,通过可逆加成-断裂链转移(RAFT)聚合构建了活性氧(ROS)/pH双重响应纳米载体mPEG-b-P(MTE-co-PDA)。信号转导因子和转录激活因子3 (STAT3)在肿瘤细胞和骨髓间充质干细胞中过表达,极大地促进了肿瘤干细胞的维持,并促进了肿瘤的转移前生态位、免疫逃避和骨髓间充质干细胞的扩增和募集。FDA批准的药物氯硝柳胺(NI)已被确定为STAT3抑制剂,可抑制Tyr705处STAT3磷酸化及其转录活性。NI还介导线粒体膜电位的快速丧失、氧化磷酸化的解偶联和线粒体超氧化物的产生,从而诱导细胞周期停滞、生长抑制和凋亡。此外,NI对癌症干细胞的抑制作用进一步证明了其作为癌症治疗的潜力。为解除NI低生物利用度和宽范围血清浓度的限制,该研究通过自组装方法将NI稳定地装载到预先设计的前药纳米颗粒(MPNPs)中。
溶酶体是参与内吞途径的末端细胞器,存在几种靶特异性水解酶,在高酸性pH(4.5-5.0)下被激活。该研究使用缺乏ICP34.5和ICP47的溶瘤HSV-1(HSV-1Δ34.5/Δ47, oHSV),其具有更低的神经毒性和更高的抗原呈递活性。OVs感染引发内质网(ER)应激,产生活性氧(ROS)。与单反应前体药物相比,细胞内ROS积累结合溶酶体特性有助于MPNPs在ROS/pH双重刺激下的有效释放。此外,MPNPs的应用促进了T细胞的浸润,减少了髓系抑制性细胞和调节性 T 细胞的募集和活化,有效地杀死了逃避OVs单一疗法的肿瘤干细胞和免疫抑制细胞。值得注意的是,MPNPs的使用最大限度地减少了全身毒性,因传统非靶向口服NI产生的不良脱靶反应大大减少。此外,oHSV和MPNPs的组合诱导大量gasdermin E依赖性细胞焦亡,并将免疫“冷”肿瘤转化为免疫“热”肿瘤。上述“免疫燃烧”策略成功激活了强T细胞依赖性抗肿瘤反应,以增强ICB对局部复发和肺转移的治疗作用。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202209379


