Mol Cell :北京大学伊成器团队开发新型RNA编辑技术
时间:2022-12-26 21:00:38 热度:37.1℃ 作者:网络
无义突变占疾病相关突变的>20%,导致过早翻译终止。在停止密码子中用假尿嘧啶替代尿嘧啶抑制翻译终止,这可能被用来介导过早终止密码子(PTCs)的读取。
2022年12月14日,北京大学伊成器团队在Molecular Cell(IF=19)在线发表题为“CRISPR-free, programmable RNA pseudouridylation to suppress premature termination codons”的研究论文,该研究表明无CRISPR的可编程RNA假尿嘧啶化,可抑制过早终止密码子。该研究提出了一个可编程的RNA碱基编辑器RESTART,以恢复PTC诱导的哺乳动物细胞翻译终止。RESTART利用gsnoRNA和内源性H/ACA box snoRNP机制来实现精确的假尿嘧啶化。该研究还鉴定和优化了gsnoRNA支架,以提高编辑效率。
出乎意料的是,该研究发现假尿嘧啶合酶DKC1的一个小亚型,缺乏C端核定位信号,极大地提高了PTC通读效率。虽然RESTART诱导限制性脱靶假尿嘧啶化,但它们没有改变编码信息和脱靶的表达水平。最后,RESTART在原代细胞中实现了稳健的的假尿嘧啶化,并在疾病相关环境中实现了功能性PTC通读。总的来说,RESTART是一个很有前途的用于研究和治疗得RNA编辑工具。

无义突变由单碱基对替换产生,并在mRNA编码区引入过早终止密码子(PTCs),导致产生截断且通常无功能的蛋白质,通过无义介导的mRNA衰变(NMD)降解含有PTC的mRNA,最终导致遗传疾病。因此,应尽一切努力开发治疗策略来解决PTC介导的疾病。
目前有几种RNA靶向治疗无义突变引起的遗传疾病的方法。剪接开关反义寡核苷酸可用于剪接框架中含有PTC的外显子,但可编码无功能或部分功能的蛋白质。小分子已被证实可通过口服给药诱导PTC通读;然而,它们缺乏特异性,并在长期使用后显示毒性。工程tRNAs已被用于读取PTCs,但它们也缺乏序列特异性。
利用ADAR和APOBEC蛋白的脱氨活性,已经开发了几种A-to-I(肌苷)和/或C-to-U RNA碱基编辑器。如在REPAIR13中,dCas13b被融合到ADAR2的催化结构域,实现A到G的置换;ADAR2的定向进化也赋予了它在RESCUE中同时具有C-to-U编辑活动的能力。RESCUE和LEAPER利用短gRNA募集内源性ADAR蛋白进行RNA编辑。序列特异性的A-to-I编辑也已在人类疾病的小鼠模型中实现。然而,这些RNA碱基编辑器存在潜在的近端和远端脱靶编辑问题。因此,通过脱靶编辑可以有效地编辑RNA碱基,并且影响最小的特定和安全的策略是非常需要的。
机理模式图(图源自Molecular Cell )
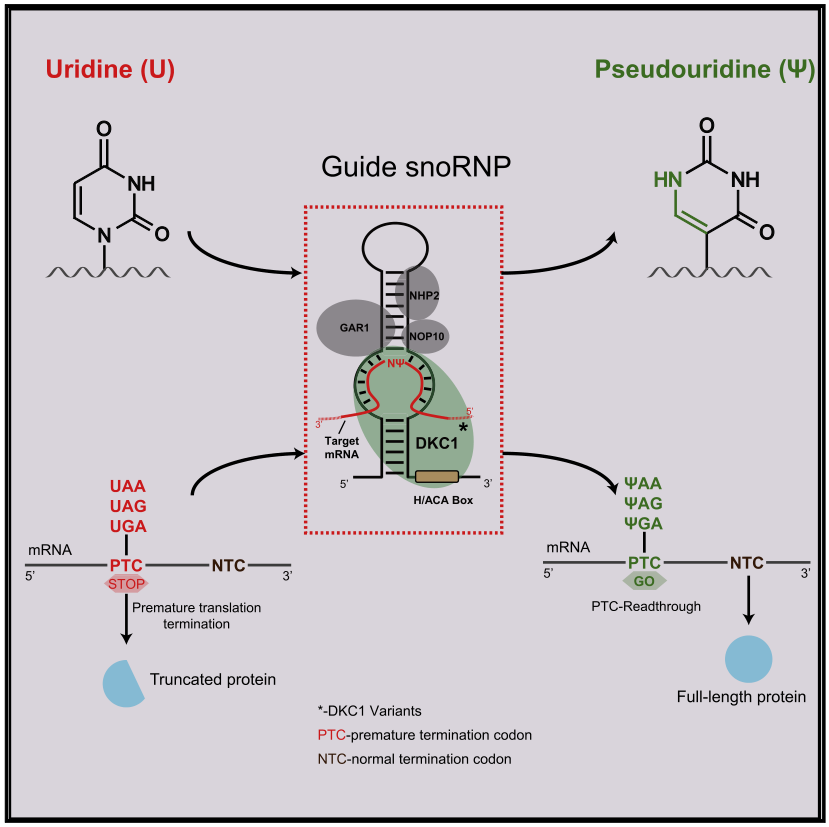
假尿嘧啶(Ψ)是RNA中含量最多的修饰,具有与尿苷(U)相似的碱基配对性质,可通过独立合成酶或RNA引导的酶复合物催化。在复合物中,H/ACA snoRNA通过与靶RNA的碱基配对作为RNA向导,并与四个进化上保守的核心蛋白DKC1、NHP2、NOP10和GAR1结合。其中DKC1是具有催化活性的Ψ合成酶。尽管Ψ只会对意义密码子的编码特性造成微不足道的改变,但已有报告说,在所有三个终止密码子中,用Ψ替换U可以意外地抑制翻译终止。
在酵母中,人工设计的snoRNA已被用于引导PTC位点的假尿嘧啶化,修饰效率为5% ;然而,与酵母和古生菌的广泛研究相比,人们对哺乳动物中H/ACA box snoRNP的靶向性和活性的了解有限。此外,与RNA序列或结构促进的停止密码子通读不同,Ψ介导的停止密码子读通与序列上下文无关。因此,在PTCs中,snoRNA引导的假尿嘧啶化为基于RNA的治疗无意义突变诱导的人类疾病提供了一个有希望的机会。
在本研究中,作者开发了对特定转录本的RNA编辑,用于假尿嘧啶介导的PTC通读(RESTART),以在哺乳动物细胞中实现高效和精确的Ψ修饰。RESTART利用H/ACAbox snoRNP机制进行RNA靶向和编辑,因此无需CRISPR。ZZ1报告了两个系统,RESTARTv1和RESTARTv2;前者只涉及一种设计的gsnoRNA,后者包含一种额外的自然发生的但较小的DKC1亚型。这两种系统都证明了对疾病相关无义突变的通读的广泛适用性,而不会由于脱靶编辑而导致不必要的后果。
北京大学生命科学学院伊成器教授为该论文的通讯作者,课题组博士后宋靖慧(已出站)、博士生董利婷、孙含笑、罗楠、博士后黄强为共同第一作者。该工作得到农业部项目、科技部重点研发计划、国家自然科学基金等项目资助以及北大-清华生命联合中心、蛋白质与植物基因研究国家重点实验室等的支持。北京大学高性能计算平台,生命科学学院仪器中心及凤凰工程等多个平台对本项目提供了重要的技术支撑。
原文链接:
https://doi.org/10.1016/j.molcel.2022.11.011


