《自然》子刊: 循环肿瘤细胞用于癌症早期检测
时间:2023-07-30 13:20:58 热度:37.1℃ 作者:网络
近日,一组来自伦敦玛丽女王大学和汉堡大学医学中心的研究团队在顶刊Nature Reviews Clinical Oncology上发表了一篇题为“Circulating tumour cells for early detection of clinically relevant cancer”的综述文章。文章中,作者介绍了癌症细胞早期血源性播散的临床意义,讨论了CTC促进临床相关癌症早期检测的潜力,可能改进CTC捕获的技术进步,以及促进CTC用于早期癌症检测的未来方向。

图片来源:Nature Reviews Clinical Oncology
一、癌症转移与癌细胞的早期扩散
继发部位的转移性定植开始于原发肿瘤细胞局部侵入其周围微环境,随后越过内皮屏障迁移,进入血液或淋巴系统。进入血液循环后,CTC被血液携带到身体的其他部位,在那里它们可以外渗、增殖并形成转移性病变(下图)。
CTC检测阳性可能表明存在一种具有高转移性扩散倾向的侵袭性癌症,因此需要增加或加强辅助全身治疗,以根除任何隐匿的微转移。相反,如果检测方法具有足够的灵敏度,CTCs的缺失可能为某些疾病环境中的治疗降级提供机会。
癌细胞的扩散发生得早,但通常发现得晚,通常在临床癌症诊断前几年,就已经在血液样本中检测到CTC了。DTC(播散性肿瘤细胞)的休眠可能是在癌细胞扩散后很长时间才发现转移的主要原因。原发肿瘤切除多年后发现的DTC一定是在明显成功的手术治疗之前释放到血液循环中,在晚期形成隐匿的微转移。目前,缺乏测量局部癌细胞侵袭的生物标志物; 然而,一旦侵入进入循环系统,CTC可能为监测微转移和评估最终明显转移的风险提供了丰富的信息。
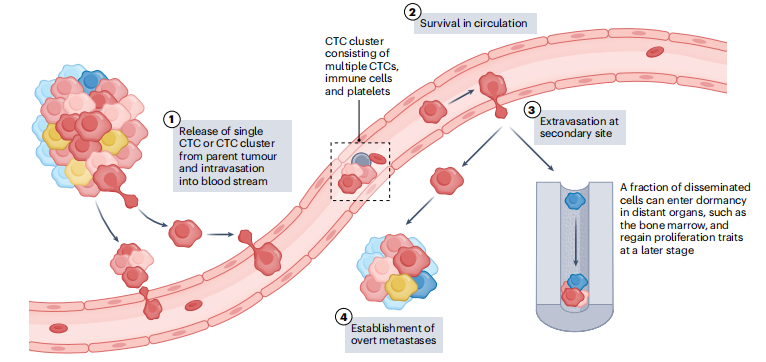
CTC形成转移的关键步骤。
图片来源:Nature Reviews Clinical Oncology
二、循环肿瘤细胞(CTC)
基于上皮细胞粘附分子(anti-EpCAM)抗体的CTC捕获技术在CTC作为生物标志物的初步临床应用中发挥了重要作用。然而,在分离CTC时考虑EMT现象是很重要的,因为EpCAM的表达在这一转变期间通常会减少。因此,不依赖表位的分离策略可能更有效地分离所有亚型的CTC。例如,基于细胞大小或密度的CTC分离方法,包括ISET、FaCTChecker和Oncoquick,Parsortix平台。
CTC簇被定义为两个或两个以上的CTC群,可以由单独的CTC(同型)组成,也可以包括各种基质细胞和/或血小板和免疫细胞(异型)。与单个CTC相比,CTC簇具有更大的转移能力,97%的转移来自CTC簇。机制可能涉及CTC聚集可能促进癌细胞增殖,可保护CTC免受流体动力剪切应力和免疫攻击,以及较大的尺寸增加了外渗的可能性。
CTC分析,包括遗传学和表观遗传学以及蛋白质水平,有助于理解涉及转移形成的许多过程,可提供关于肿瘤突变负担和患者突变谱异质性的额外信息。表观遗传图谱可能揭示肿瘤抑制基因沉默机制。CTC量化可能指示侵袭性癌症患者的肿瘤负荷和肿瘤的侵袭性。有趣的是,CTC可以穿过血脑屏障,因此可以在原发性脑肿瘤患者中检测到。大多数关于CTC的研究都集中在其对晚期癌症患者的预后能力上,但对CTC在早期癌症检测领域的应用的探索正在增加(下图)。
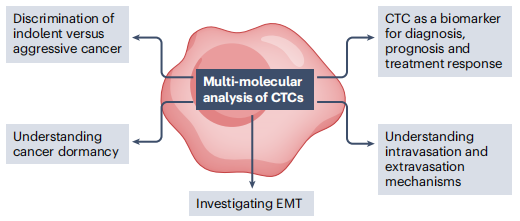
表征CTC以提高对转移的了解并改进癌症的管理。
图片来源:Nature Reviews Clinical Oncology
三、CTCs在癌症早期检测中的应用
癌细胞的局部侵袭和内渗可以在几小时内迅速发生,因此CTC检测能够先于临床癌症诊断。许多临床研究已经利用已知癌症诊断患者的血液样本评估了CTC在癌症检测中的潜力。在早期乳腺癌、非转移性结直肠癌患者、非转移性前列腺癌、I期非小细胞肺癌患者中,均可检测到CTC。一项对18项前瞻性研究的荟萃分析发现,CTC阳性是预测早期非小细胞肺癌患者不利总生存期的一个有希望的生物标志物,强调了CTC预测侵袭性癌症的潜力,从而可能指导新治疗策略的发展。此外,在一项预测98例疑似前列腺癌患者活检诊断的前瞻性研究中,使用Parsortix分离系统CTC检出与临床显著性癌症密切相关。CTC阳性评分结合血清PSA水平预测临床显著前列腺癌的活检诊断,AUC为0.869,联用一个由12个基因组成的panel的CTC转录组分析增加了预测准确性,AUC为0.927。在其他几项使用ISET技术检测CTC的研究中,尽管敏感性不高,CTC检出的个体中相当数量在随访中发现早期癌症的证据。
总之,这些研究表明CTCs有潜力用于临床相关癌症的早期发现和/或诊断,尽管还需要进一步的调查和技术改进。目前,许多临床试验正在研究CTC在早期癌症诊断中的应用,包括前列腺癌的PROLIPSY试验(NCT04556916)和乳腺癌(NCT03511859)、NSCLC (NCT02380196)、CRC (NCT05127096)和胰腺癌(PANCAID)的类似试验。如果这些临床试验产生积极的结果,在早期癌症检测中使用CTC可能成为现实。
四、未来的发展方向
最大化CTC检出
目前,限制CTCs用于早期癌症检测的主要问题与血液样本中CTC稀缺性有关。因为依赖于表位的分离策略很难捕获所有CTC,研究重点是开发和应用基于细胞大小、密度或形态的分离方法来提高CTC产量。多种方法的组合可能更有效地收集CTCs,增加CTC的纯度,但也可能伴随着细胞损失的增加。
继续验证CTC检测技术将是最终获得此类系统用于早期癌症检测的批准的关键。这一过程可能涉及实验室间环形试验技术的标准化,以评估可重复性和数据可比性,这可能有助于提出基于CTC研究的最低要求建议。这些建议将包括有关分析前和质量控制过程的要求,分析前的因素,如抽血的时间和解剖部位、针头的大小和采血管的类型、环境温度和储存条件,都应仔细考虑并在CTC分析方案中概述。
优化CTC样本采集
在最佳的解剖位置和时间,增加通过血液取样分离CTC 的绝对数量,甚至增加样本量,可能是关键。除了血液,脱落癌细胞也可以在其他体液中检测到,如淋巴液或脑脊液,但它们的分离需要更具侵入性的采样程序。已经探索了使用不同的血管进行样本采集,以增加收集到CTC的机会。例如,非小细胞肺癌患者的肺静脉、胰腺癌患者的门静脉或CRC患者的肠系膜静脉。采血时间也是重要考虑因素。数据表明78.3%的CTC在夜间休息阶段释放。
目前用于CTC分析的常规血样本量≤7.5 ml,增加血样本量将会改善CTC在早期癌症检测中的效用。一种名为CellCollector的设备由抗epcam抗体包被的医用Seldinger导丝组成,插入肘静脉后,用于从大量血液中捕获CTC。在50名肺癌患者的185个应用(治疗前后)中检测到108个(58%)CTC。
开发能够长期监测病情的可穿戴设备是临床诊断领域未来研究的一个重要方向。如果可以使用佩戴在手或手臂上的成像设备检测到通过静脉的CTC,那么不仅可以在更大的血容量中识别CTC,还可以方便地监测CTC释放的时间差异。可穿戴传感器设备的开发将需要优化可注射探针和耦合检测系统。考虑到目前技术发展的阶段和速度,在体内检测CTC进行早期癌症检测可能很快就会成为可能。
CTC的分子表征
识别不同的CTCs亚群,例如,区分休眠和增殖CTCs以及与不同免疫细胞相关的CTCs,可能在临床应用。添加免疫特异性标记,可确定哪些类型的免疫细胞与CTC相关,以及这些相互作用对特定细胞途径的影响,从而影响转移潜力。需要开发新的技术,如多重免疫荧光分析、质谱流式细胞技术、成像质谱流式细胞术可以提供在CTC上测量多种分子标记的潜力,因此,可能能够在早期检测环境中识别出新的侵袭性癌症生物标记。单细胞分析技术将需要进一步发展,以降低其成本和复杂性,以促进其临床应用。此外,CTC的体外培养将提供额外分子和表型分析的机会,并可以提供个体患者中癌细胞治疗脆弱性的信息。这种分子研究也可能有助于识别标记物,用于使用传感器设备在体内检测CTC。

促进CTC用于早期癌症检测的未来方向。
图片来源:Nature Reviews Clinical Oncology
将CTC与其他生物标志物联合用于早期癌症检测
通过与其他血液生物标志物(包括蛋白、ctDNA、miRNAs、细胞外囊泡和免疫细胞亚群)的结合,CTC作为早期癌症检测工具的用途可能会进一步得到改善,这些生物标志物与CTC相比各有优缺点。
有研究证明结合CTC和血浆蛋白分析大大提高了测试准确性。血浆ctDNA甲基化谱、miRNA、循环免疫细胞的表型这些生物标志物与CTC检测的结合也会提高检测的灵敏度和特异性。
其他非侵入性技术,如尿液生物标志物测定和癌症成像,已经在临床用于早期癌症检测。CTC和尿液标志物的联合诊断价值尚待研究。放射成像也常用于癌症诊断和基于人群的乳腺癌和肺癌筛查。研究表明,CTC对乳腺癌患者的诊断准确性与各种成像方式(包括乳房x光检查、超声检查和MRI)相似,但特异性更高,敏感性较差,;因此,将这两种技术结合起来可能会提高临床相关癌症的检出率。
CTCs在癌症筛查中的应用
CTC是许多类型癌症的特征,因此,有潜力被用作检测多种癌症类型的生物标志物。未来开发具有足够灵敏度和特异性的CTC检测平台可能提供第一种泛癌症筛查技术(下图)。
在用于普通人群的癌症筛查之前,CTC可能首先应用于更有针对性的、风险分层的筛查,这些筛查基于遗传风险因素、生活方式因素和/或临床和家族史,被认为具有发展特定恶性肿瘤高风险的个体。CTC阳性的个体可以进行进一步的调查,包括器官靶向成像(如乳房x光检查),癌症特异性血液生物标志物检测(血清蛋白检测,ctDNA和/或miRNA分析)或CTC的进一步分子分析以定位肿瘤,如肿瘤特异性抗原检测,DNA甲基化分析或拷贝数畸变分析。在将此类检测结果与患者特征、风险因素和可疑症状的信息相结合后,根据活检取样的可行性和非侵入性生物标志物的准确性,可以对可疑肿瘤部位进行活检取样或不进行活检取样,从而做出诊断。CTC检测结果为阴性的个体可被视为无癌或患癌风险低,随后定期重新筛查CTC的存在,除非他们的症状有任何变化。
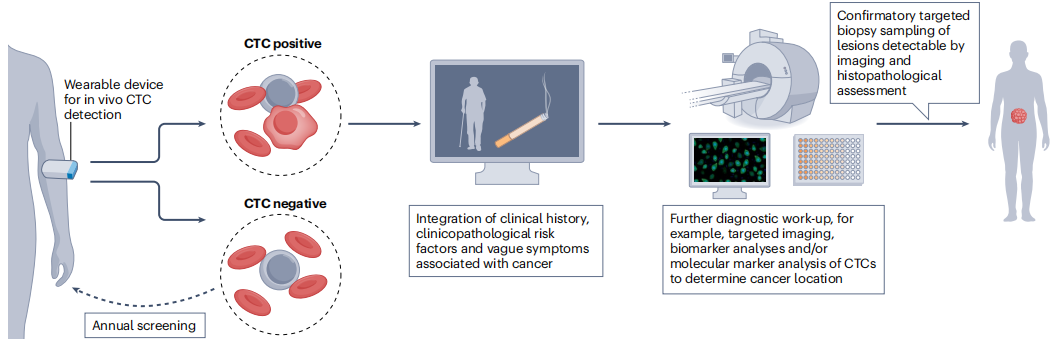
对CTC在早期癌症检测中的未来作用的展望。
图片来源:Nature Reviews Clinical Oncology
结论
在一个快速发展的领域,在了解早期癌症传播和转移的过程方面已经取得了巨大的进展。微转移可以在肿瘤发生早期形成,越来越多的证据表明,CTC可以在侵袭性癌症发展的早期阶段被检测到。因此,CTC在早期癌症检测中具有很大的潜力,可以识别临床相关肿瘤,同时避免对惰性疾病的过度诊断。目前的挑战在于开发技术来可靠地收集和分析这些稀缺但具有隐含意义的细胞。随着技术的进一步发展,特别是能够通过无创或微创的大量血液采样,在方便的时间进行高灵敏度的CTC检测,我们期望CTC分析将成功地应用于改变早期癌症检测的范式,从而大大改善癌症患者的预后。


