2022 ESMO Asia:肺癌,靶向免疫治疗最新进展汇总
时间:2023-01-03 15:04:07 热度:37.1℃ 作者:网络
一、非小细胞肺癌-靶向治疗部分
EGFR突变
NCT03861156研究
NCT03861156研究:贝福替尼(D-0316)是一种新型的高选择性口服第三代EGFR-TKI,在一项关键的II期研究(NCT03861156)中显示出令人鼓舞的抗肿瘤活性,该研究纳入了EGFR T790M突变阳性患者。这项开放标签III期随机临床试验旨在比较贝福替尼和埃克替尼作为先前未经治疗的、携带EGFR敏感突变(Del19或L858R)的局部晚期或转移性NSCLC患者一线治疗的疗效和安全性。符合入组标准的IIIB/IIIC/IV期伴EGFR Del19或L858R突变的NSCLC患者按1:1随机分为两组,分别接受贝福替尼(75-100 mg,1次/天)或埃克替尼(125 mg,3次/天)作为一线治疗。主要研究终点为独立评审中心(IRC)评估的无进展生存期(PFS)。次要终点包括客观有效率(ORR)、疾病控制率(DCR)、有效持续时间(DOR)、IRC评估的总生存期(OS)和安全性。

陆舜教授口头报告
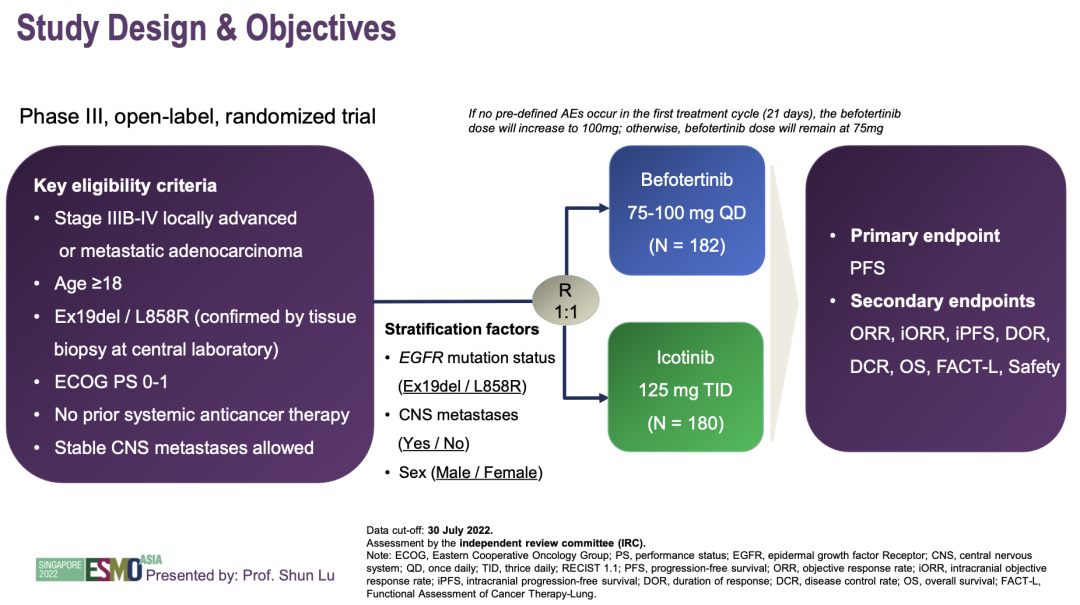
研究设计
研究结果:2019年12月24日至2020年12月28日,362例患者被随机分为两组,分别接受贝福替尼(182例)和埃克替尼(180例)治疗。根据IRC评估的中位随访时间20.6月,贝福替尼组的中位PFS为22.1月,埃克替尼组为13.8个月(HR 0.49[95% CI 0.36-0.68];p<0.0001)。贝福替尼和埃克替尼组的ORR分别为75.8%和78.3%,DCR分别为94.5%和98.3%。埃克替尼组的中位DOR为12.4个月,而贝福替尼组DOR尚未达到。在两个治疗组中,OS数据都不成熟。使用贝福替尼的中位治疗时间为16.4个月,使用埃克替尼的中位治疗时间为11.1个月。贝福替尼组86例(47.3%)和埃克替尼组54例(30.0%)发生≥3级治疗相关不良反应(TEAEs)。贝福替尼与埃克替尼组分别有2例(1.1%)和1例(0.6%)发生药物相关患者死亡。

两组PFS曲线
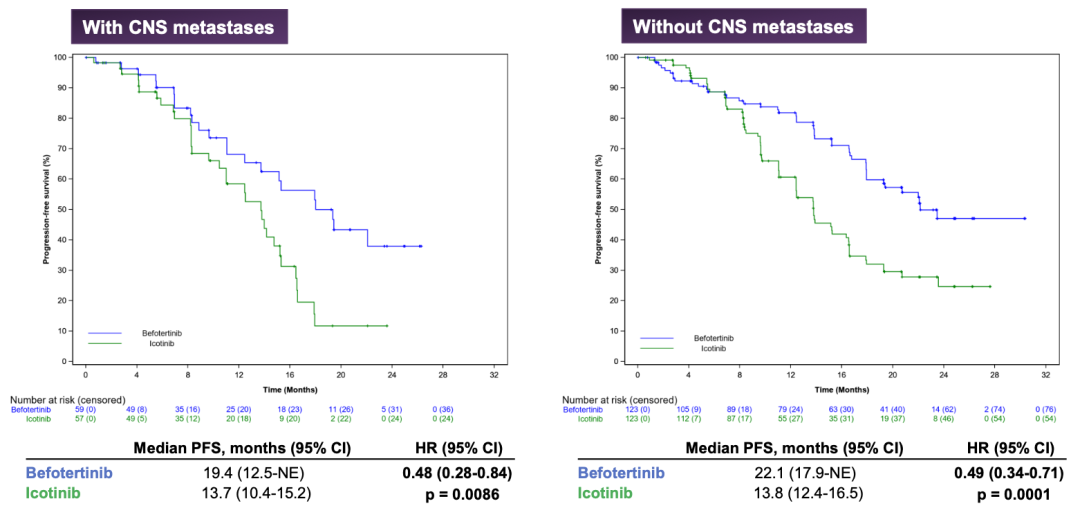
有/无CNS转移患者数据
小结:与埃克替尼相比,贝福替尼在一线治疗EGFR突变阳性的晚期NSCLC中显示出更好的疗效,且安全性是可接受的。
FL-ALTER研究
FL-ALTER研究:安罗替尼是一种口服多靶点酪氨酸激酶抑制剂,可有效抑制VEGFRs、FGFRs、PDGFRs、c-kit和MET2。今年ESMO AISA大会上,中山大学肿瘤防治中心方文峰教授公布了III期FL-ALTER研究结果,该研究旨在评估安罗替尼或安慰剂联合吉非替尼在初治EGFR 突变转移性 NSCLC 患者中的疗效和安全性。符合条件患者为年龄 18~75岁、EGFR 19外显子缺失或 21外显子L858R点突变的IIIB 或 IV 期 NSCLC患者,ECOG PS为 0 或 1,根据 RECIST v1.1评估有可测量的病灶和足够的器官功能。入组患者按1:1比例随机分配,分别接受口服吉非替尼(250 mg QD)+安罗替尼(G+A 组,12 mg QD,第 1-14 天,每个周期 21 天)或吉非替尼+安慰剂(G+P 组)治疗,直至疾病进展或出现不可接受的毒性。主要终点是由 IRC评估的PFS。次要终点包括OS、ORR、疾病控制率(DCR)、DOR和安全性。基线时、首次评估时和疾病进展(PD)时收集用于 ctDNA 分析的血液样本,并使用 329个基因的panel进行分析。

方文峰教授口头报告

研究设计
研究结果:2019年4月到 2021年 8月期间,共315例患者被分配至 G+A(n=157)或 G+P 组(n=158)。2022 年 7 月 31 日数据截止时,G+A组和G+P组的中位随访时间为17.3个月和18.8个月。与G+P组相比,G+A 组患者由IRC评估的中位PFS 明显更优(14.75个月 vs 11.20个月;HR= 0.64,P = 0.0028)。G+A组和G+P组确认的 ORR分别为76.13%和64.52%。与 G+P相比,G+A组患者的缓解持续时间更长(中位DOR:12.48个月 vs 9.46个月,HR=0.56,P=0.0003)。OS数据仍不成熟。
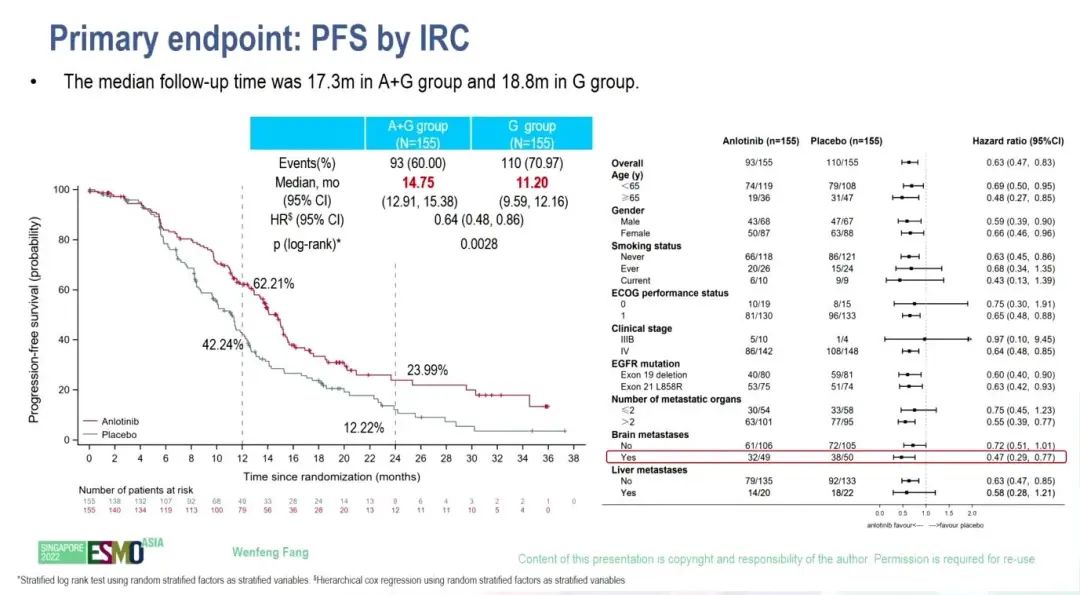
PFS结果

次要终点结果
G+A组和G+P组3级及以上TEAE发生率分别为49.68%和30.97%。最常见的3级及以上 TEAE为高血压 (29.68%,G+A组) 和ALT 升高(12.26%,G+P组)。可评估ctDNA数据的289例患者的初步分析表明,EGFR拷贝数变异患者更能从G+A组中获益(对比G+P组)(11.74个月 vs 6.83个月;HR=0.27)。

安全性分析
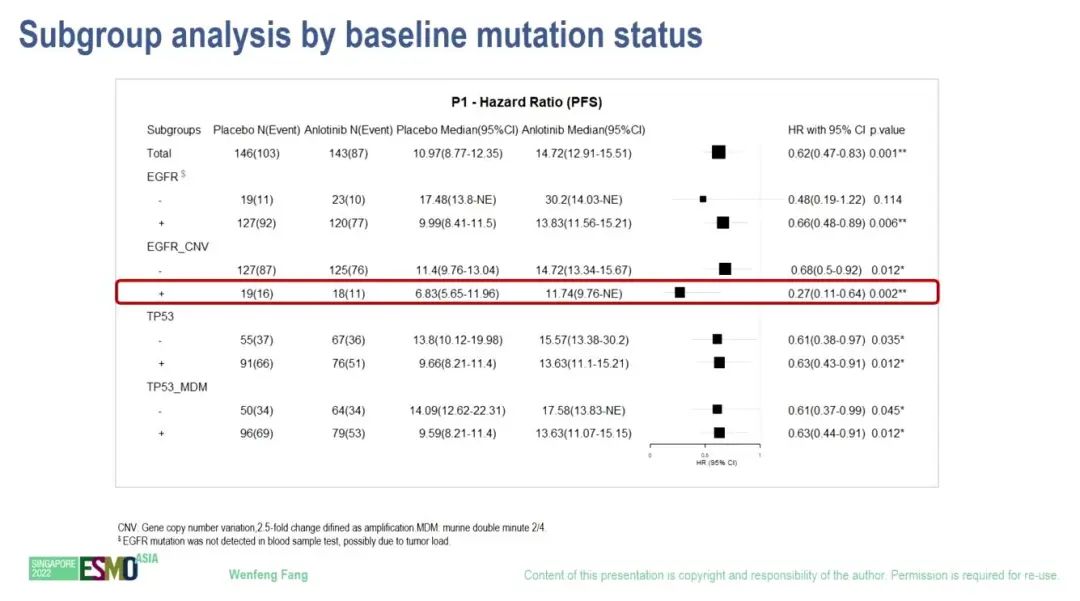
生物标志物分析
小结:FL-ALTER是安罗替尼联合吉非替尼用于EGFR突变晚期NSCLC的首个III期研究。与G+P组相比,G+A组可显著延长初治转移性EGFR突变NSCLC患者的PFS,且安全性可控。安罗替尼联合吉非替尼有望成为用于EGFR突变NSCLC患者新的一线治疗选择。
LASER301研究

Byoung Chul Cho教授
LASER301研究: Lazertinib是一种有效、具有中枢神经系统(CNS)穿透力、选择性的第三代 EGFR-TKI,可同时靶向EGFR T790M和EGFR敏感突变。I/II期LASER201研究显示,lazertinib用于第一/二代EGFR-TKI治疗进展的T790M阳性晚期非小细胞肺癌(NSCLC)患者二线治疗时,客观缓解率(ORR)为55%,中位无进展生存期(PFS)为11.1个月,LASER201一线治疗队列中,lazertinib单药的ORR为70%,中位PFS为24.6个月。符合条件患者年龄≥18 岁EGFR敏感突变晚期 NSCLC,且既往未接受过 EGFR-TKI治疗/全身抗肿瘤治疗。有CNS转移、神经系统稳定患者允许入组,前提为任何明确的治疗方案/类固醇治疗已完成 2周及以上。入组患者按1:1比例随机分配接受每日一次lazertinib (口服,240 mg)或吉非替尼(250 mg,每日一次,口服)治疗,分层因素包括突变状态和种族等。主要终点为研究者根据RECISTv1.1标准评估的PFS。数据截至日期为2022 年 7 月 29 日。

研究设计
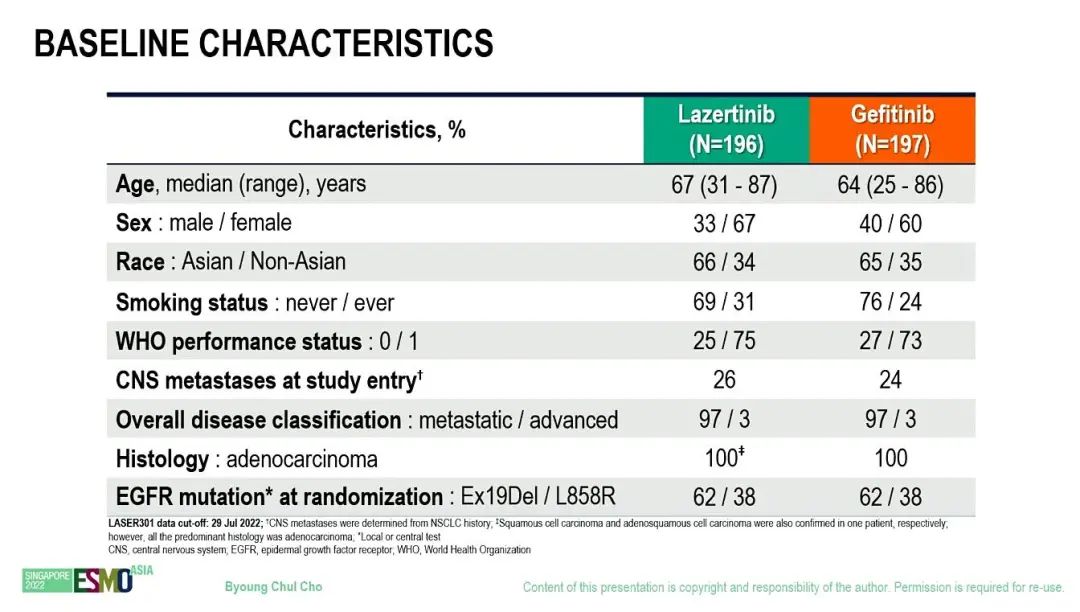
基线特征
研究结果:研究纳入来自13个国家/地区96个中心的393例患者,入组患者被随机分配至lazertinib组(n=196)或吉非替尼组(n=197)。与吉非替尼组相比,lazertinib组患者的中位 PFS 明显更优(20.6 个月 vs 9.7 个月;HR=0.45;95% CI,0.34- 0.58;P<0.001)。亚组分析也显示出一致的生存获益。

PFS更新结果
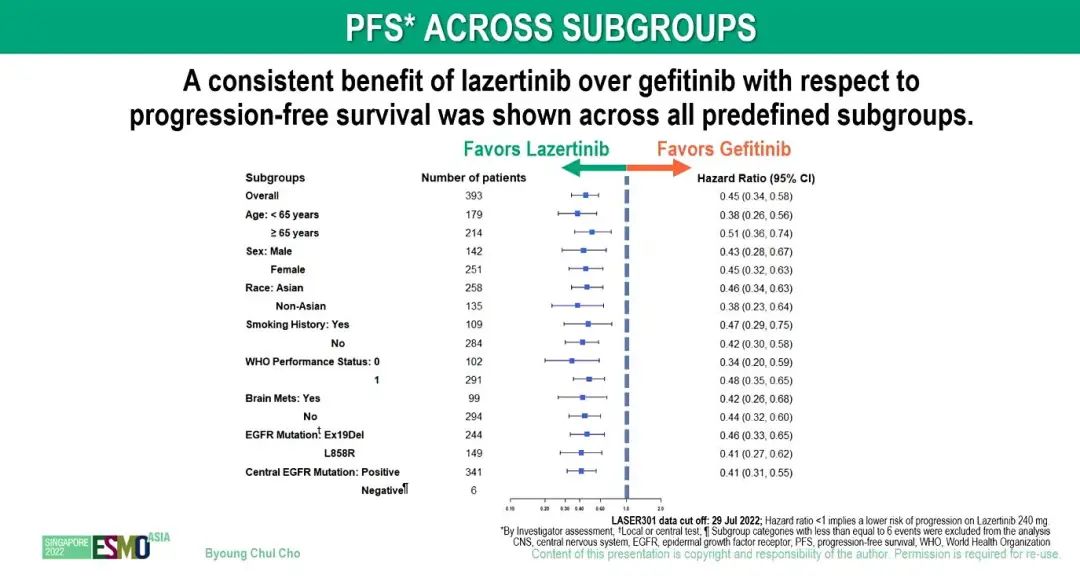
PFS亚组分析
亚裔亚组分析显示,lazertinib组和吉非替尼组的中位 PFS分别为20.6 个月和 9.7 个月,非亚裔亚组患者的中位PFS分别为未达到和9.7个月,19 外显子缺失、L858R 突变亚组患者的中位PFS分别为 20.7个月 vs 10.9个月、17.8个月 vs 9.6个月。lazertinib组和吉非替尼组的ORR均为76%(OR,0.99;95% CI,0.62-1.59),两组的中位缓解持续时间分别为 19.4个月和8.3个月(95% CI,6.9-10.9)。中期分析时,总生存期(OS)数据尚不成熟,成熟度为 29%,lazertinib组和吉非替尼组的18个月OS率分别为80%和72%(HR=0.74,95% CI,0.51-1.08;P = 0.116)。两组中观察到的安全性事件与既往的报道结果一致。

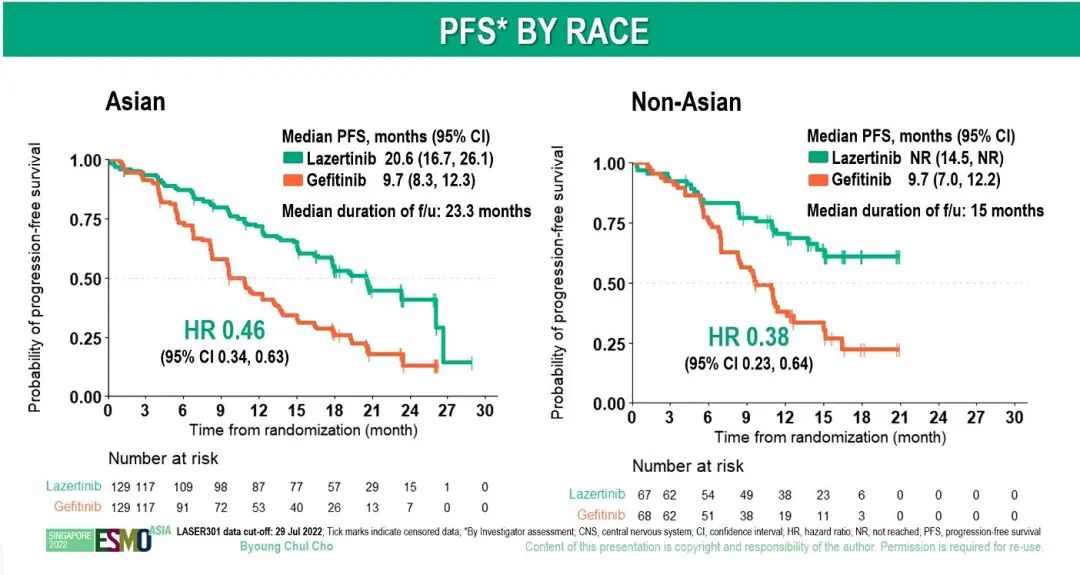
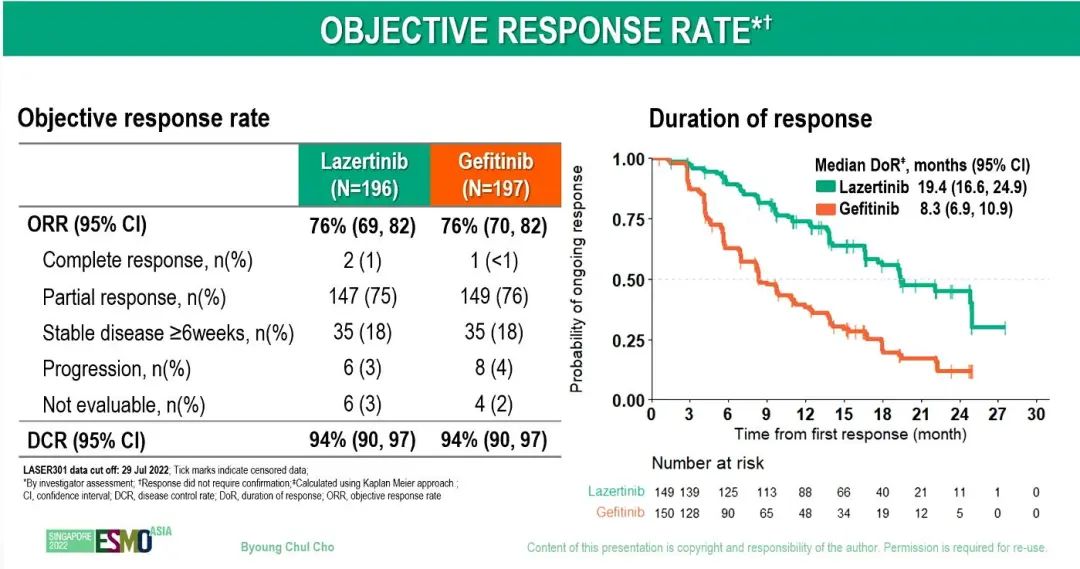
左图:有和无CNS转移PFS亚组分析;中图:亚裔和非亚裔亚组分析;右图:疗效分析
小结:与吉非替尼相比,lazertinib一线治疗可明显提高EGFR敏感突变晚期NSCLC患者的PFS,疾病进展或死亡风险降低55%,研究支持lazertinib可作为EGFR敏感突变晚期NSCLC患者新的标准治疗选择。
二、ALK融合
TQ-B3139-III-01研究
TQ-B3139-III-01研究: TQ-B3139-III-01研究是一项随机、多中心、开放标签的III期临床试验(NCT04009317),旨在评估依奉阿克对比克唑替尼一线治疗ALK阳性晚期NSCLC有效性和安全性。试验的主要终点是独立审查委员会(IRC)评估的无进展生存期(PFS);次要终点包括研究者评估的无进展生存期(PFS)、IRC和研究者评估的客观缓解率(ORR)、IRC和研究者评估的缓解持续时间(DoR)、总生存期(OS)以及安全性。该试验的Leading PI为中山大学肿瘤防治中心张力教授,共入组264例患者。
研究结果:在2022 ESMO-Asia会议上,方文峰教授代表研究团队以Mini-Oral形式公布了研究结果(320MO)。依奉阿克组mPFS(IRC评估)显著优于克唑替尼组(NR vs 11.89 m,HR = 0.46,p < 0.0001),合并TP53突变的患者同样可以从依奉阿克治疗中获益(mPFS:11.93 m vs 7.85 m, HR = 0.47),研究者评估的mPFS与IRC评估一致(22.70m vs 11.96 m,HR = 0.43,p < 0.0001)。IRC评估的ORR为81.68% vs 69.92%,同时依奉阿克组具有更持久的疗效(mDoR:NR vs 12.68 m,p = 0.0014)。对于基线无脑转移的患者,治疗期间依奉阿克组脑转移发生率明显低于克唑替尼组(1.10% vs 11.83%,p = 0.0049),基线有颅内靶病变的患者的CNS-ORR为78.95% vs 23.81%。药物相关≥3级TEAEs的发生率为51.91% vs 40.60%,TEAEs导致治疗中断的比例为4.58% vs 3.01%。
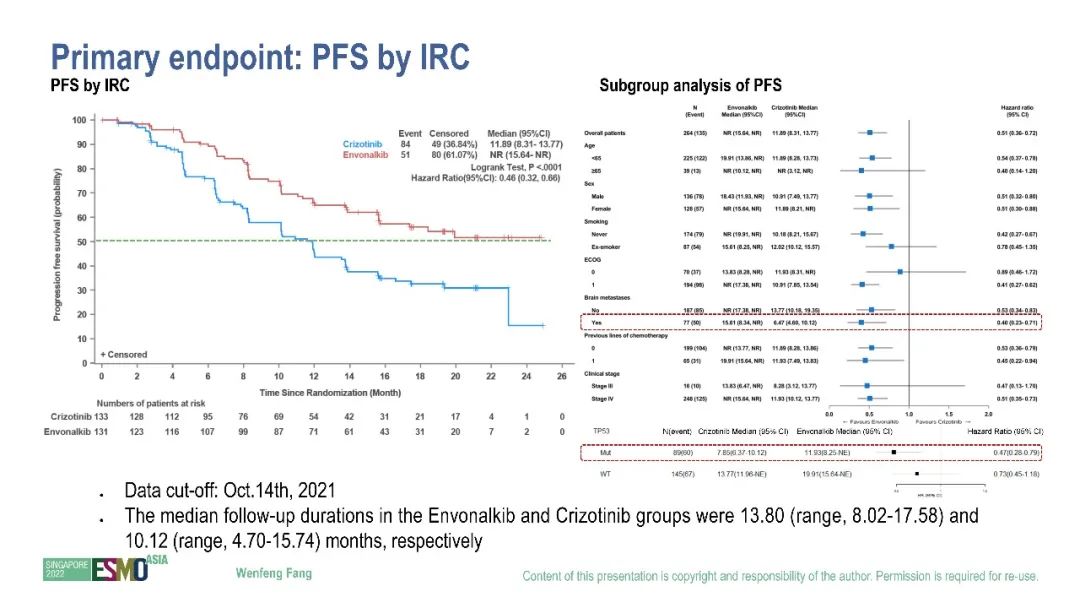
小结:基于该研究的结果,依奉阿克已于2022年5月向国家药监局递交了上市申请,申请适应症为ALK阳性晚期NSCLC一线治疗,预计将在2023年获得批准,这将为国内ALK阳性晚期NSCLC一线治疗提供新的用药选择。
三、MET变异
NCT04338243研究
NCT04338243研究:MET扩增(METamp)通常在携带EGFR突变的非小细胞肺癌(NSCLC)患者中介导对EGFR TKIs的耐药性。多项临床试验表明,MET抑制联合EGFR TKI是克服MET扩增介导耐药性一种有前途的治疗策略。SCC244是一种高选择性的MET激酶小分子抑制剂。其耐受性良好,在临床研究中显示出良好的抗肿瘤活性,可用于MET变异患者的单药治疗。这是一项开放标签的IB/II期临床研究(NCT:04338243),旨在评估SCC244联合奥希替尼治疗局部晚期或转移性EGFR-mut NSCLC的安全性和有效性,入组携带METamp,对EGFR TKI耐药的患者。在IB期试验中,30例患者接受SCC244 200 mg/d或300 mg/d和奥希替尼80 mg/d的联合治疗,直至病情进展或不可耐受的毒副反应。每6周评估一次肿瘤反应。研究人员将IB期的主要终点定为ORR (RSCIST v1.1)。

虞永峰教授

研究设计
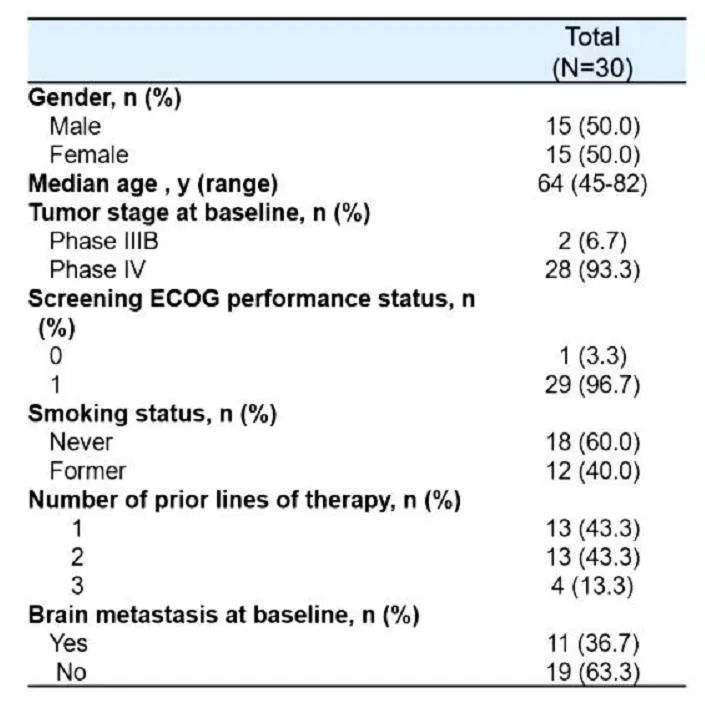
基线特征
研究结果:总体ORR为60% [95% CI:40.6-77.3],mDOR为5.8个月[95% CI:3.9-12.7],mPFS为6.9个月[95% CI:3.9-8.9],mOS为16.9个月[95% CI:11.1-NE]。在19例EGFR-mut T790M阴性,且此前第1代或第2代EGFR TKI治疗后进展的NSCLC患者中,ORR为73.7% [95% CI:48.8-90.9],mDOR为6.2个月[95% CI:3.3-NE],mPFS为7.0个月[95% CI:4.1-13.8],mOS为15.1个月[95% CI:9.5-NE]。30例可评估患者中,最常见的AE为水肿(70.0%)。最常见的≥3级TRAE是血小板减少(16.7%)和中性粒细胞减少(16.7%)。6例患者因TRAE停止治疗,无一例停药完全归因于SCC244。
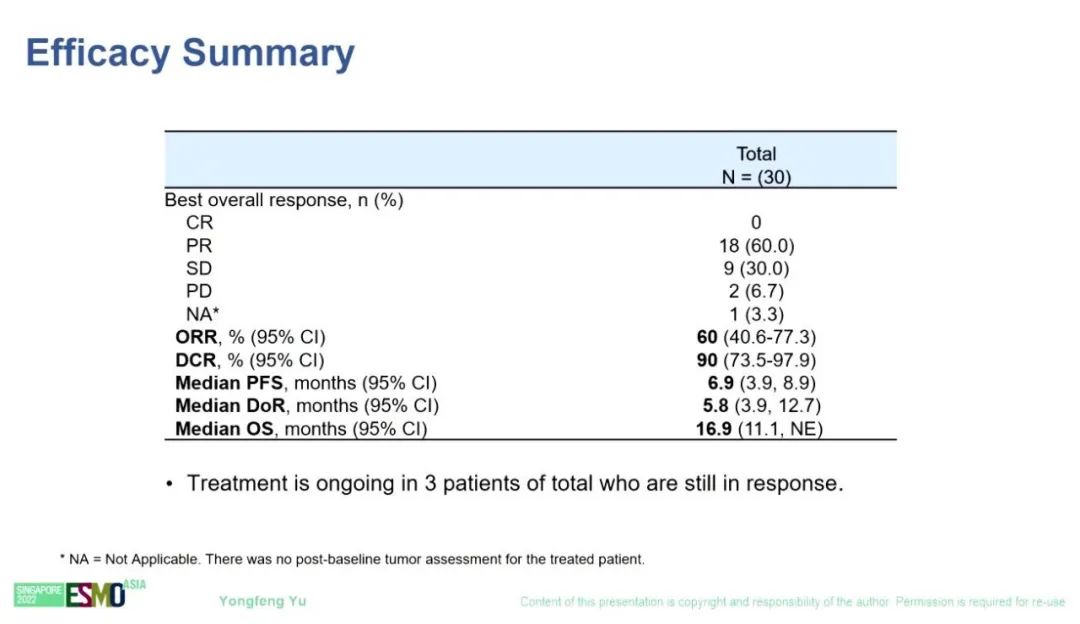
疗效分析1

疗效分析2
小结:SCC244联合奥希替尼在EGFR突变且EGFR TKI耐药的NSCLC患者中有效。安全性是可接受和可管理的。
四、小细胞肺癌
ASTRUM-005研究
ASTRUM-005研究:PD-L1抑制剂联合化疗是小细胞肺癌(SCLC)领域的里程碑式进展,PD-L1抑制剂已获批用于广泛期小细胞肺癌(ES-SCLC)的一线治疗。今年ASCO年会上,吉林省肿瘤医院程颖教授公布了斯鲁利单抗(一种新型PD-1抗体)联合化疗用于初治ES-SCLC患者的III期研究中期分析结果,斯鲁利单抗是首个在SCLC领域显示阳性结果的PD-1抑制剂。基于早期结果,早在今年4月,斯鲁利单抗已被美国FDA授予孤儿药资格,用于SCLC患者的治疗。今年ESMO-AISA大会上,程颖教授再次公布了中位随访19.8个月的更新结果及亚组分析结果。ASTRUM-005是一项随机、双盲、国际、多中心、III期研究(NCT04063163)中,初治ES-SCLC患者按 2:1 比例随机分配接受斯鲁利单抗(4.5 mg/kg)或安慰剂联合卡铂/依托泊苷治疗(每3周静脉注射一次)。主要终点是总生存期(OS)。次要终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DOR)和安全性。

程颖教授口头报告

研究设计
研究结果:2019年9月12日至2021年4月27日期间,585例患者被随机分组,斯鲁利单抗组和安慰剂组分别有389例和196例。2022年6月13日数据截止时,中位随访时间为 19.8个月。与安慰剂组(11.1个月)相比,斯鲁利单抗组(15.8个月)的中位OS显著改善(HR=0.62,95% CI 0.50–0.76;P <0.001)。
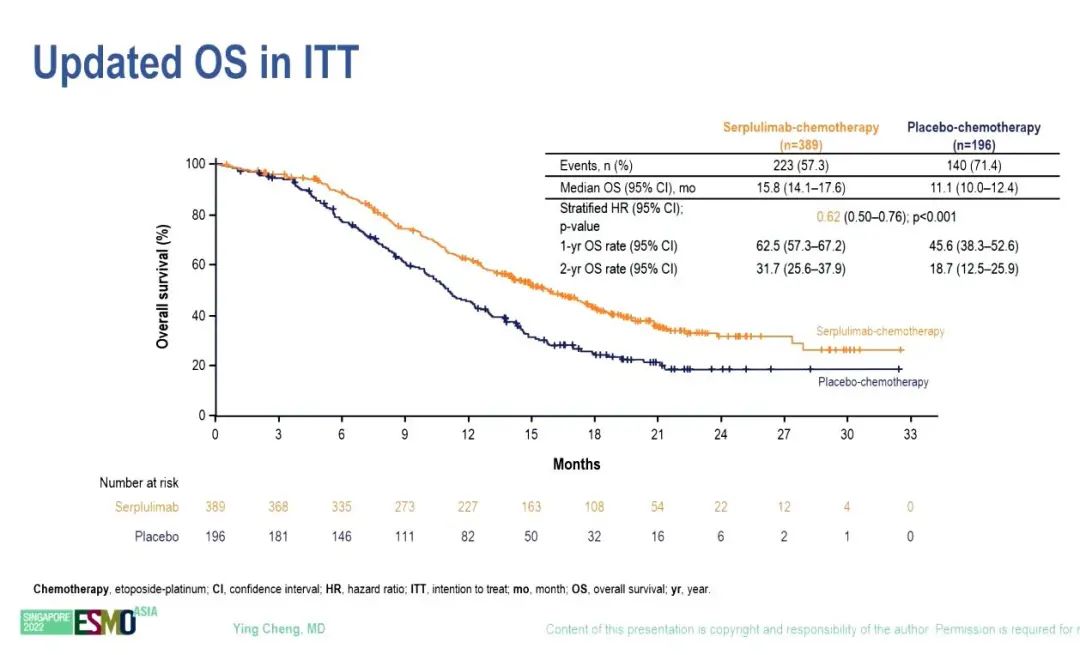
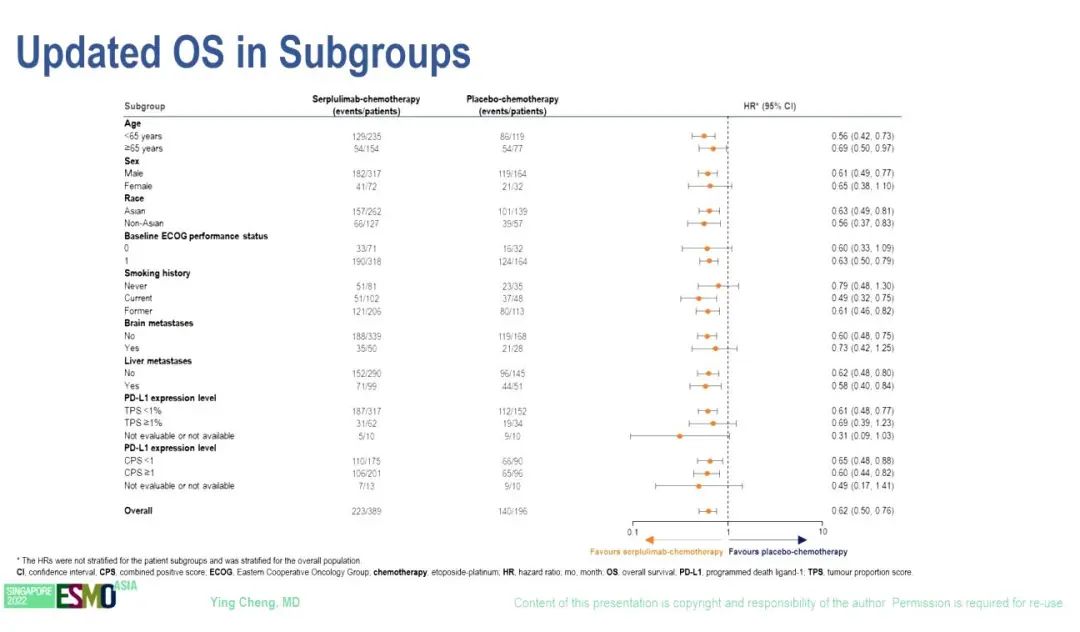
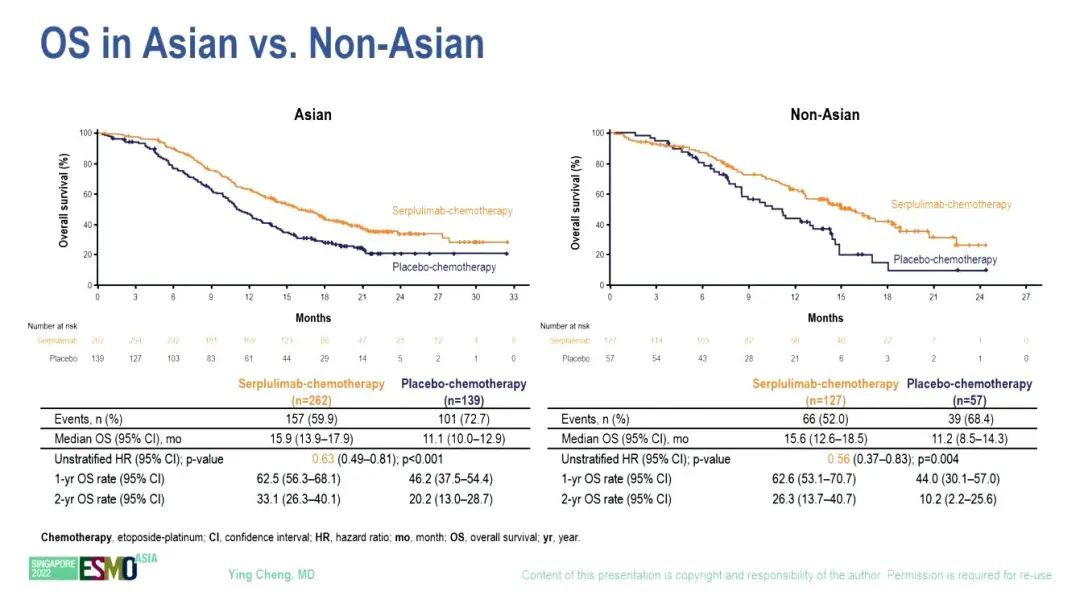
根据 RECIST v1.1由独立放射学审查委员会(IRRC)评估的中位 PFS 也明显改善,斯鲁利单抗和安慰剂组的中位PFS分别为5.8个月和4.3个月(HR=0.47,95% CI 0.38–0.58)。亚组分析显示,亚裔和非亚裔OS(HR 0.63 vs 0.56)和PFS(HR 0.47 vs 0.53)改善趋势类似。由IRRC评估的ORR分别为68.9%和58.7%。
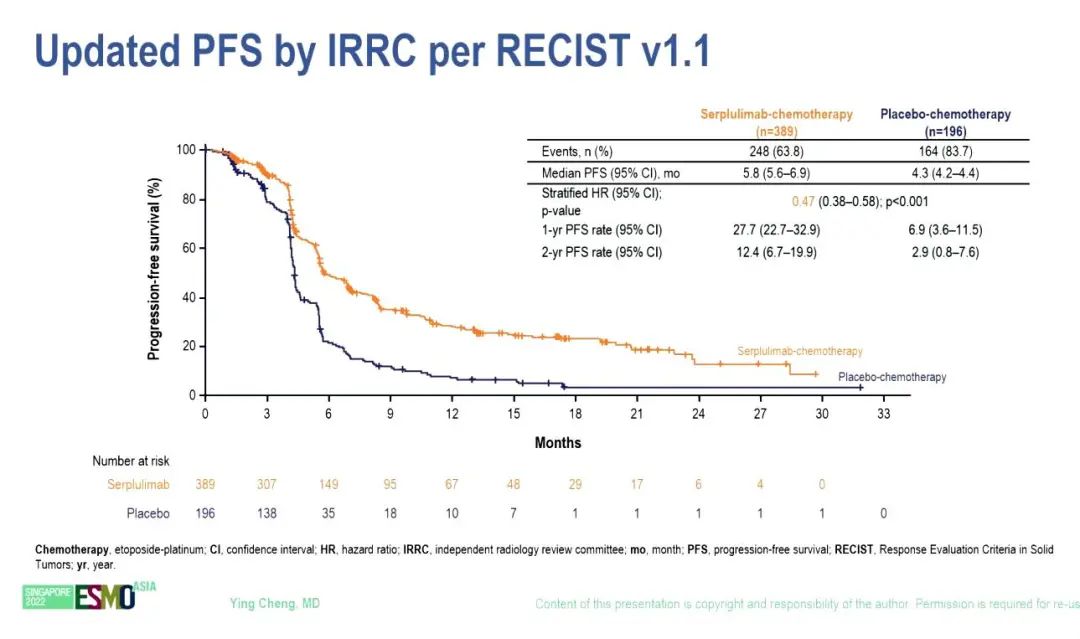
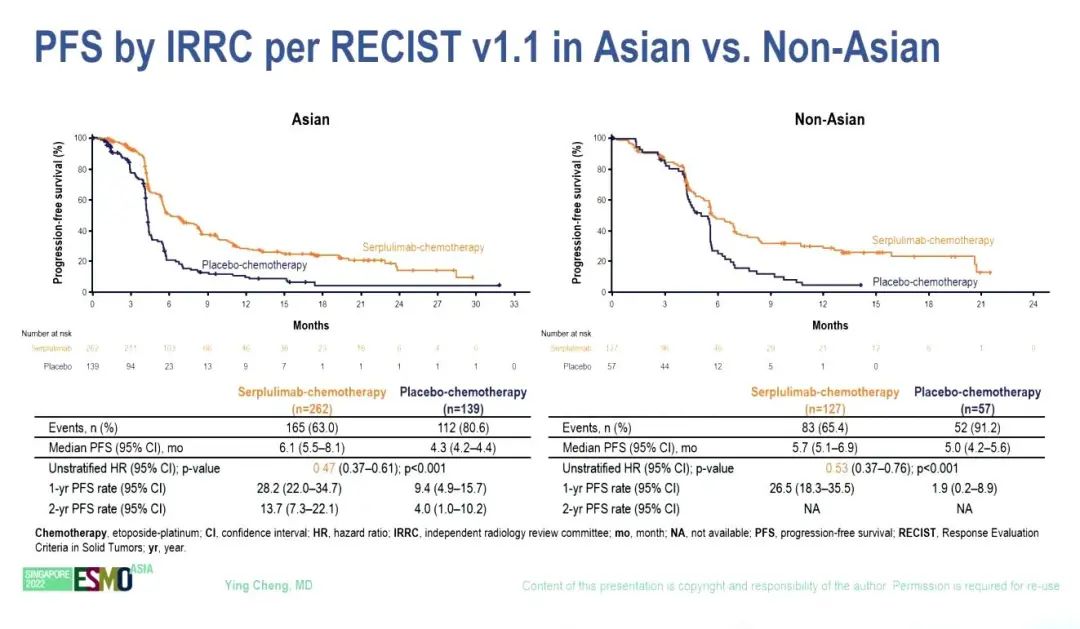
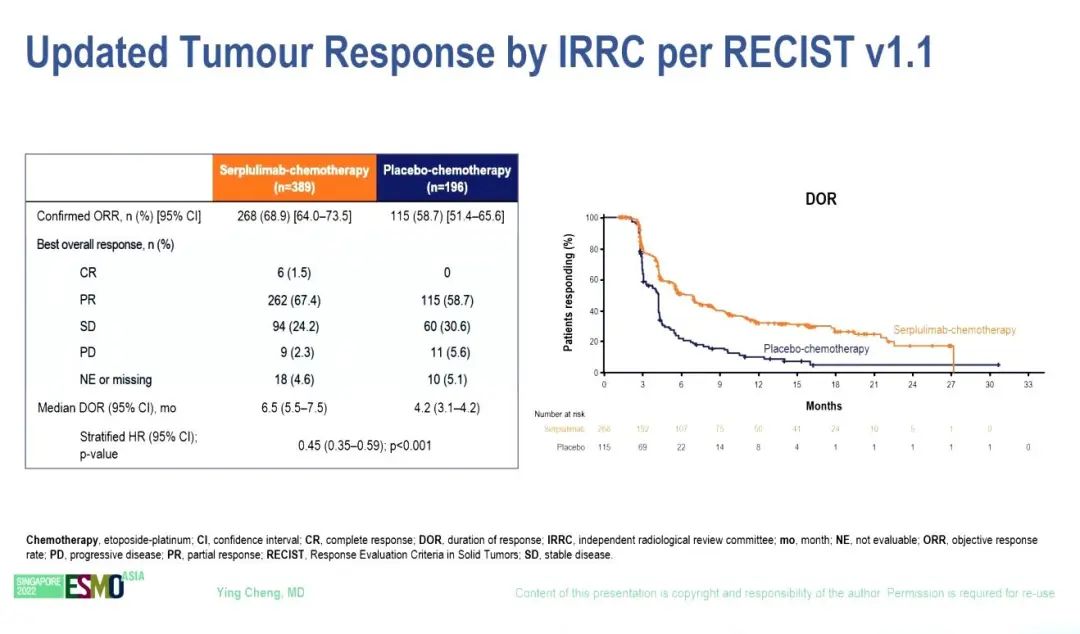
小结:斯鲁利单抗+化疗在初治ES-SCLC患者中显示出较好的抗肿瘤活性和良好的安全性。亚组分析显示出一致的OS获益。ASTRUM-005研究结果支持首个用于SCLC的PD-1抑制剂斯鲁利单抗联合化疗用于初治ES-SCLC的一线治疗。

本文作者





