宾夕法尼亚大学杨小鲁教授《Nature》:治疗阿尔茨海默病的新方法!
时间:2023-07-30 21:21:57 热度:37.1℃ 作者:网络
Tauopathies是一大类神经退行性疾病,包括但不限于阿尔茨海默病。这些疾病的细胞内tau水平增加,最终对神经元产生毒性并导致其变性。这些疾病在病理学上由细胞内神经纤维缠结(NFTs)定义,该缠结由微管相关蛋白tau的过度磷酸化和丝状形式组成。众所周知,tau编码基因的突变会导致遗传性的tau病子集。然而,如何从可溶性单体转化为不溶性纤维聚集体仍然是一个谜。这一明显的知识差距阻碍了针对这一大群疾病的基于机制的治疗方法的发展。在散发性和遗传性tau病中,tau聚集体的积累都是以年龄依赖的方式发生的,这表明细胞因子可能在生命早期起作用,抑制tau错误折叠和聚集。所有生命体都依赖蛋白质质量控制(PQC)系统来去除有缺陷或多余的正常蛋白质,防止蛋白质错误折叠和聚集,并溶解先前存在的蛋白质聚集体。最近的研究表明,仅在后生动物中发现的trpartite motif (TRIM)蛋白可能在这些高度复杂的生命形式中参与PQC的多个方面。
基于此,美国宾夕法尼亚大学医学院杨小鲁教授课题组研究了TRIM系统,以寻找其在牛头病发病机制中的潜在作用,研究其潜在机制,并测试其作为治疗剂的潜在效用(图1)。相关工作以“TRIM11 protects against tauopathies and is down-regulated in Alzheimer’s disease”发表在《Science》。
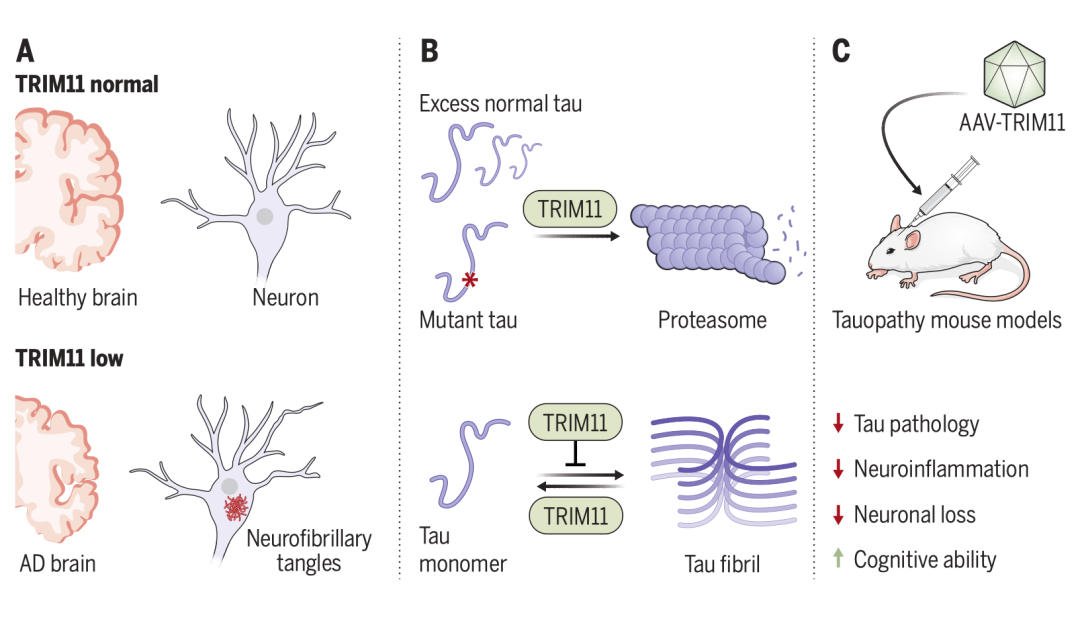
图1. TRIM11在AD脑中的下调及其恢复的潜在治疗益处
研究者检查了70多个人类TRIMs,观察到TRIM10、TRIM55,尤其是TRIM11表现出很强的去除由疾病相关tau突变体形成的聚集体的能力。对23名AD患者和14名年龄和性别匹配的对照组的死后脑组织中这三种TRIMs的分析显示,与对照组相比,AD患者大脑中的TRIM11蛋白水平(而不是mRNA)显著降低,而TRIM10和TRIM55 mRNA和蛋白水平保持不变。从机制上讲,TRIM11有三个与tau相关的活性。首先,它介导突变tau蛋白和过量正常tau蛋白的周转。它通过与tau蛋白结合,特别是突变变体或过度磷酸化的物种,并促进其sumo化,导致其蛋白酶体降解来实现这一点。因此,TRIM11代表了tau和蛋白酶体之间的关键联系。其次,TRIM11作为tau蛋白的分子伴侣,防止tau蛋白错误折叠和聚集。第三,TRIM11是一种分解tau蛋白的酶,可以溶解先前存在的tau蛋白沉积物,包括顽固性纤维聚集体。TRIM11伴侣和解聚酶活性不依赖于ATP,即使在低亚化学计量TRIM11/tau比下也能有效地运作。
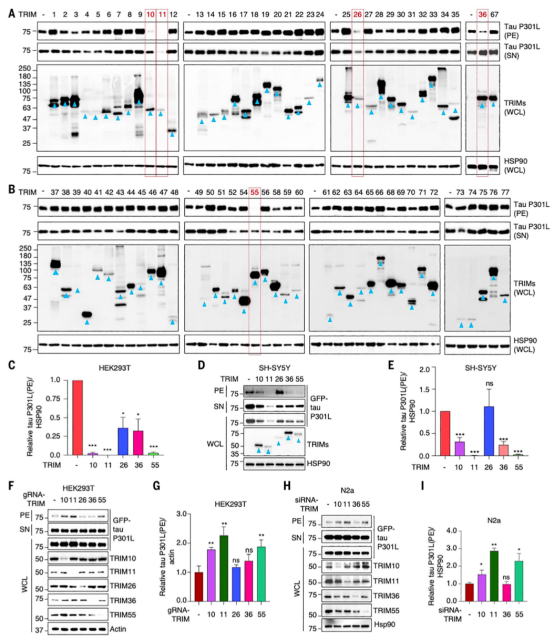
图2. 筛选TRIMs蛋白
在不同的细胞模型中,trim11可以防止细胞内tau的自发和种子聚集,使tau保持其功能可溶性形式。在培养的原代神经元中,内源性TRIM11的下调会损害神经元的活力,而TRIM11的表达增加则会促进神经元的活力以及突触前和突触后点的形成。因此,TRIM11是一种重要的神经保护因子。
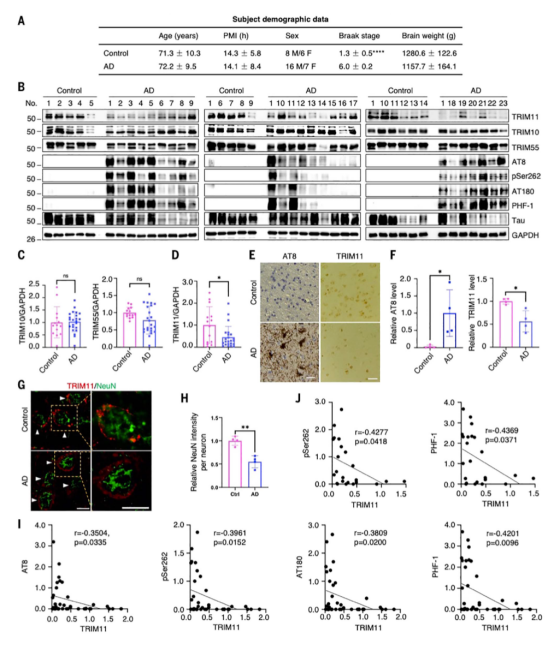
图3. TRIM11在散发性AD脑中的下调
为了研究TRIM11在哺乳动物大脑中的作用并评估其治疗潜力,研究者使用了多种tau病小鼠模型,包括表达常见tau突变体P301L的PS19小鼠;给PS19小鼠注射预先形成的tau原纤维可加重疾病表型;和3×Tg-AD小鼠,它们表达tau P301L和两种AD相关蛋白(淀粉样蛋白前体蛋白和早老素1)的家族突变。TRIM11通过腺相关病毒(AAV)载体局部递送到海马,或通过脑脊液在大脑中整体递送。在这些模型中,TRIM11抑制tau病理和神经炎症,并改善认知和运动能力。
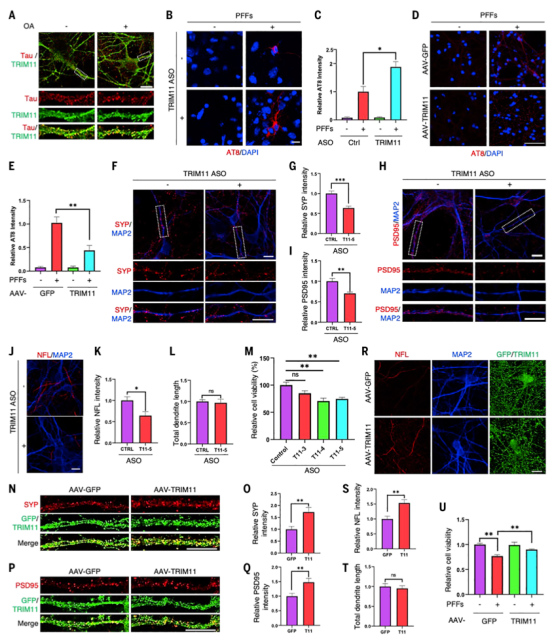
图4. TRIM11维持神经的完整性和连通性
【小结】
这些数据表明TRIM11在预防牛头病中起重要作用,其下调可能有助于这些疾病的发病机制。我们的研究结果还强调了一个强大的、具有后生特异性的PQC系统,该系统具有独立的组件,可以使用不同于规范的、依赖于ATP的PQC系统的机制执行多个任务。考虑到TRIM11的表达似乎受到高度调控,通过小分子上调其表达可能是可行的。此外,该研究结果为TRIM11基因本身作为治疗剂的概念提供了证明,增强了PQC能力,从而解决了各种神经退行性牛头病的根本原因。
原文链接:
https://www.science.org/doi/full/10.1126/science.add6696


