INC世界知名儿童神外Rutka教授:脑干肿瘤治疗的最新进展及治疗案例解析
时间:2023-01-06 06:02:01 热度:37.1℃ 作者:网络
脑干肿瘤是跨越脑干中脑、桥脑、延髓区域并可压迫小脑、颈髓等的一组异质性肿瘤,脑干肿瘤占儿童颅内肿瘤的10%-20%,占成人颅内肿瘤的1.5%~2.5%,脑干胶质瘤是最常见的病理类型,其他包括海绵状血管瘤、转移瘤、成血管细胞瘤、淋巴瘤等。
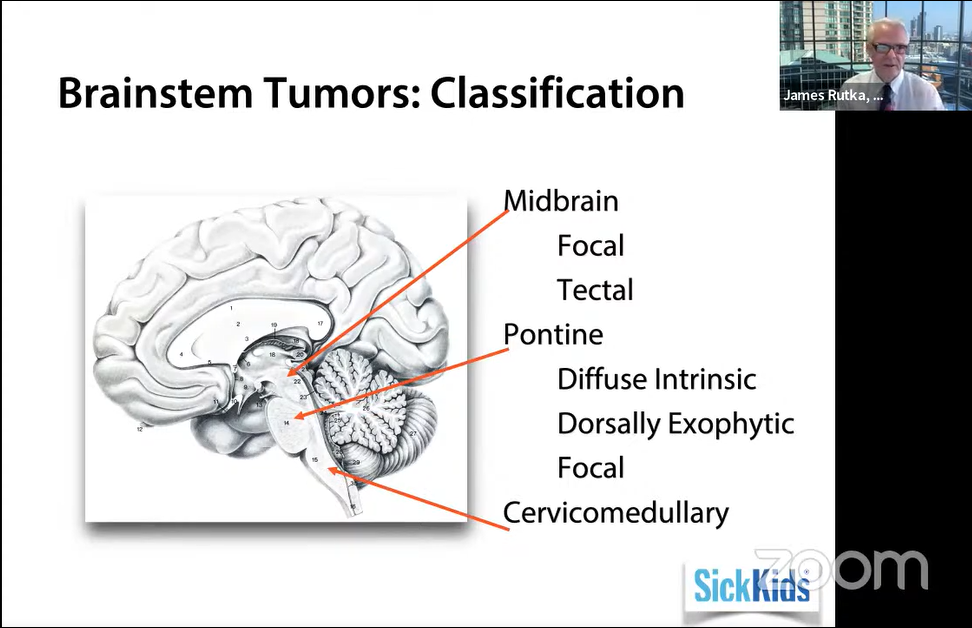
脑干肿瘤分类,Midbrain 中脑—Focal 局灶性、Tectal 顶盖;Pontine桥脑—Diffuse Intrinsic 弥漫性内生性脑桥胶质瘤 (DIPG)、Dorsally Exophytic 背侧外生、Focal 局灶性;Cervicomedullary 颈髓
INC旗下世界神经外科顾问团成员、加拿大SickKids儿童医院脑瘤研究中心主任、世界神经外科学院前主席、世界神经外科专业知名杂志《Journal of Neurosurgery》主编James T. Rutka教授在其课程演讲《Recent Advances in the Management of Brainstem Tumors》中详细阐述了中脑肿瘤、桥脑肿瘤、延髓-颈髓肿瘤等不同类型儿童脑干肿瘤的临床症状、诊断方法、分型、治疗办法及预后等,可为国内外的小儿脑干肿瘤患者治疗提供国际标准的参考。
脑干胶质瘤,由于改进的显微神经外科方法的出现,以及对肿瘤类型的进一步了解,带来了治疗的改进,现在被认为是可触及的肿瘤。
脑干—中脑肿瘤
中脑顶盖胶质瘤
1.特点:
·导致梗阻性脑积水的小肿瘤
·MRI是诊断这些肿瘤的金标准
·生长速度非常慢,惰性病变
·脑脊液转移必经之地
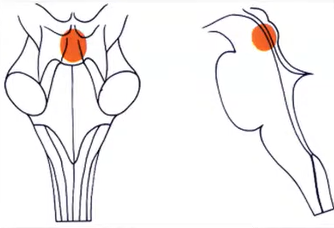
2.案例解读:选择的成像方式是核磁共振。在对比剂增强后,被盖肿瘤通常均匀强化。他们可以很大体积地占据整个被盖部,并且可因Monro孔闭塞而引起脑积水。
案例1:8岁女孩,头痛逐渐恶化,视神经乳头水肿。
治疗:仅ETV,恢复活动,如蹦床
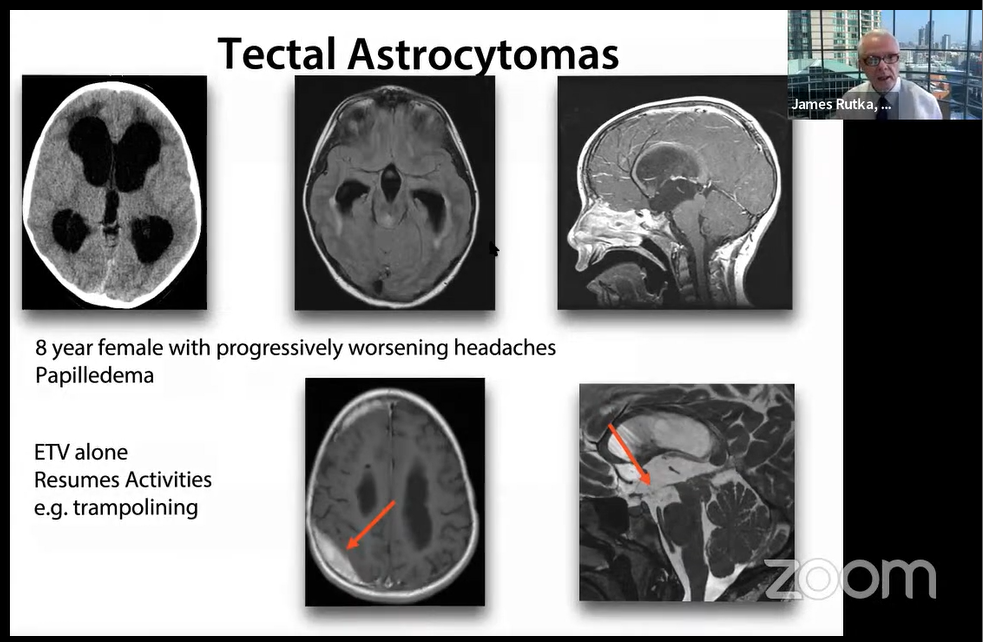
案例2:3个月男婴,急性梗阻性脑积水插入VP分流器!
MRI显示顶盖增厚和导水管缺失
案例3:10岁男性,头痛逐渐恶化,GBM家族史
治疗:仅ETV,随访患儿情况稳定
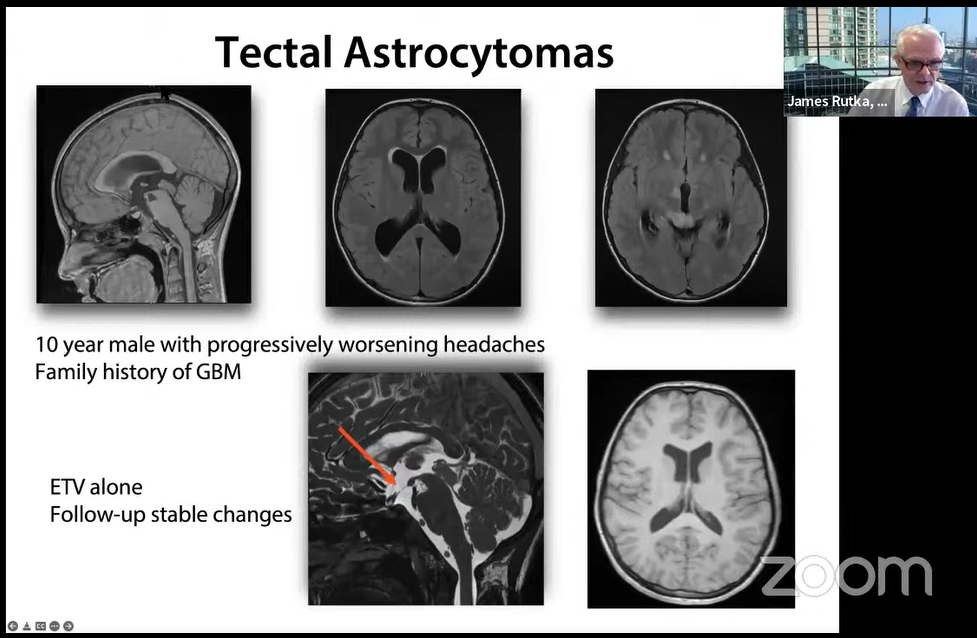
案例4:14岁男孩,帕里诺综合征,头痛
术后1年,帕里诺综合征消失,MRI无增强
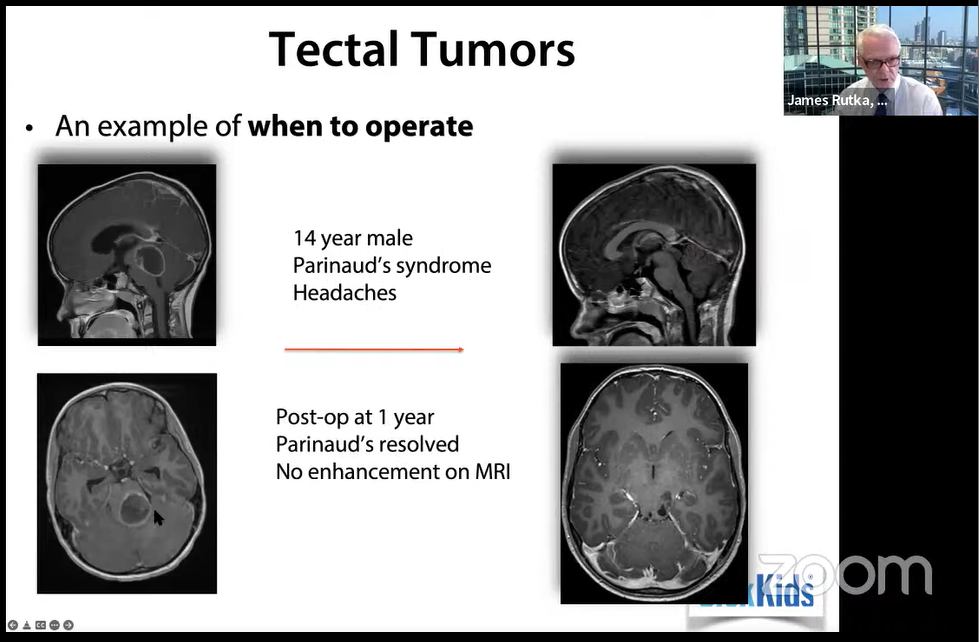
3.治疗建议:
·内窥镜第三脑室造瘘术 (ETV)最能实现脑脊液分流
·即使在年幼的孩子身上也能取得非常好的预后
·如果需要,同时对病变进行活检
4.手术入路:
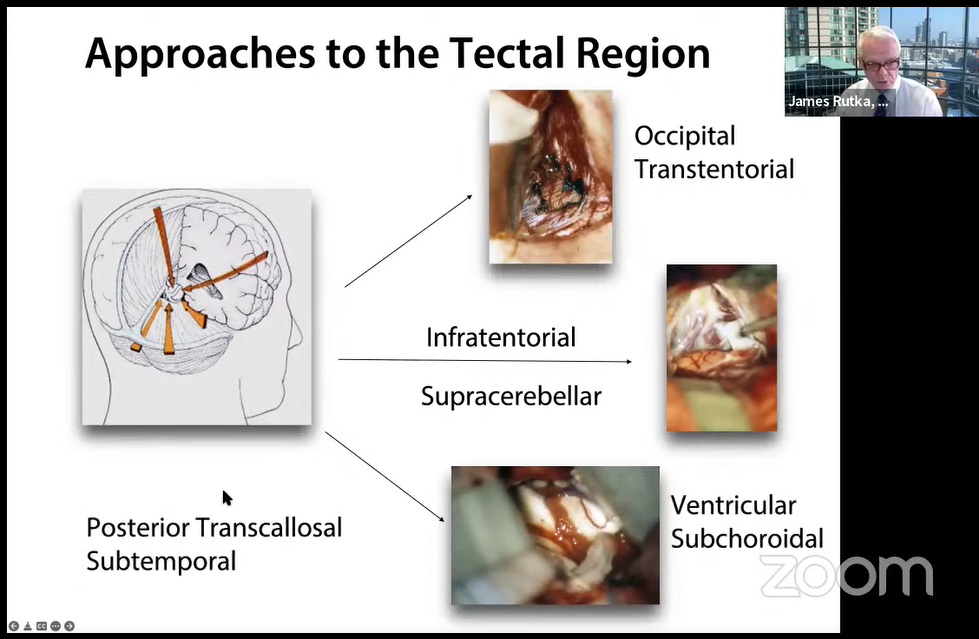
手术入路图解

教授相关专著
中脑局灶性被盖肿瘤
1.临床研究:12例儿童分析,所有低级别星形细胞瘤,仅通过手术治疗的6例,术后XRT治疗6例,预后都很好。
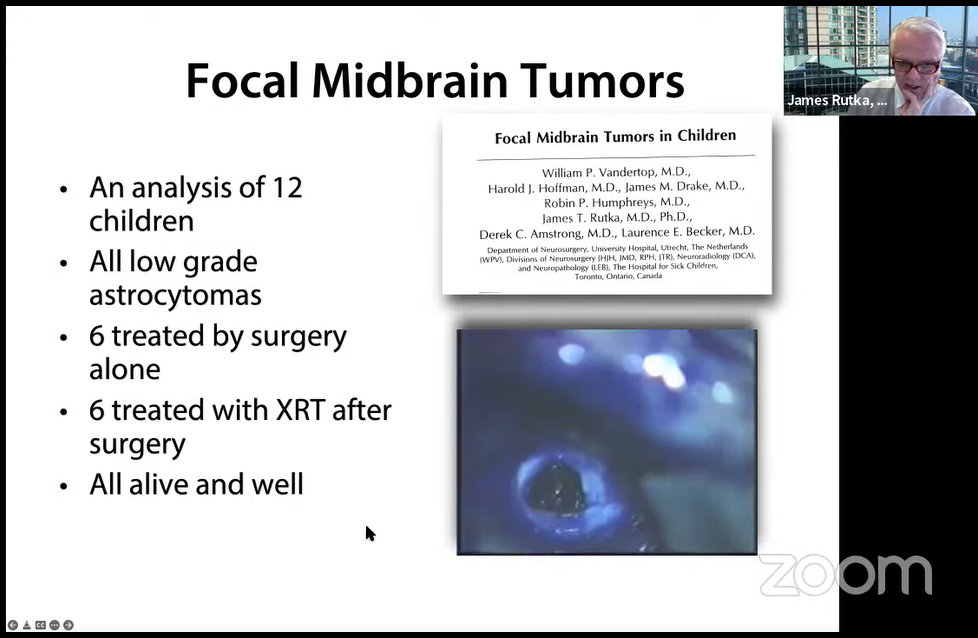
2.特点:
·中脑局灶性强化被盖肿瘤
·通常导致儿童偏瘫和上颅神经麻痹
·大多数为低级别,可切除
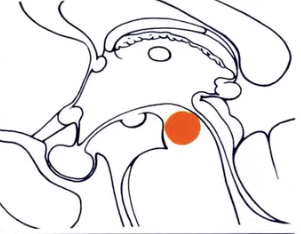
3.诊断方法:选择的成像方式是核磁共振。在对比剂增强后,被盖肿瘤通常均匀强化。他们可以很大体积地占据整个被盖部,并且可因Monro孔闭塞而引起脑积水。
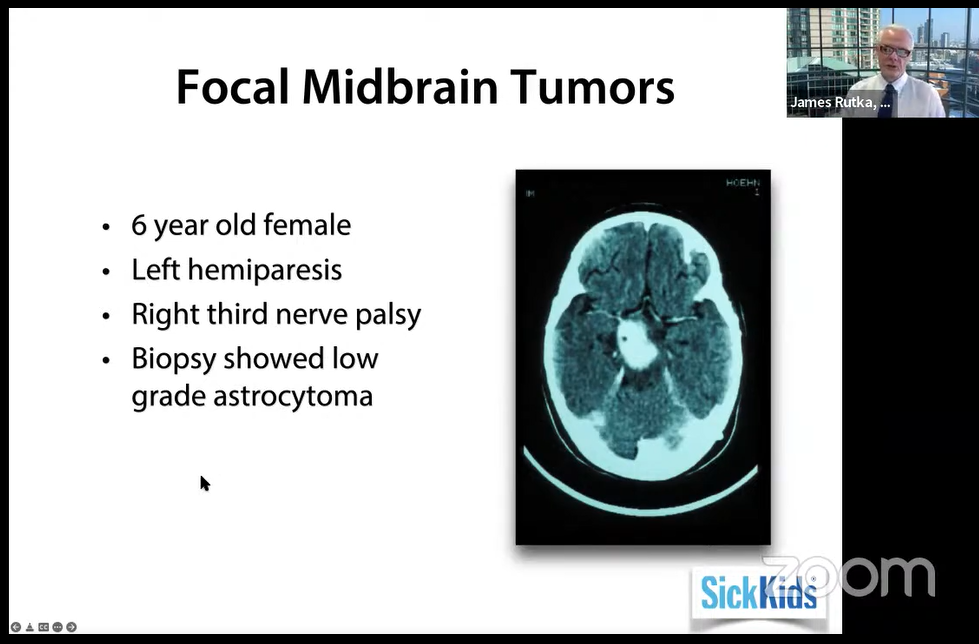
6岁女孩,左侧偏瘫,右侧第三神经麻痹,活检显示低级别星形细胞瘤。
4.治疗方法:局灶性被盖肿瘤在手术入路和长期管理方面给神经外科医生带来了巨大挑战。大多数病变是低级别胶质瘤,可进行传统框架或无框架立体定向活检。可选择的手术入路包括经外侧裂入路、经颞入路或经胼胝体入路,具体取决于肿瘤的大小及其对软脑膜或脑室表面的影响。最佳的神经外科切除术是借助神经导航,尤其是MR上的弥散张量成像序列、术中神经导航和术中MRI 扫描。手术的目标是达到肿瘤的完整全切。如果无法全切,那么可以考虑特定的中线低级别胶质瘤药物的化疗试验。有时 BRAF 基因可能在低级别星形细胞瘤中发生突变或融合, 这种分子表现可以为靶向药物治疗提供机会。儿童标准低级别胶质瘤化疗也是一种选择,并且在许多情况下效果很好。如果神经外科手术切除和化疗不够充分,则还可以进行调整适形放射治疗 (IMRT)。
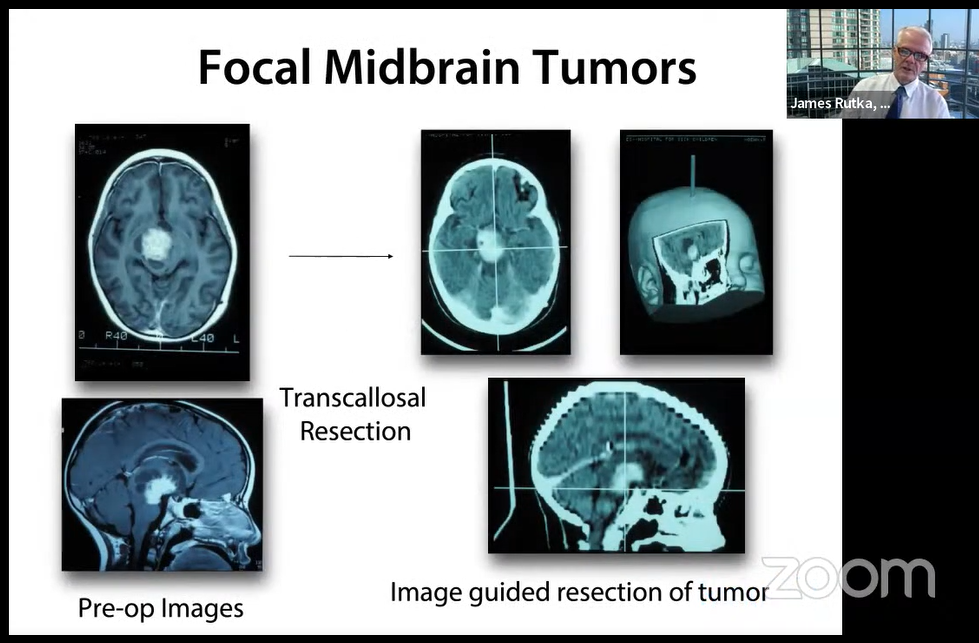
Transcallosal Rep:经胼胝体切除术,Pre-op Images :术前影像 ,Image guided rep of tumor:图像引导肿瘤切除术
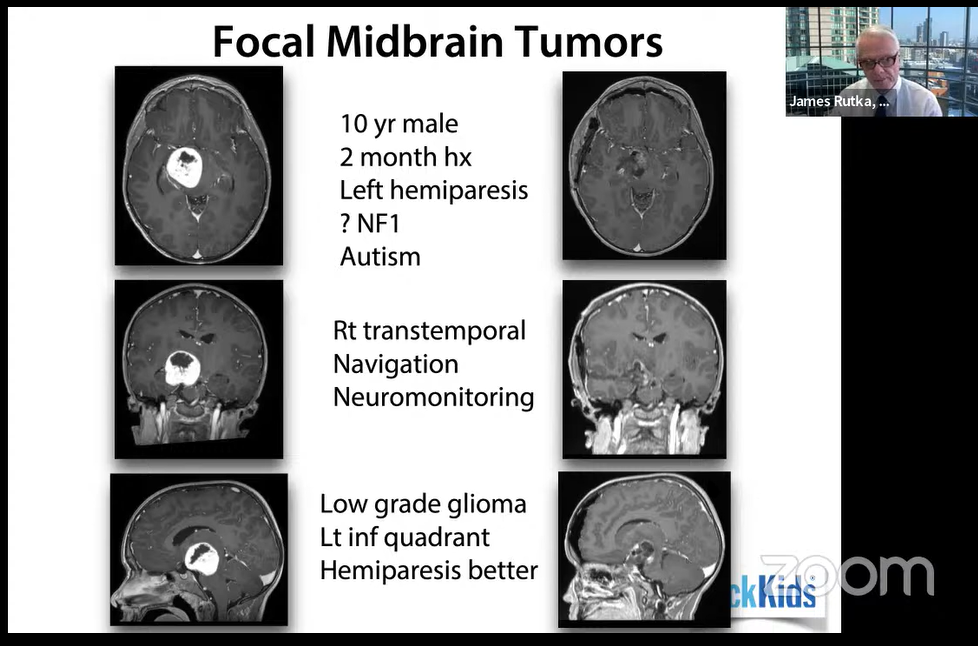
10岁男孩,2个月病史,左侧偏瘫,疑似NF1型,有自闭症。右侧经颞入路,在术中导航和神经电生理监测下进行手术。术后偏瘫改善。
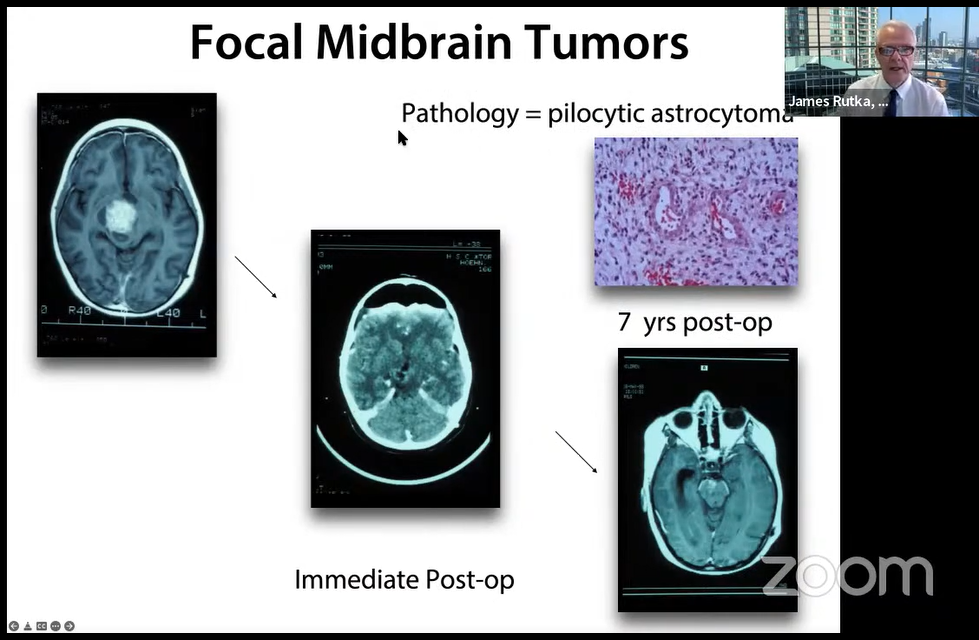
局灶性中脑肿瘤病例的术后影像,手术后即刻影像和术后7年显示肿瘤全切除,病理是毛细胞星形细胞瘤。
5.预后/生活质量:患有局灶性中脑肿瘤的儿童可以在积极的神经外科切除术后表现非常好。如果术后有残余肿瘤并被证实的再生,那么对于年龄较大的儿童,可以考虑靶向化疗、传统化疗或放射治疗等几种选择。通过最大程度的安全切除术,大多数局灶性中脑肿瘤的儿童可以过上正常的生活。由于存在复发的可能性,强烈推荐连续 MR 复查随访。总的来说,患有局灶性中脑肿瘤的儿童预后良好,90%或以上的患者可达到5 年生存时间。
背侧外生型脑桥胶质瘤
1.特点:
有长期症状的生长缓慢的儿童肿瘤
颅神经麻痹
常见脑积水
适用于外科手术
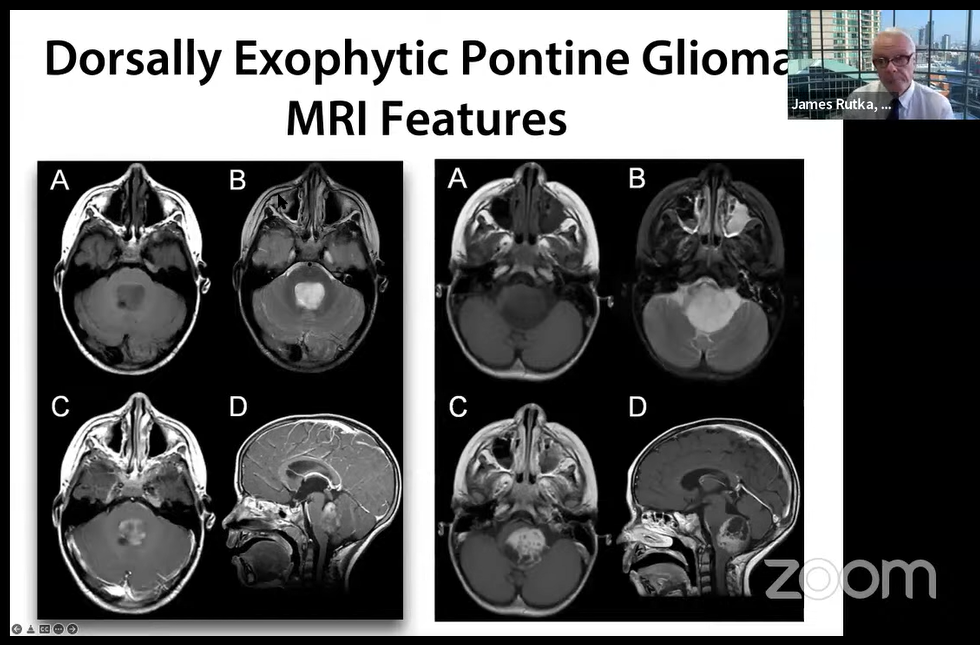
2.诊断方法:选择的成像方式是核磁共振。在对比剂增强后,被盖肿瘤通常均匀强化。他们可以很大体积地占据整个被盖部,并且可因Monro孔闭塞而引起脑积水。
3.案例:
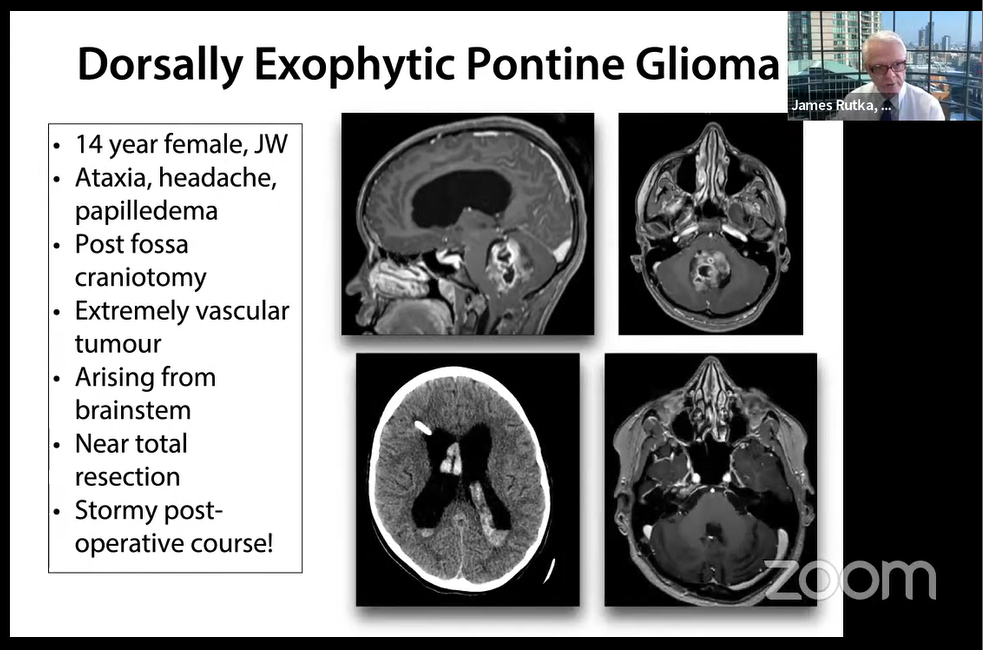
14岁女孩,出现共济失调、头痛、视乳头水肿。行后颅窝开颅术,近全切。

核间眼肌麻痹、严重共济失调、吞咽障碍、左侧面瘫等。术后逐步恢复,无需辅助治疗,最终成功毕业。
4.治疗方法:由于手术技术和神经影像学的现代进步,大多数背侧外生型脑干胶质瘤非常适合手术切除。而这些病变以前一直被认为无法手术,而如今由于显微神经外科技术的进步,术中神经电生理监测(IONM)和神经导航的出现,背侧外生型脑干胶质瘤越来越能够更好地接近。在标准枕下开颅和硬脑膜打开后暴露第四脑室背侧外生型占位后,通过使用超声波抽吸器 (CUSA)和双极烧灼逐步切除肿瘤。术中超声也是判断切除范围的有用辅助手段,术中磁共振iMRI也是如此。必须注意不要在第四脑室底部的估计平面以下切除肿瘤。IONM 的反馈有助于决定何时何地停止神经外科切除术。术后并发症通常以现有术前共济失调、测距障碍、眼球震颤和颅神经功能障碍加重的形式出现。
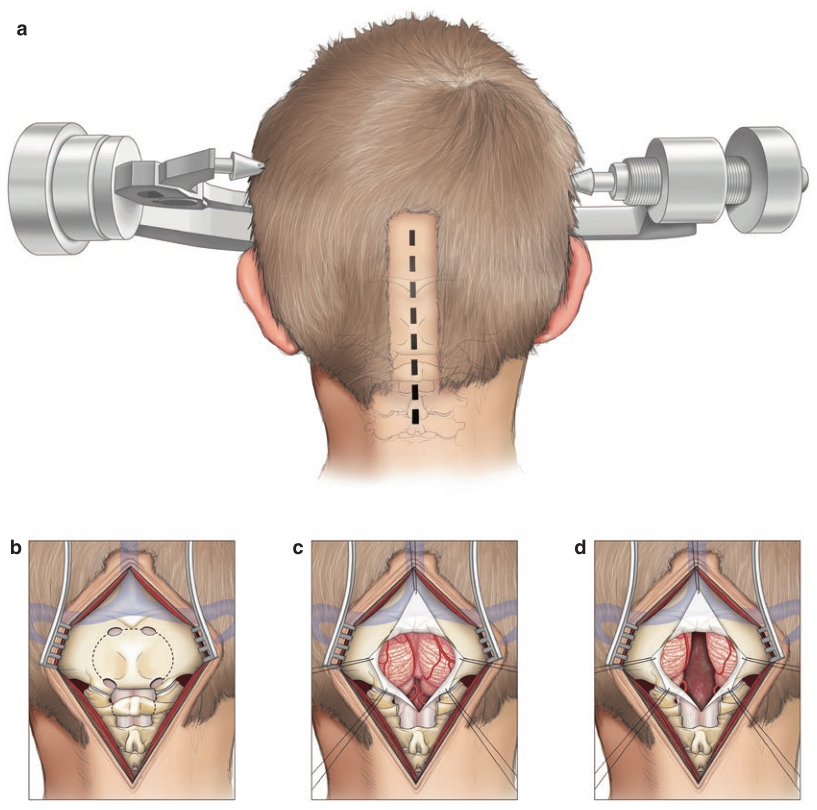
图:(a) 后颅窝病变的标准中线入路,适用于背侧外生型脑干胶质瘤。患者俯卧位固定(上图),进行小的局部中线剃发。(b) 枕部中线暴露进行时要记住两侧横窦的定位。如图所示进行开颅手术。四个钻孔用于准备用于去除颅骨的开颅器。小心识别枕骨大孔的唇部,以免在使用开颅器时造成硬脑膜撕裂。(c) 硬脑膜以 Y 形方式切开并反折,其边缘用钉缝线固定。(d) 小脑半球被轻轻,暴露第四脑室。显微镜用于切除肿瘤,注意不要在任何时候越过第四脑室底部。或者,可以使用经髓帆入路进行肿瘤切除
对于那些已经复发且难以进行进一步的切除手术的患者,可能需要放射治疗。通常,在 6 周内分 30 次给予 54 Gy。在许多系列中,放射治疗后的肿瘤控制被描述为普遍有利的。如今,随着已知的针对儿童低级别胶质瘤的生物学靶向,背侧外生性脑桥胶质瘤可能适合化疗。过去,卡铂和长春新碱有被使用。现在,随着各种 BRAF 突变和融合异常的发现,目前正在探索 BRAF 抑制剂疗法。
5.预后/生活质量:背侧外生型脑干胶质瘤中,毛细胞病变的总体 5 年存活率良好,大多数研究中的存活率约为 95%。即使肿瘤大体完全切除也能识别复发,因此 5 年无进展生存率在 54% 至 72% 之间。其他使生存恶化的因素是出现时的颅神经(特别是外展神经)功能障碍和症状持续时间少于 6 个月。与部分(< 总肿瘤质量的 50%)切除相比,低级别脑干病变的全切或次全切除已被证明具有更好的结果。背侧外生型病变手术后的长期神经功能通常良好,大多数患者均有所改善。
尽管背侧外生型毛细胞性胶质瘤的预后良好,但较罕见的纤维状胶质瘤的预后可能非常差。各种新的模式正在被研究,包括增强对流和缓流递送化疗药物,放射增敏剂、基因治疗、高压和间质放射治疗。最后,对于这些肿瘤的分子生物学的更深入了解将导致靶向疗法治疗的改进。
脑干—桥脑肿瘤
桥脑局灶性肿瘤
1.特点:
·脑干星形细胞瘤的新发现
·有些是低级别肿瘤,可接受神经外科手术切除
·一些将发展到间变性
2.治疗方法:
·大多数患者需要侧入脑干
·神经导航很有用
·颅底入路有助于以最低的发病率接近病变
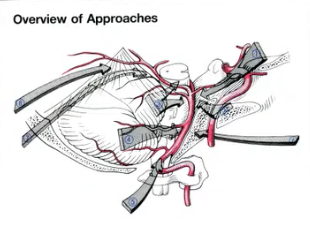
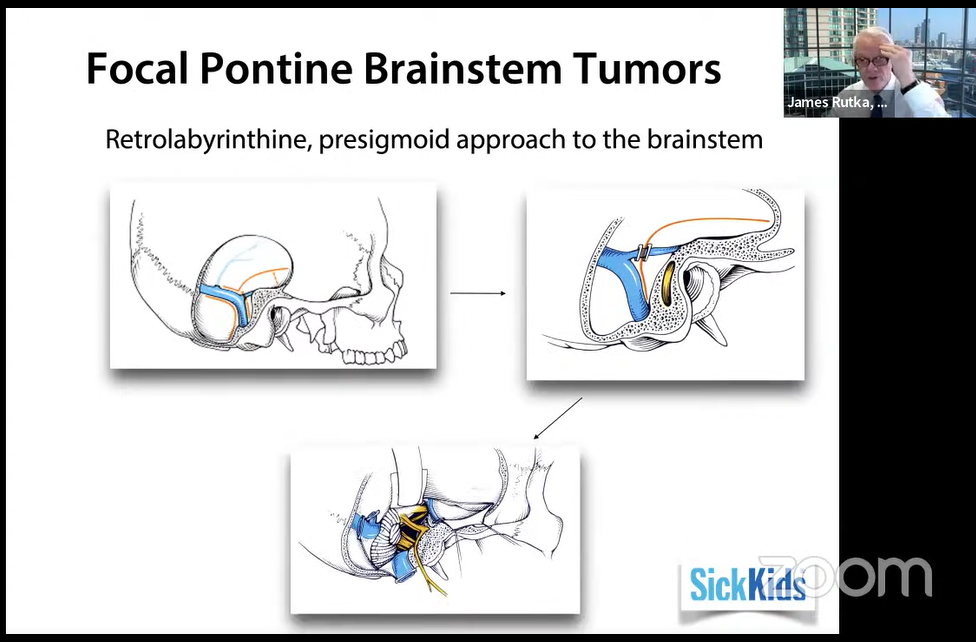
经迷路后、乙状窦前入路至脑干
3.案例:
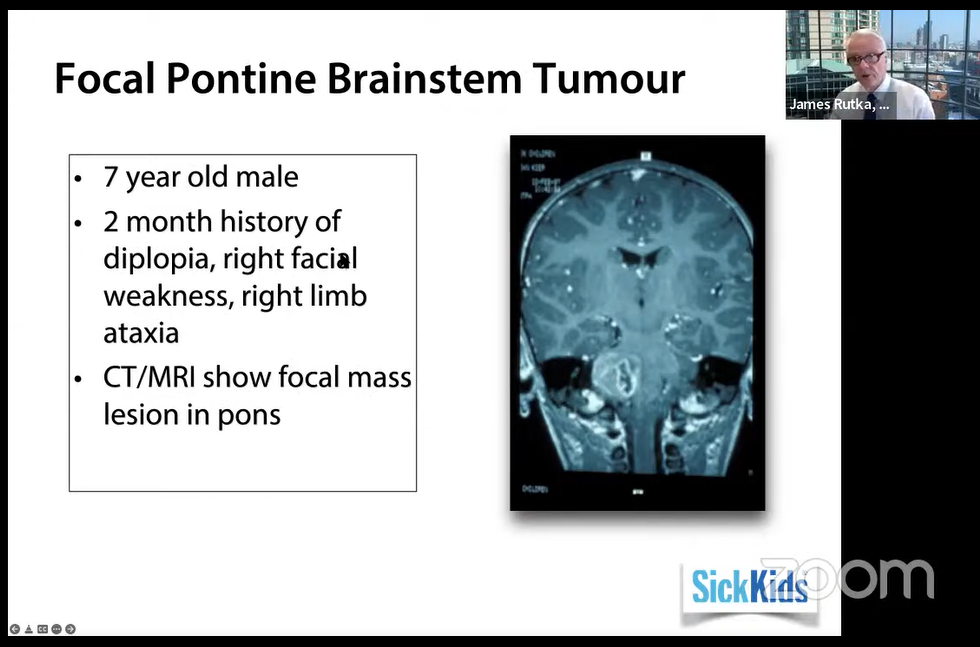
7岁男孩,复视、右面部无力、右肢体共济失调2个月病史,CT/MRI显示脑桥局灶性肿块。
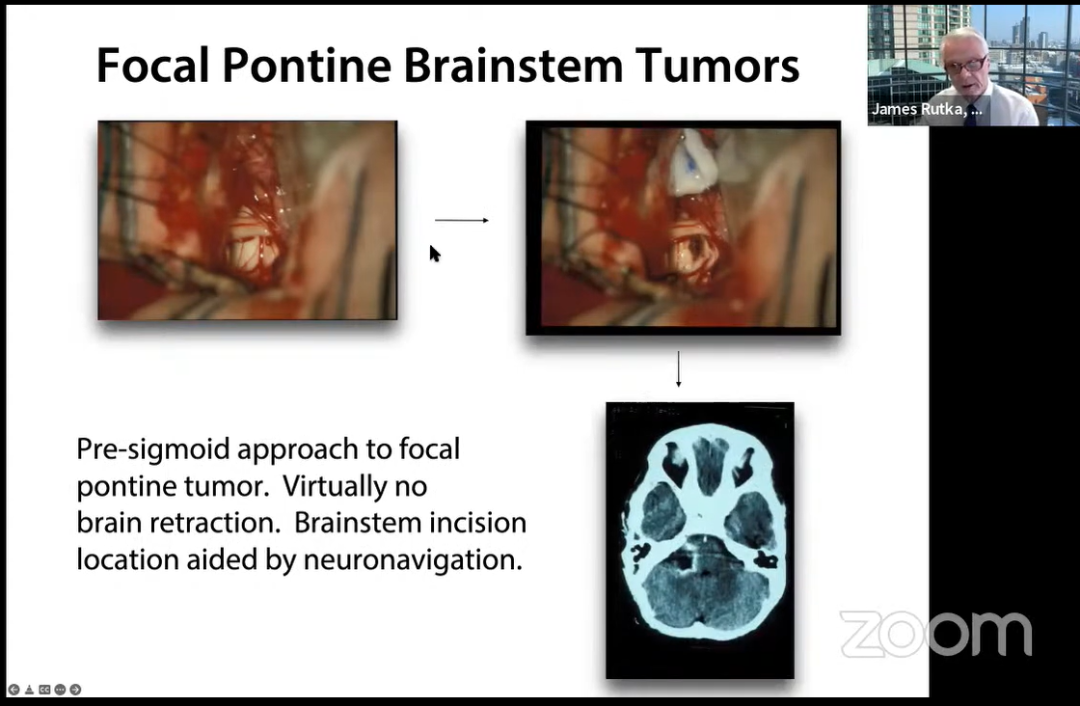
乙状窦前入路治疗脑桥局灶性肿瘤,几乎没有大脑收缩。神经导航辅助脑干切口定位
弥漫性内生性脑桥胶质瘤DIPG
1、定义:弥漫性内生性脑桥胶质瘤(DIPG)约占所有脑干肿瘤的 70%,使其成为最常见的脑干肿瘤类型。通常,这些病变是高级别肿瘤,尽管进行了各种治疗,但大多数儿童在诊断后 2 年内死亡,总体生存率非常低。DIPG的性别发病率相等,大多数儿童在诊断时年龄在5至10岁之间。是重要的是,儿童 DIPG 的分子遗传学现在了进一步的研究发现得到,新的基因遗传途径被发现为该肿瘤发生的驱动因素,包括 ACVR1、H3K27M、PDGB 和其他。
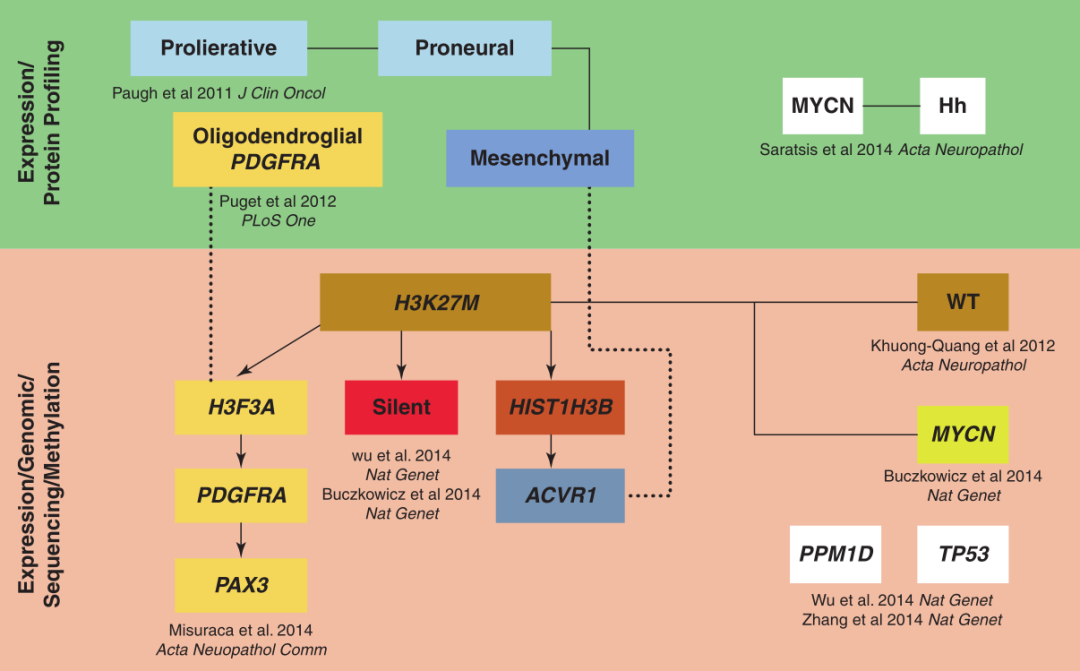
图:分子遗传特征示意图DIPGs。DIPG 的主要遗传驱动因素包括MYCN、ACVR1、H3K27M、PDGFRA 和 PAX3,其中其他(改编自 Misuraca、Cordero 和Becher, Front Oncol 2015)

DIPG遗传学研究

DIPG:分子遗传学的最新进展。儿科 DIPG 的药物靶点和治疗。DIPG 的特征在于组蛋白 H3 中发生的 K27M 突变。DIPG 中可靶向的转录依赖性
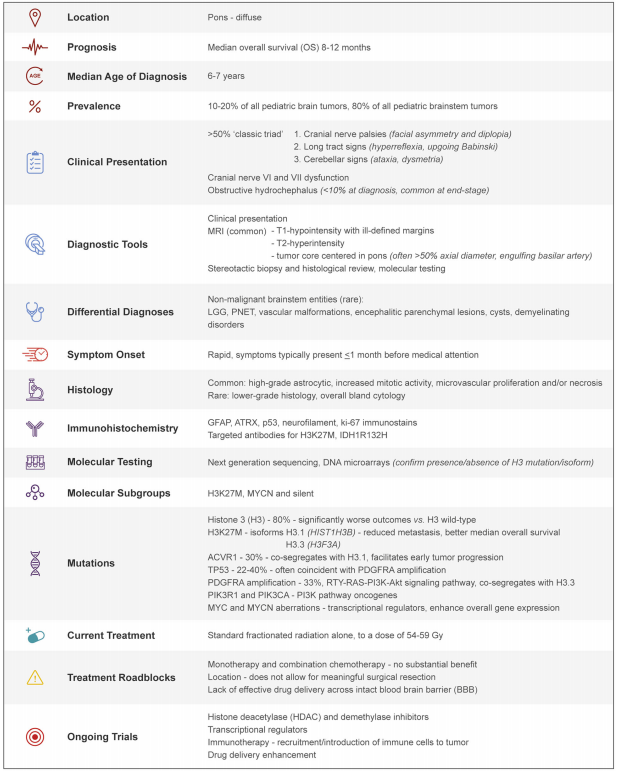
DIPG所有你需要知道的:DIPG 临床病理特征总结
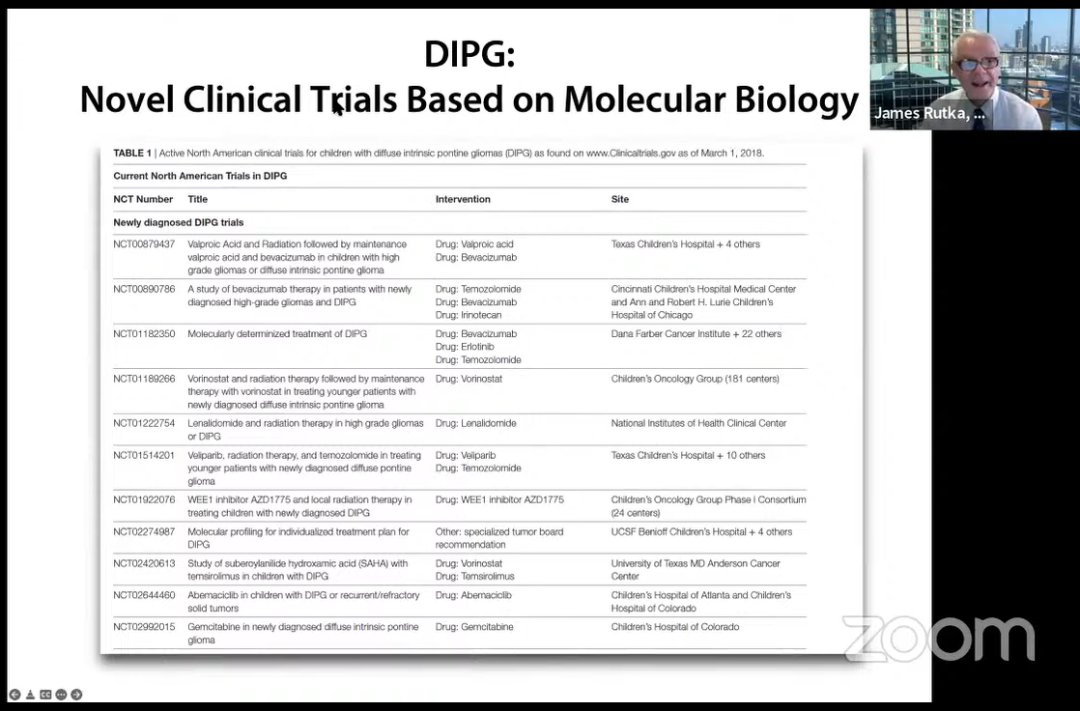
DIPG:基于分子生物学的新临床试验
2、特点:
局限于脑桥的肿瘤
出现颅神经麻痹和长道体征的患者
通常5-7岁
病程后期出现脑积水(脑积水发病较晚)
都是间变性肿瘤
MRI是首选的影像学研究
脑桥弥漫性病变
放疗+化疗
生存12-18个月
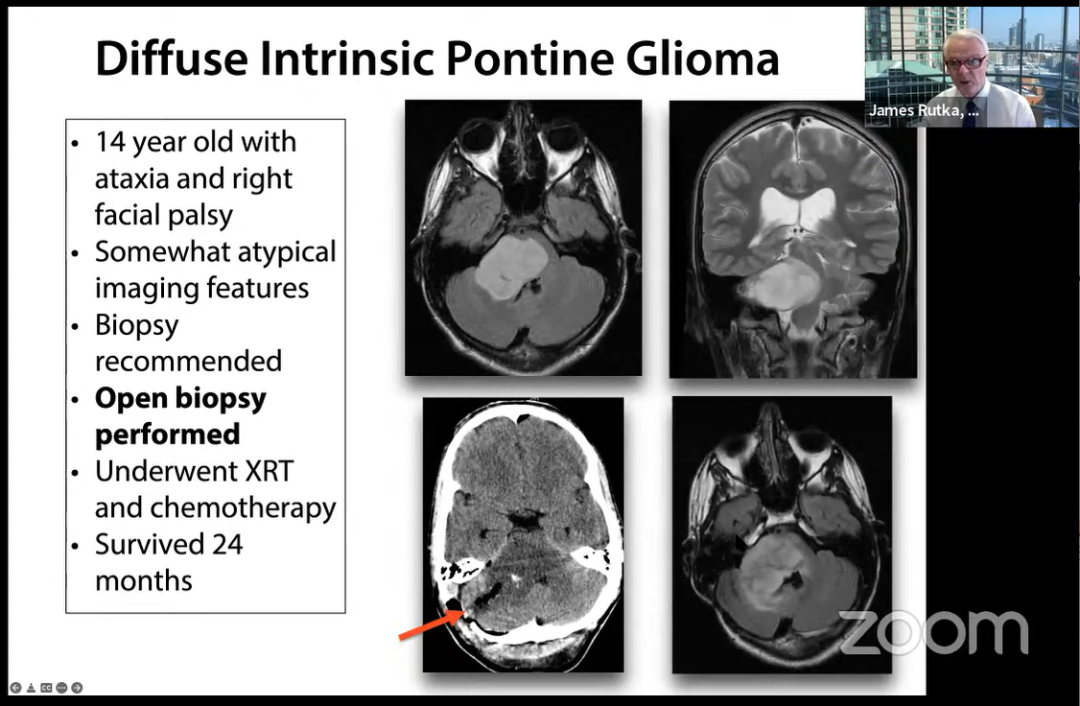
14岁,共济失调和右侧面瘫。进行开放式活检,进行XRT和化疗,幸存24个月。
3.诊断方法:DIPG的诊断常常通过MRI进行。通常,脑桥弥性扩大,占脑干该区域的 50-75% 或更多。可能有外生成分,尤其是腹侧。增强后可能会有强化,但通常是斑片状的,合并脑桥弥漫性肿胀。有时,基底动脉可能完全被肿瘤覆盖(图3)。其他 MR序列和技术已用于DIPG,包括显示较低的平均总胆碱浓度的磁共振波谱成像 (MRS)和弥散张量成像 (DTI) ,但这些在预测病变的神经病理学特点以及结局方面并未被证明是可靠的。
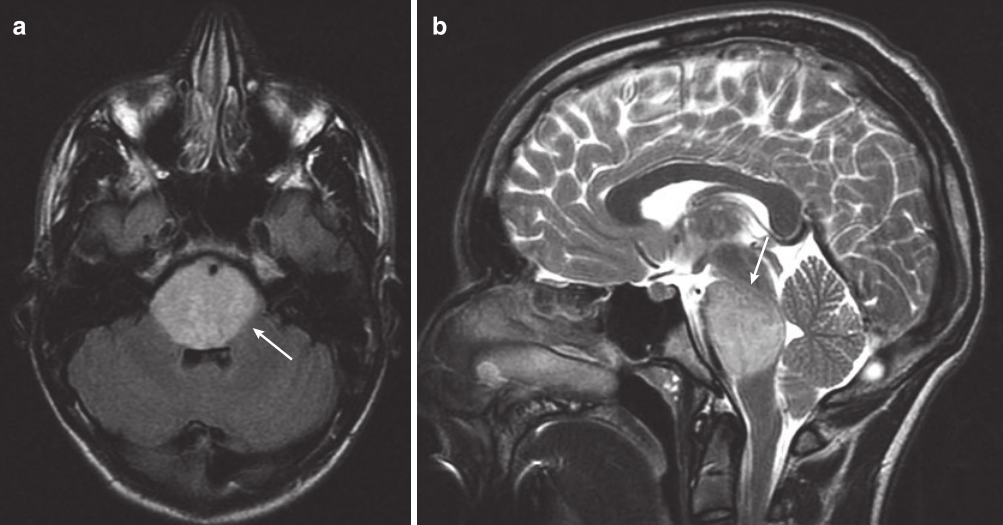
图:一名14 岁男孩的 MRI 扫描,他有短暂的复视、共济失调和左侧面瘫。(a) 轴向FLAIR MRI 显示高信号占据整个脑桥(箭头)。(b) 矢状 T2 MRI 显示DIPG使脑桥范围受累(箭头)
4.临床分类:对于患有DIPG 的儿童,临床没有一致的疾病分期标准。随着疾病的进展,可能会通过软脑膜播种转移到大脑的其他区域或脊髓轴。
5.治疗方法:对于绝大多数患有 DIPG 的儿童,直接手术可能没有作用。此外,多年来,通常的做法是不对 MRI 可以明确肿瘤为典型DIPG的儿童进行病理活检手术,避免额外的神经损伤。影像 MRI 明确诊断为 DIPG 的儿童建议及时进行放射治疗,包括使用 IMRT 调强放疗或超分割放射治疗。现在已经进行了许多临床试验来评估化疗在 DIPG 中的作用。化疗药物如长春新碱,洛莫司汀,泼尼松,顺铂,环磷酰胺,依托泊苷和他莫昔芬都已尝试过,但效果不佳。
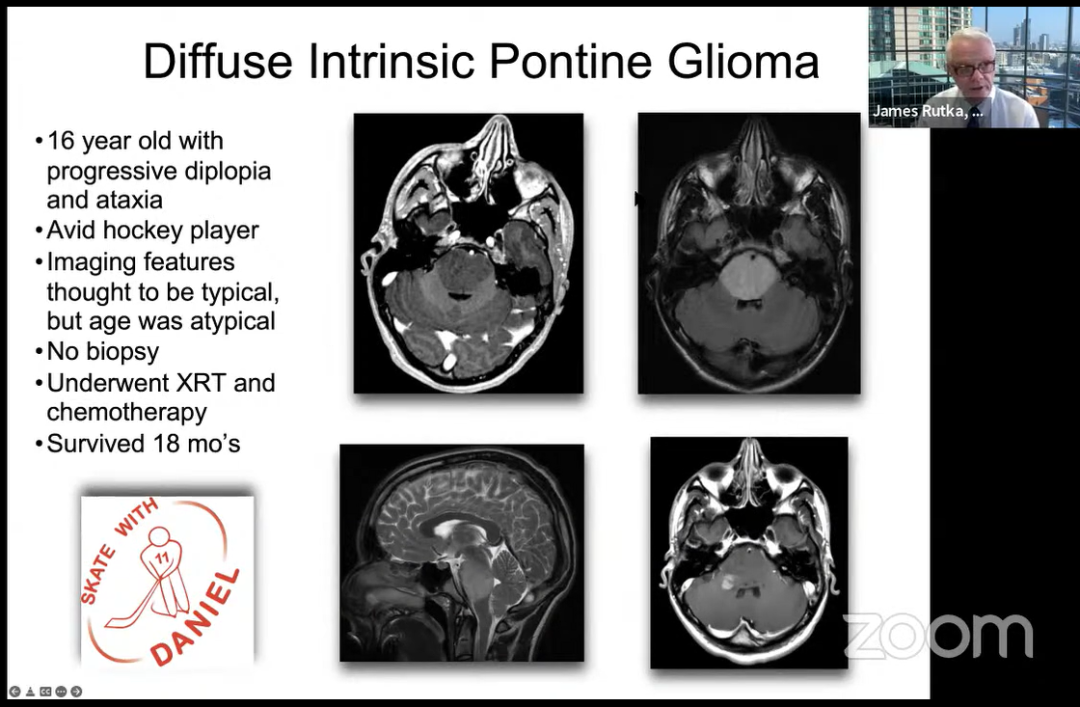
16岁,进行性复视和共济失调。曲棍球运动员,图像特征被认为是典型的,但年龄不典型。无活检,进行XRT和化疗,存活18个月。
认识到某些 DIPG 可能具有非典型特征(例如,10 岁以上的儿童,脑干受累率低于 50% 的横向增强肿瘤),一些中心现在为这些患者提供立体定向活检。立体定向活检可以安全地进行,并可以对新鲜肿瘤标本进行分子遗传学的群体中,有合理的期望发现新的或可靶向的遗传病变。现在正在对患有 DIPG 的儿童进行一些创新的临床试验。Souweidane及其同事最近发表了他们关于使用对流增强递送 (CED) 靶向神经胶质瘤相关 B7-H3 抗原的放射免疫疗法药物以及许多其他靶向药物治疗患有 DIPG 的儿童的发现。他们已经表明,在已经接受过放射治疗的儿童中使用 CED 既安全又可能有效。此外,最近对免疫疗法进行了更进一步的研究。 Benitez-Ribas 等人使用同种异体肿瘤细胞系裂解物脉冲的自体树突状细胞治疗患有 DIPG 的儿童。他们表明,该协议会导致明确的免疫反应,并可能成为未来治疗的有希望的支柱。我们最近表明,在实验模型中,使用磁共振引导聚焦超声 (MRgFUS) 可以增加化疗药物(特别是阿霉素)向脑干的输送。
Rutka教授在其《rainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery》中表示磁共振图像引导聚焦超声(MRgFUS)已被用于实现瞬时血脑屏障(BBB)开放而无组织损伤。数据表明,在MRgFUS用于BBB开放后,脑干组织学和功能完整性得以保持,并且能够显著增强药物输送至该区域的能力,从而有望治疗脑干特异性疾病。


临床前模型:MRgFUS的工作流程
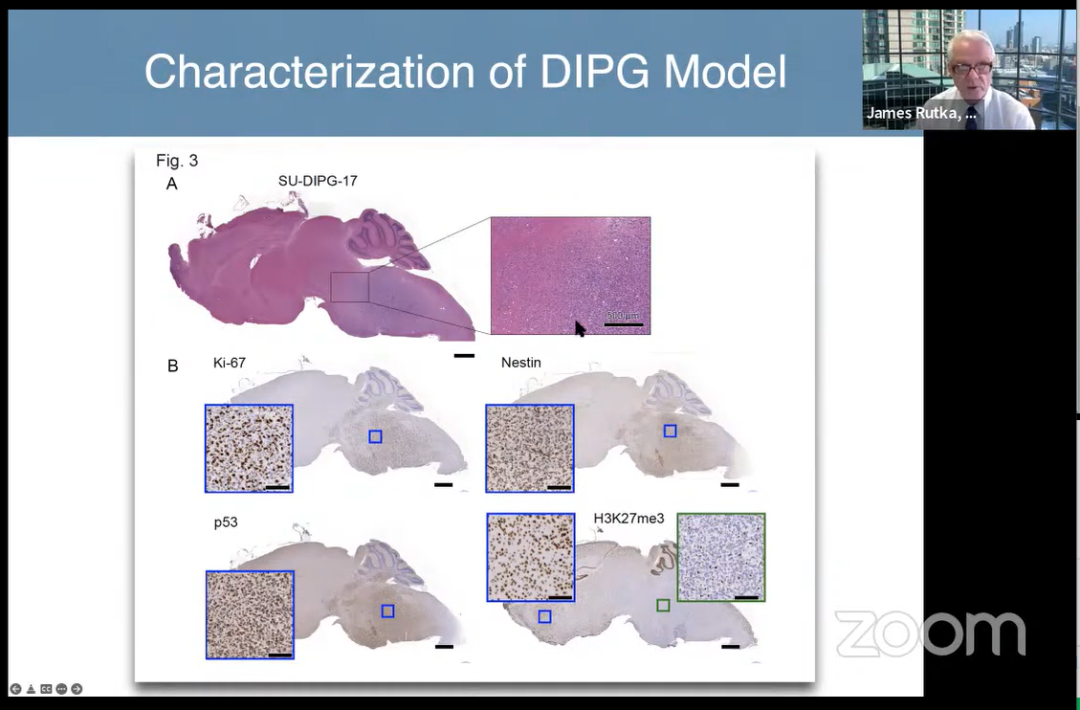
DIPG模型的表征
Rutka教授在其《MRI-guided focused ultrasound enhances drug delivery in experimental diffuse intrinsic pontine glioma》论文中展示了一种实验模型——使用磁共振引导聚焦超声 (MRgFUS) 可以增加化疗药物(特别是阿霉素)向脑干的输送。


DIPG 小鼠模型表现出不同程度的 BBB 渗透性
6、DIPG未来的治疗方向:DIPG 有多种对未来有希望的治疗途径。这些包括靶向疗法、基因疗法和免疫疗法。
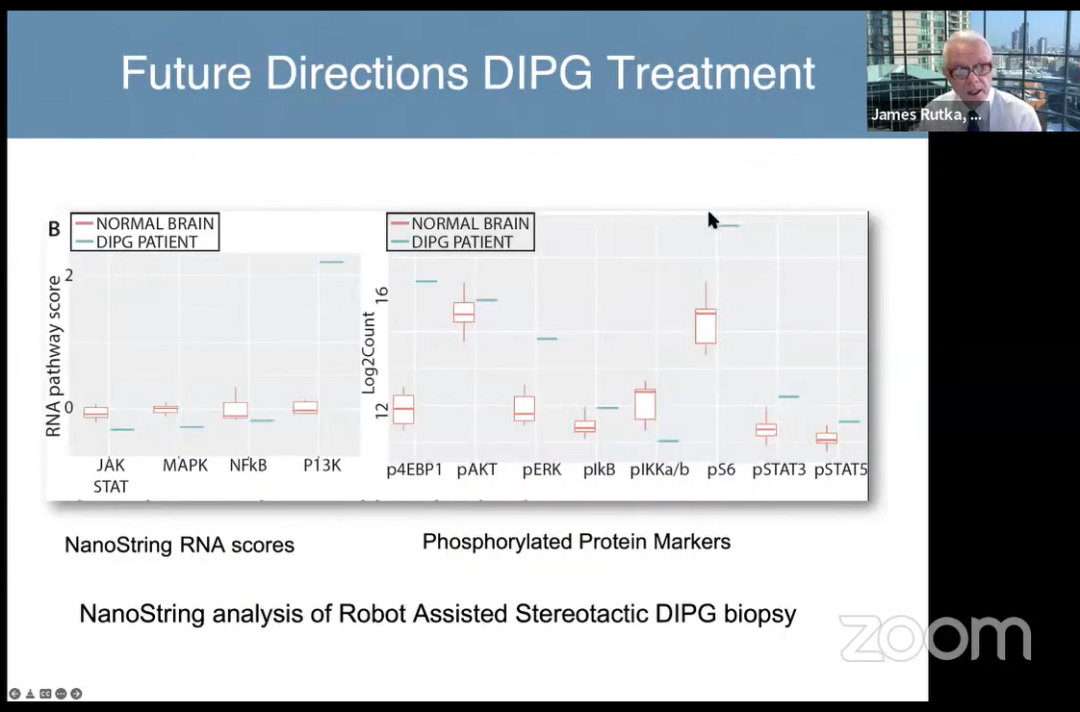
机器人辅助立体定向DIPG活检
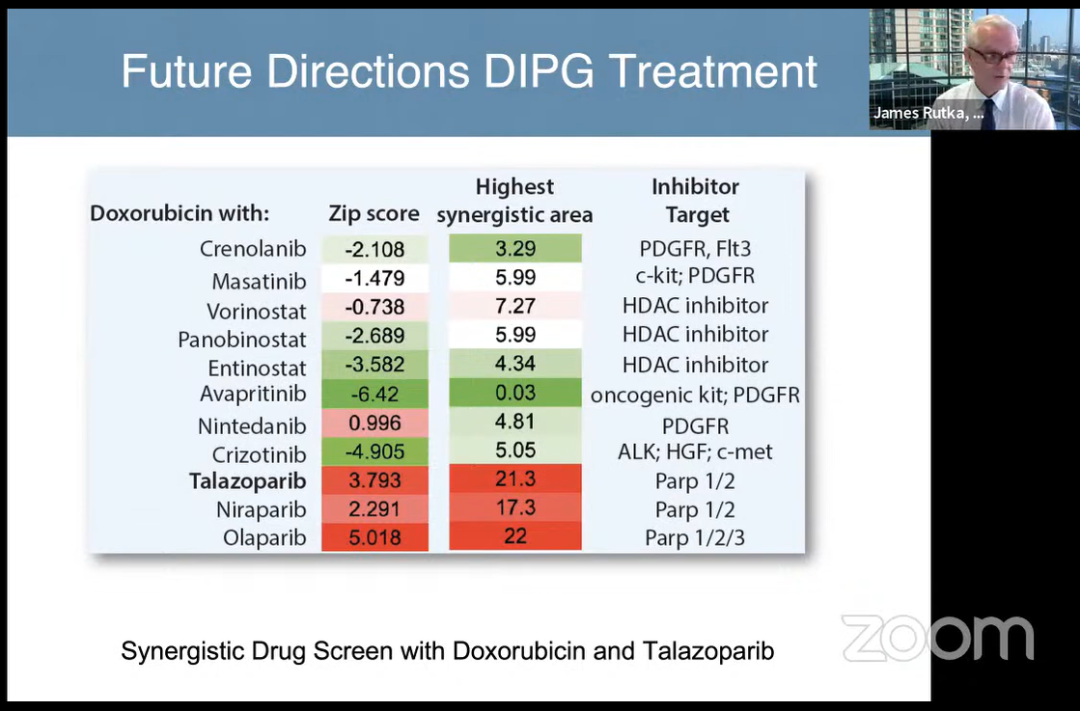
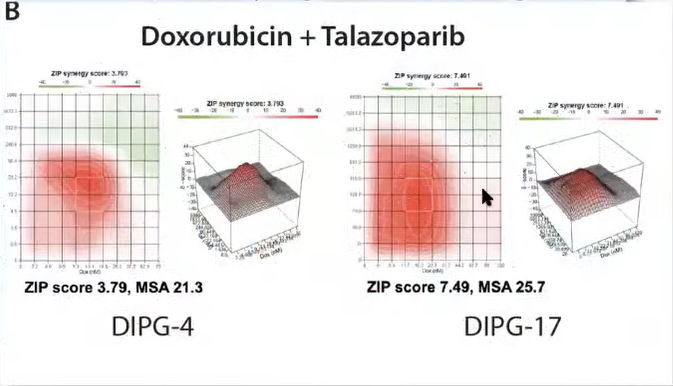
阿霉素和他拉唑帕尼协同药物筛选
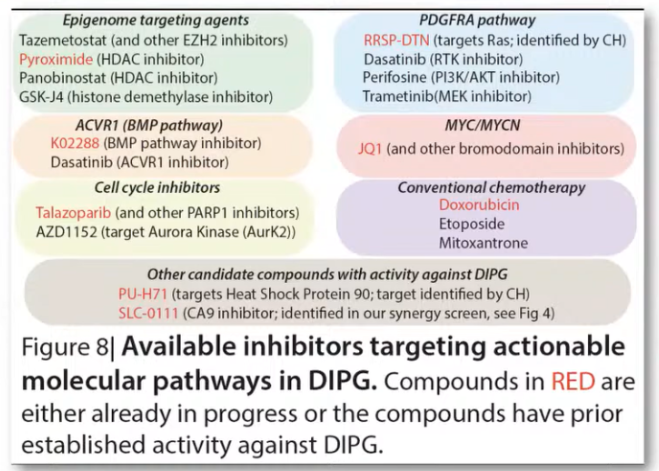
图8:针对DIPG中可操作分子途径的可用抑制剂。RED中的化合物要么已经在进行中,要么这些化合物已经对DIPG具有预先确定的活性。
脑干—延髓颈髓肿瘤
延髓-颈髓胶质瘤(CMG)
1、定义:延髓-颈髓胶质瘤是在颅椎交界处周围进展的髓内肿瘤。它们是罕见的、生长缓慢的组织学良性肿瘤,通常表现为多种神经系统症状,包括下脑干功能障碍和脊髓病。肿瘤位于延髓-颈髓区域的患者通常会出现恶心、呕吐、生长迟缓、下颅神经功能障碍、慢性误吸、睡眠呼吸暂停和阻塞性脑积水。位于上颈髓的肿瘤会导致用手习惯、步态的改变和运动功能退化,尤其是在年轻患者中。它们还可能导致低反射/反射亢进和面部疼痛。然而,独立于解剖起源,随着肿瘤的扩大,患者会出现这些体征和症状的混合表现。
2.诊断方法:无论位置如何,延髓-颈髓胶质瘤都具有临床、影像学和病理学的相似性。MRI用作初始诊断工具,手术中的组织诊断成为最终病理诊断。在 MRI 上,大多数延髓-颈髓胶质瘤白质呈低信号。在 T2 和质子密度图像上,白质呈高信号。在矢状位 MRI 上,延髓-颈髓胶质瘤从延髓的尾部三分之二延伸到延髓-颈髓的喙侧。它们往往会在造影剂给药后迅速强化。延髓-颈髓胶质瘤通常是低级别肿瘤,可能是神经胶质瘤或神经节胶质瘤。有时,在这些肿瘤中可能会发现间变性改变。
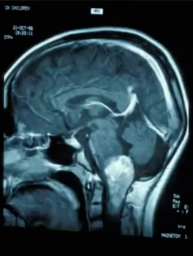
14岁男孩,复发性肺炎,嘶哑的声音,第十一神经麻痹,眼球震颤,共济失调。
3.临床分类:延髓-颈髓胶质瘤没有标准分类系统。由于大多数这些肿瘤是低级别的,它们倾向于沿着脑膜局限性包裹性生长,并随着白质束走形而呈现不同生长形态。因此,锥体交叉纤维和内侧丘系限制了它们向脑桥和延髓交界处的侵犯扩散,而是促使它们向第四脑室生长。这种生长限制随后会导致明确的肿瘤边界,从而使外科医生更容易切除。
4、治疗方法:虽然对这些肿瘤的常规治疗是通过手术切除,但已经有大量关于放疗和化疗作为手术辅助手段的作用的讨论。手术的作用是必不可少的,因为它能够实现通过组织活检做出诊断和通过脑干和颈椎的减压来治疗相关的脊髓空洞等。然而,由于肿瘤的边界不清或不可接受的神经功能缺损的风险,因此全切通常是不可能的。超声、术中MRI、立体定位和神经生理监测等有价值的工具有助于实现最大程度的切除。
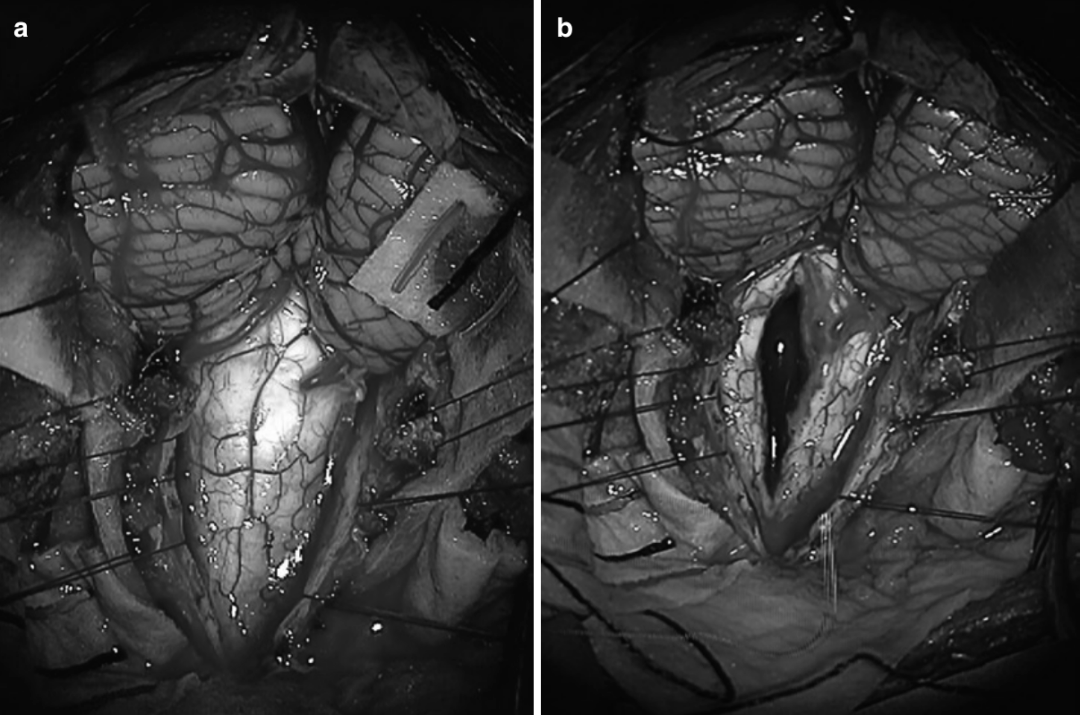
图:延髓-颈髓胶质瘤的术中照片图,(a)后颅窝开颅后,可见延髓-颈髓胶质瘤,在连续的术中神经电生理(IONM)监测下,使用CUSA超声刀切除了肿瘤。(b) 显示肿瘤切除后的即时照片,显示脊髓后正中线切开和延髓-颈髓胶质瘤的切除。
如前所述,大多数情况,手术是必须要考虑的治疗方式,如果没有手术指征,放射治疗 (RT) 被认为是延髓-颈髓胶质瘤的一种可选治疗方式,它可作为低级别病变的初始治疗或补救治疗,并且对于不适合手术切除的恶性肿瘤,也可考虑用于与化疗联合的初始治疗。
更保守的手术方法可能适用于在非强化病变中表现出强化的肿瘤组织延髓-颈髓肿瘤,而这些与正常延髓和/或延髓和/或轮廓不清的肿瘤/脑干相连续,MRI上表现为从明显的肿瘤延伸到脑干的异常T1信号。当这些表现出现在 MRI 上时,建议化疗和/或放疗可能是更好的治疗方式,能相对提供更好的生存和预后疗效。
5.复发进展性脑干延髓-颈髓治疗:单独的化疗通常不被认为是标准的治疗模式,而对于一些复发性或进展性的肿瘤来说,化疗可以作为一种辅助治疗与手术或补救性治疗相结合的治疗方式。有趣的是,基于这些肿瘤的特定分子特征,有大量的研究重点放在开发新颖的、有针对性的靶向或基因治疗方法上。目前已经阐明了关键的肿瘤分子标志物/通路,包括 ERK/MAPK 通路的激活和高频 KIAA1549-BRAF基因融合的鉴定。某些CMG 子集也已知表达BRAFV600E突变。ERK/MAPK通路提供了一个强大的 MEK 抑制剂靶向治疗领域,为无法接受最大程度切除或不希望接受最大程度切除手术的患者提供了一种潜在的替代治疗方式。因此,作为延髓-颈髓胶质瘤的未来治疗方法,开发有效靶向治疗的潜力巨大。
6、预后/生存质量:延髓-颈髓胶质瘤通常是低级别病变,因此具有良好的总体生存率。然而,他们的复发率高,需要长期随访才能最大限度地提高总生存率和神经功能。从本质上讲,这些肿瘤使患者走上了导致逐步恶化的慢性疾病途径。当然,目标是最大限度地切除肿瘤,最大限度地减少长期神经系统并发症,并随着时间的推移提高整体生活质量。有趣的是,已经表明,诊断前症状持续时间较长的患者通常患有低级别肿瘤,总体生存期较长的可能性很高。最后,据报道颈椎矢状面畸形是儿童接受髓内脊髓肿瘤出现手术的主要风险因素,这也包括延髓-颈髓胶质瘤。有时,可能需要进行枕颈融合手术。
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


