TRP通道在炎症性皮肤病中的作用
时间:2023-08-01 11:26:55 热度:37.1℃ 作者:网络
瞬时受体电位(transient receptorpotential,TRP)通道超家族是广泛表达于多种细胞膜的一类重要的非选择性阳离子通道,接受温度、光、机械损伤、化学物质、细胞因子、渗透压和pH值改变等刺激,介导钙离子为主的阳离子内流,发挥多种生理病理功能。
TRP通道在皮肤多种细胞表达,包括感觉神经细胞、角质形成细胞、黑素细胞和免疫炎症细胞等,参与感觉、皮肤稳态调节、黑素合成、创面愈合等生理过程,也参与免疫炎症、瘙痒疼痛、屏障受损和皮肤癌变等病理过程。TRP通道家族具有功能多样性且有药理学上可结合的位点,使其有望成为皮肤疾病的治疗靶点。近年来大量研究表明,TRP通道与玫瑰痤疮、特应性皮炎、银屑病等炎症性皮肤病的发生发展有密切联系。
与炎症性皮肤病密切相关的TRP通道
皮肤血管炎在临床上并不少见,研究结果显示年发病率39.6/百万~59.8/百万,另有研究发现年发病率为15.4/百万~29.7/百万,女性稍多,成人多于儿童(过敏性紫癜和婴幼儿急性出血性水肿除外),平均发病年龄约47岁。皮肤血管炎可能的病因包括感染(乙型肝炎病毒、单纯疱疹病毒、细小病毒B19、链球菌、葡萄球菌、分枝杆菌等)、药物(抗生素、抗癫痫药、非甾体类消炎药、利尿剂等)、系统性炎性疾病(结缔组织病、炎症性肠病、冷球蛋白血症等)和肿瘤(主要是血液系统肿瘤和实体瘤)。
根据蛋白的氨基酸序列和拓扑结构差异,TRP通道在哺乳动物中被分为六个亚家族: 经典瞬时受体电位(TRP canonical,TRPC)、瞬时受体电位香草酸亚型(TRP vanilloid,TRPV)、瞬时受体电位锚蛋白(TRP ankyrin,TRPA)、M型瞬时受体电位 (TRP melastatin,TRPM)、多囊蛋白类瞬时受体电位(TRP polycystin,TRPP)和黏脂质类瞬时受体电位(TRPmucolipin,TRPML)。
TRPV家族是能被香草醛、香草酸等激活的热感受TRP通道,有6个成员,其中TRPV1-4是非选择性阳离子通道,在许多神经元及非神经元细胞均有表达,可感知并转导伤害性信号。
TRPV1被43摄氏度以上、辣椒素、酸、前列腺素和组胺等激活,在神经元中常与TRPA1共表达整合伤害性刺激,诱发神经源性炎症;TRPV1与TRPA1也出现在角质形成细胞、黑素细胞、肥大细胞和树突状细胞中,起加强炎症、调节表皮细胞生长分化、促黑素生成等作用。TRPV2在高于52℃、渗透压刺激和机械拉伸时被激活,也参与炎症反应,但确切功能有待进一步研究。TRPV3在超过34摄氏度时被激活,也可被樟脑、前列腺素E2、三磷酸腺苷、缓激肽和组胺等激活,参与促炎信号转导、表皮屏障修复和毛发生成等作用。TRPV4在高于27℃、机械刺激、低渗条件和花生四烯酸代谢产物等作用下被激活,与急慢性瘙痒有关,角质形成细胞的TRPV4亦参与皮肤屏障的形成和修复
TRPA1是哺乳动物TRPA家族的唯一成员,低于17℃时被激活,还可由机械刺激、香料化合物及内源性炎症介质等激活。感觉神经元的TRPA1介导神经源性炎症,非神经元细胞的TRPA1也参与部分炎症和瘙痒的诱导。哺乳动物TRPM家族有8名成员,TRPM8是冷觉的主要感受器,低于22摄氏度时被激活,是薄荷醇的受体。TRPM8也同时存在于神经元和角质形成细胞、血管内皮细胞等非神经元细胞,激活TRPM8可抑制皮肤炎症、参与冷暖感觉、调节血管收缩、促进皮肤屏障修复等。
不同的炎症性皮肤病中TRP通道的作用
TRP通道与玫瑰痤疮
玫瑰痤疮是一种常见的炎症性皮肤病,表现为面部潮红、毛细血管扩张和面中部炎性丘疹脓疱、肥大增生,其诱因包括日晒、冷热刺激、酒精、辛辣食物、运动等。玫瑰痤疮发病机制尚未完全阐明,固有免疫异常、皮肤微生物群失衡、神经血管失调等可能与之相关。
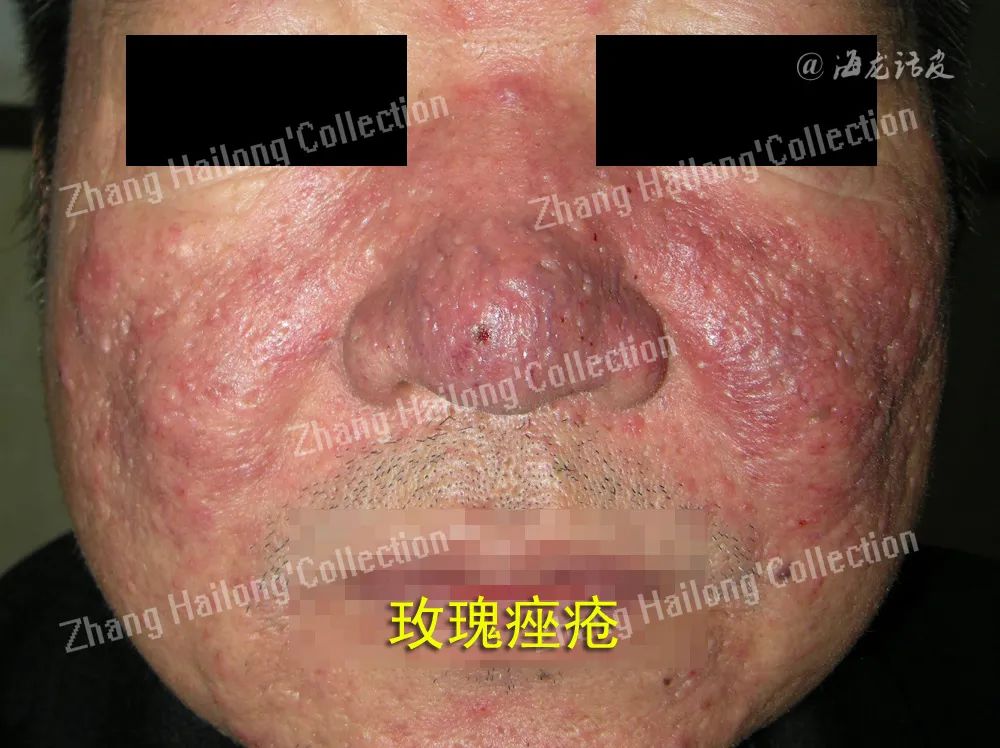
研究发现,玫瑰痤疮患者皮损处感觉神经元、角质形成细胞、血管内皮细胞及免疫细胞中TRP通道密度均较健康皮肤增加,引起玫瑰痤疮患者面部敏感的温度和化学刺激阈值降低。玫瑰痤疮皮损中高表达的TRPV1和TRPA1等受体被各种刺激激活后引起感觉神经末梢释放P物质和降钙素基因相关肽等介质,诱发神经源性炎症,引起血管功能失调和伤害性感受。
在抗菌肽LL-37诱导的玫瑰痤疮小鼠模型中,TRPV2和TRPV4也出现高表达,LL-37可激活蛋白偶联受体Mas相关基因X2,其通过白喉毒素敏感的G蛋白受体激活TRPV2和TRPV4,使两者在肥大细胞中表达增加,大量阳离子内流,诱发肥大细胞脱颗粒释放炎症和神经介质,抑制TRPV2和TR-PV4则可抑制肥大细胞功能,减轻玫瑰痤疮的炎症和痛痒感觉。
TRPV3在玫瑰痤疮所有亚型中表达均增加,通过调节角质形成细胞和肥大细胞功能参与炎症和伤害性感受,通过诱导成纤维细胞的免疫反应参与在肥大增生型玫瑰痤疮的纤维化增生。因此,TRPV1-4和TRPA1通道的失调均可能参与玫瑰痤疮的发病机制,有望成为其治疗的作用靶点。
TRP通道与特应性皮炎
特应性皮炎(atopicdermatitis,AD)是一种慢性复发性炎症性皮肤病,临床表现为皮肤干燥瘙痒及复发性湿疹样皮损。AD病因尚未完全阐明,可能与遗传、环境、皮肤屏障破坏和免疫异常等有关。
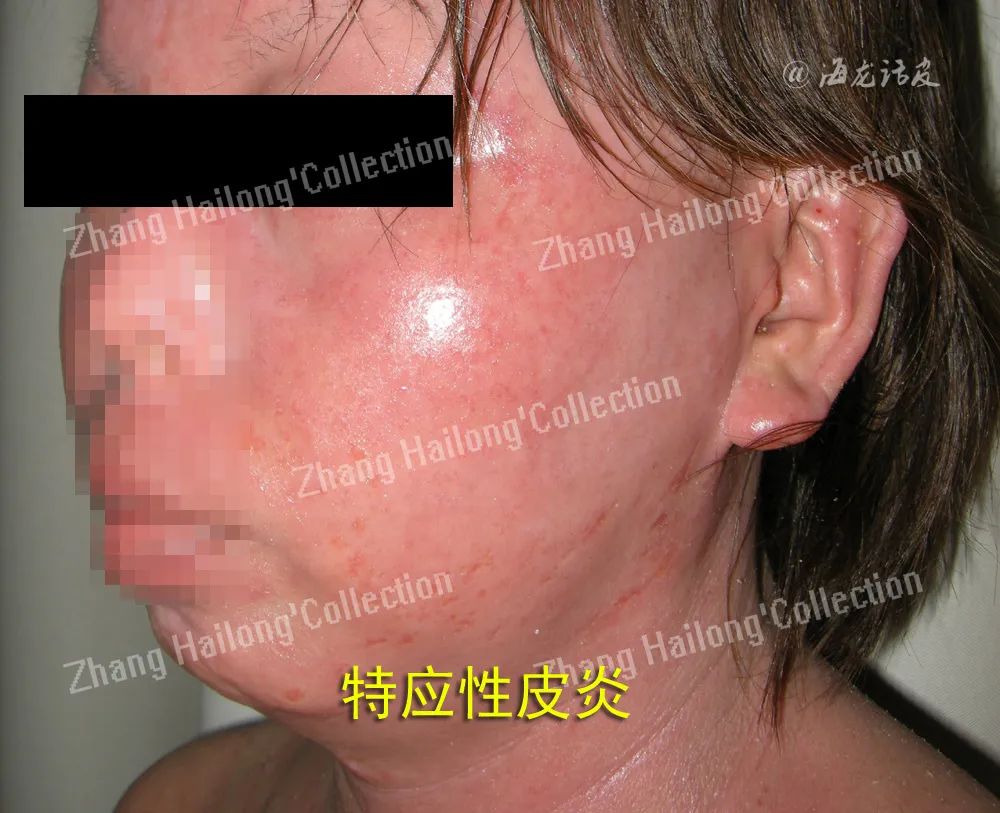
多种TRP通道均与AD发病机制相关。AD患者皮损中TRPA1和TRPV1表达明显高于对照组。在体内体外实验中阻断TRPV1,不仅加速皮肤屏障功能恢复,还可缓解多种皮炎表现,包括皮肤红肿、小鼠搔抓行为、血清IgE升高和肥大细胞脱颗粒等。
另有研究发现,多种Th2细胞因子通过TRP通道介导AD: IL-13可增强TRPV1和TRPA1的表达引发小鼠搔抓;IL-31在AD皮损中显著升高,通过激活TR-PA1、TRPV1和TRPV3诱导瘙痒;胸腺基质淋巴细胞生成素可激活AD患者皮肤感觉神经元的TRPA1,增加其表达,提示干扰Th2免疫反应对TRP通道的调控可能有助于治疗AD。葡糖鞘氨醇是一种内源性鞘脂,在AD患者表皮中有大量积累,研究发现其可通过小鼠感觉神经元中的5-羟色胺受体和TRPV4受体介导瘙痒。
TRP通道与银屑病
银屑病是一种常见的慢性炎症性皮肤病,典型表现为皮肤境界清楚的红色斑块上覆厚层银白色鳞屑。其确切病因尚不清楚,可能由遗传、内外环境、免疫因素等相互作用所致。
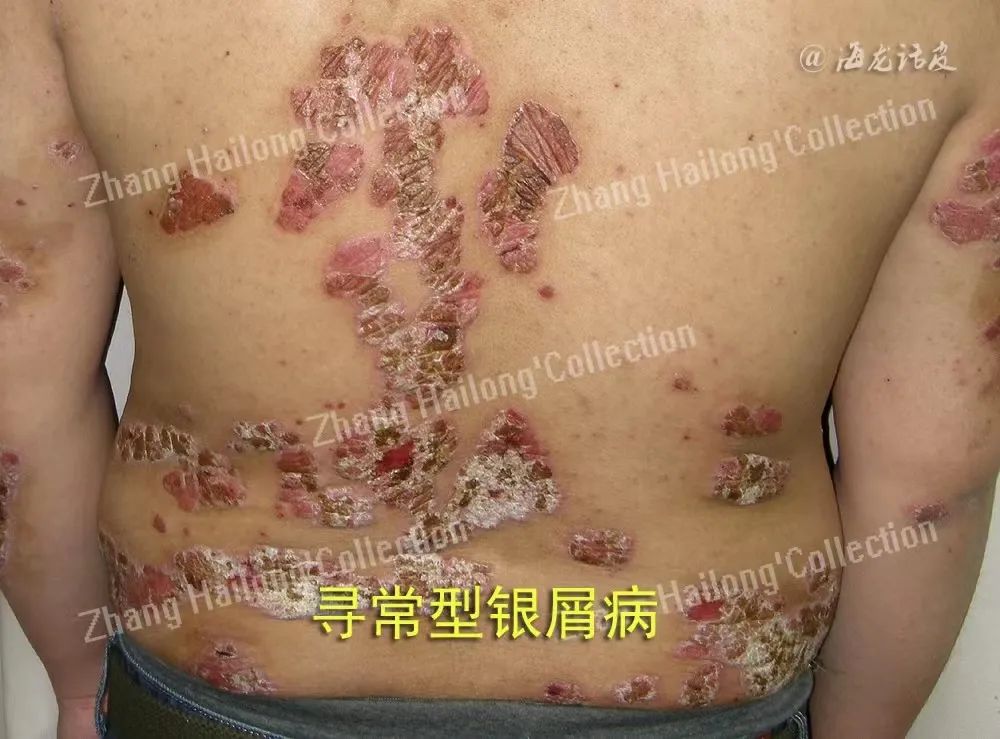
多种TRP通道与银屑病的发生发展相关。TR-PA1、TRPV1和TRPV3在银屑病皮损中过表达且与瘙痒程度正相关,进一步研究发现TRPV1敲除组和TRPA1敲除组相较对照组银屑病小鼠的银屑病临床评分、经表皮水分丢失评分、表皮增生程度、Munro微脓肿面积和血管增生均显著降低,皮肤炎症和屏障受损减轻;TRPV1敲除组和TRPA1敲除组皮损处CD45+白细胞、肥大细胞和CD3+T细胞浸润均减少,炎症因子IL-1β、IL-6、IL-23表达水平降低,提示TRPV1与TRPA1在银屑病样炎症中发挥关键作用。
但有研究发现相反的结果,在银屑病小鼠中抑制TRPA1后银屑病样皮炎表型增加,提示TRPA1可能也介导银屑病样皮炎的保护作用。TRPV3参与银屑病的炎症、瘙痒和皮肤屏障功能异常。TRPV4也调节皮肤屏障功能,参与角质形成细胞的增殖分化,同样参与了银屑病的发病。
TRP通道与其他炎症性皮肤病
TRP通道还在其他多种炎症性皮肤病中发挥重要作用。
TRP通道介导接触性皮炎:氢醌在临床上多用于美白,但易引起皮肤刺激,研究发现TRPA1是氢醌引起皮肤刺激的靶点。类似的,甲苯、二甲苯、肉桂醛等也通过刺激TRPA1引起接触性皮炎。TR-PA1在接触性皮炎相关的炎症反应和瘙痒的免疫与神经机制整合中起重要作用,抑制TRPA1可减轻皮炎的水肿和瘙痒疼痛。除TRPA1外,TRPV1也介导接触性皮炎,两者都可直接激活瘙痒受体引发搔抓。但有趣的是,TRPV1也可通过调节巨噬细胞免疫抑制皮肤炎症。
冻伤是皮肤暴露于寒冷环境中长期血管收缩导致的皮肤缺血和潜在不可逆损伤。皮肤微血管系统中的TRPA1和TRPM8可作为血管冷感受器调节血管收缩,参与皮肤冻伤的形成。
卟啉症患者暴露阳光下会产生灼痛,接受光动力治疗的患者也会产生类似的疼痛而限制治疗。研究发现,紫外线和蓝光可激发卟啉或光敏药物产生单线态氧,经氧化的TRPA1和TRPV1光敏性显著提高,导致TRP通道依赖的促炎神经肽释放,使用TRPA1或TRPV1拮抗剂可有效缓解灼痛。
与炎症性皮肤病相关的TRP通道激动剂和抑制剂
TRP通道激动剂
冷感觉可以减轻瘙痒,因此激活TRPA1和TRPM8有助于缓解瘙痒。研究发现,皮内注射TRPA1激动剂可显著抑制内皮素-1引起的小鼠搔抓。U73122是一种磷脂酶C抑制剂,近来发现其也是一种TRPA1强效选择性激动剂,为TR-PA1靶向药物的开发提供了新思路。大麻类药物可作用于TRP通道受体,调节皮肤炎症、疼痛和瘙痒,使用大麻类药物WIN55,212-2处理大鼠三叉神经节可激活神经元中的TRPA1,引发细胞外钙离子内流,激活钙调磷酸酶,导致TRPV1去磷酸化而脱敏,从而抑制炎症性疼痛,提示大麻类药物可通过激活TRPA1减轻神经元性炎症及组织损伤。
TRPM8是由冷和薄荷醇激活的离子通道,激活TRPM8可同时抑制组胺依赖和非依赖的瘙痒通路。他克莫司是一种大环内酯类免疫抑制剂,研究发现其部分抗过敏和止痒作用是通过激活TRPM8实现的。百里香酚也可通过激活TRPM8治疗银屑病小鼠,注射药物后皮损处中性粒细胞、树突状细胞和Th17细胞浸润减轻,促炎因子减少,银屑病样皮损及瘙痒症状缓解。一种 TRPM8激动剂Cryosim-1的外用凝胶已进入临床试验,随机双盲对照试验提示该药物可迅速控制患者瘙痒症状,给药后10min内起效,2h后仍有作用,对迅速缓解荨麻疹等瘙痒性疾病十分有效。
辣椒素是一种外用TRPV1激动剂,可激活TR-PV1并使其脱敏,长期以来被用于治疗各类皮肤炎症、疼痛和瘙痒,但辣椒素激活TRPV1带来的灼烧感降低了患者的依从性,且由于辣椒素消除能力差,在皮肤长期积累可能诱发癌变,目前越来越多靶向调节TRPV1的新药正在研发中,发挥疗效的同时减少辣椒素的不良反应。
TRP通道抑制剂
TRPV1可接受多种刺激,是疼痛通路中的重要传感分子,已有诸多关于TRPV1抑制剂的研究。AG1529是正在研究的辣椒素类似物外用软膏,通过抑制TRPV1缓解皮肤炎症及瘙痒,由于不产生热效应,且皮肤酯酶可使其失活从而避免皮肤积累,动物实验也无明显刺激反应,因此对局部治疗瘙痒性炎症性皮肤病有良好的临床潜力。Re-solvinsD3也是一种TRPV1抑制剂,在银屑病小鼠中,单次系统给药特异地降低TRPV1依赖的急性疼痛和瘙痒,反复系统给药显著降低神经元中降钙素基因相关肽的表达,减少银屑病样炎症。
目前有部分TRPV1拮抗剂已进入临床试验,如PAC-14028,可缓解皮肤瘙痒和炎症,修复皮肤屏障,已完成局部治疗皮肤瘙痒、玫瑰痤疮和AD的II期临床试验。除化学药物外,物理治疗也可经TRPV1通道发挥疗效,射频辐照在体内体外的玫瑰痤疮模型中均可减少TRPV1活化及神经肽释放,减轻神经肽诱导的巨噬细胞活化和炎症分子表达,从而减轻TRPV1相关的烧灼感。虽然有大量关于TRPV1拮抗剂的研究,但多数因提高患者的热疼痛阈值导致体温过高而被终止,寻找没有这种不良反应的新分子是目前开发新TRPV1靶向药的核心。
TRPA1拮抗剂在研发中尚未发现重大安全问题,逐渐受到关注。GRC17536是一种高效且可口服利用的TRPA1拮抗剂,体内实验证实了其缓解炎症性和神经性疼痛的作用,已进入II期临床试验。此外,还有多种TRPA1拮抗剂已申请专利并进入临床试验,包括ODM-108、HX-100、GDC-0334和CB-625等,然而由于以TRPA1为靶点的药物开发存在诸多药物和药代动力学并发症,许多研发都已停止,因此对于具有良好药代动力学的TRPA1拮抗剂还需进一步研究。
目前,靶向TRPV3的拮抗剂也受到越来越多关注。香豆素蛇床子素是蛇床子属植物的主要活性成分,常用于治疗皮肤炎症瘙痒,研究发现蛇床子素通过选择性抑制TRPV3发挥作用。最近发现一种天然化合物连翘酯苷B,体内体外实验都证实其能够特异地抑制过度活跃的TRPV3,具有治疗慢性瘙痒症、皮肤过敏或炎症相关皮肤病的潜力。Han等纯化鉴定了一种吖啶酮生物碱citrusinine-II,是TRPV3的选择性强抑制剂,对急慢性瘙痒均有缓解作用,小鼠皮内注射几乎完全抑制瘙痒行为,同时具有镇痛作用,未发现明显副作用,该研究目前已申请专利。
此外,关于TRPV4通道的靶向药物也有一些研究。克罗米通是一种常用的止痒剂,研究发现其止痒作用是通过抑制TRPV4实现的。升麻素是一种中药常用的止痒剂,呈剂量依赖地特异性抑制TRPV4相关的急性瘙痒,减轻银屑病小鼠搔抓行为。
另还有一些非选择性TRP通道抑制剂。柠檬醛对TRPV1-3和TRPM8具有持久抑制效果,同时可暂时阻断TRPV4和TRPA1。钌红是一种水溶性聚阳离子染料,也是一种非选择性TRP拮抗剂。但目前这些非特异性通道阻滞剂已逐渐被更具选择性的TRP拮抗剂所取代。
小结
炎症性皮肤病在人群中发病率高,由于长期反复且伴有痛痒的特点,严重影响人们的生活质量。研究这类疾病的发病机制及开发相应治疗药物十分有意义。TRP通道在人类皮肤的多种细胞均有表达,通过引起细胞外钙离子为主的阳离子内流广泛参与皮肤生理病理过程,调控玫瑰痤疮、银屑病、AD、接触性皮炎等炎症性皮肤病的发生发展。
近年来靶向TRP通道的药物研究正逐渐增多,可据此开发抗炎止痒药物、研究相关的离子通道疾病,具有广阔前景。但由于目前TRP通道在皮肤中的具体作用机制尚未完全明确,靶向激活或抑制TRP通道的药物在缓解炎症瘙痒的同时常出现诸多药物不良反应和药代动力学并发症。未来还需对TRP通道各亚型在皮肤不同类型细胞中的调控机制、TRP通道靶向药物在疾病模型与实际临床疾病中应用的差异、系统应用TRP通道调节剂时对其他组织的影响等问题进行更加深入的研究。
参考文献:
[1]洪安澜,林彤.TRP通道在炎症性皮肤病中的作用[J],中国麻风皮肤病杂志, 2023,39(2):129-133.
[2]Caterina M,Pang Z.TRP channels in skin biology andpathophysiology[J].Pharmaceuticals,2016,9(4) : 77.
[3]Jia Q,Tian W,Li B,et al.Transient receptor potential channels,TRPV1 andTRPA1 in melanocytes synergize UV-dependent and UV-independent melanogenesis[J].Br JPharmacol,2021,178(23) : 4646-4662.
[4]Sato M,Sato T,Yajima T,et al.The transient receptor po-tential cation channel subfamily V members 1 and 2,P2X purinoceptor 3 and calcitonin gene-related peptide in sensory neurons of the rat trigeminal ganglion,innervating the perios-teum,masseter muscle and facial skin[J].Arch Oral Biol,2018,96: 66-73.
[5]更多参考文献略。


