STTT:有望成为新型抗肝癌药物!广州医科大学李斌团队揭示蛋白翻译后修饰促进肝癌进展机制
时间:2023-01-10 18:01:29 热度:37.1℃ 作者:网络
肝细胞癌(Hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一。目前迫切需要明确HCC发生发展的潜在机制,并探索新的治疗药物。
2023年1月9日,广州医科大学李斌团队在Signal Transduction and Targeted Therapy 杂志在线发表题为“Blockade of NMT1 enzymatic activity inhibits N-myristoylation of VILIP3 protein and suppresses liver cancer progression”的研究论文,这项研究旨在研究N -肉豆蔻酰转移酶1 (NMT1)介导的Visinin-like protein 3 (VILIP3) 肉豆蔻酰化的调控和功能,并研究地氯雷他定(desloratadine)作为单一药物或联合索拉非尼在体外和体内抑制HCC进展方面的抗癌特性。
总之,这项研究表明地氯雷他定可能是一种新型的抗癌药物,NMT1介导的肉豆蔻酰化有助于HCC的进展,是HCC潜在的生物标志物和治疗靶点。

作为最常见的肝癌类型,肝细胞癌(HCC)预后差,是全球癌症相关死亡的第四大原因虽然手术切除和移植用于治疗早期HCC,但大多数患者在晚期才被诊断出来索拉非尼(sorafenib)和乐伐替尼(lenvatinib)是治疗肝癌的一线药物,美国食品和药物管理局(FDA)于2017年批准瑞格非尼(regorafenib)用于治疗索拉非尼耐药的肝癌患者。尽管近几十年来化疗有所改善,但患者生存期差仍然是当前癌症治疗的主要问题。尽管索拉非尼和瑞格拉非尼的发展,但由于耐药和肿瘤复发,HCC的总生存率仍然很低。因此,迫切需要寻找具有抗肿瘤疗效和低毒的肝癌患者潜在治疗药物
药物再利用是指在原有药物适应症之外开发新用途的过程。与针对特定适应症开发新药相比,药物再利用策略具有多方面的优势。例如,失败率更低,药物开发所需的时间更少,货币成本也降低了在本研究中,基于由419种FDA批准的药物组成的小分子文库,该研究确定地氯雷他定为治疗HCC的候选药物。地氯雷他定是一种口服活性H1受体拮抗剂,常用于治疗过敏然而,它在癌症治疗中的潜在作用尚不清楚。
地氯雷他定发挥抗肿瘤作用的机制仍有待探讨。为此,采用综合药物亲和反应靶稳定性(drug affinity responsive target stability,DARTS)和基于质谱的蛋白质组学技术鉴定靶蛋白。N-肉豆蔻酰转移酶1 (N-myristoyl transferase 1,NMT1)是一种重要的不可逆真核脂质修饰N-肉豆蔻酰化的主要酶,被确定为地氯雷他定的重要靶蛋白。既往研究表明NMT1在各种癌症中均有过表达,且NMT1表达与患者生存不良呈正相关然而,NMT1在HCC中的作用尚不清楚。
蛋白质肉豆蔻酰化在肿瘤发生中的重要性研究表明,病毒癌基因产物pp60v-src的肉豆蔻酰化在膜转化中的重要作用。研究越来越多地确定蛋白质肉豆蔻酰化作为抗癌化疗药物的靶点。尽管肉豆蔻酰化在癌症发展中起着重要作用,但NMT1酰化底物仍有待鉴定。
在这项研究中,一个由419种FDA批准的药物组成的化合物库被用于筛选潜在的抗癌药物。一系列功能实验表明,抗过敏药物地氯雷他定可抑制肝癌细胞系、细胞源性异种移植(cell-derived xenograft,CDX)、患者源性类器官(patient-derived organoid,PDO)和患者源性异种移植(patient-derived xenograft,PDX)模型的增殖。通过药物亲和反应靶稳定性(drug affinity responsive target stability,DARTS)和表面等离子体共振(surface plasmon resonance,SPR)测定, NMT1为地氯雷他定的靶蛋白。
进一步研究表明,在体内和体外实验中,上调NMT1表达可促进肿瘤生长,而下调NMT1可抑制肿瘤生长。代谢标记和质谱分析显示,Visinin-like protein 3 (VILIP3)是NMT1蛋白酰化修饰的新底物,NMT1或VILIP3高表达与HCC晚期和生存率低相关。在机制上讲,地氯雷他定与NMT1中的Asn-246结合并抑制其酶活性,破坏NMT1介导的VILIP3蛋白的豆豆酰化和随后的NFκB/Bcl-2信号通路。
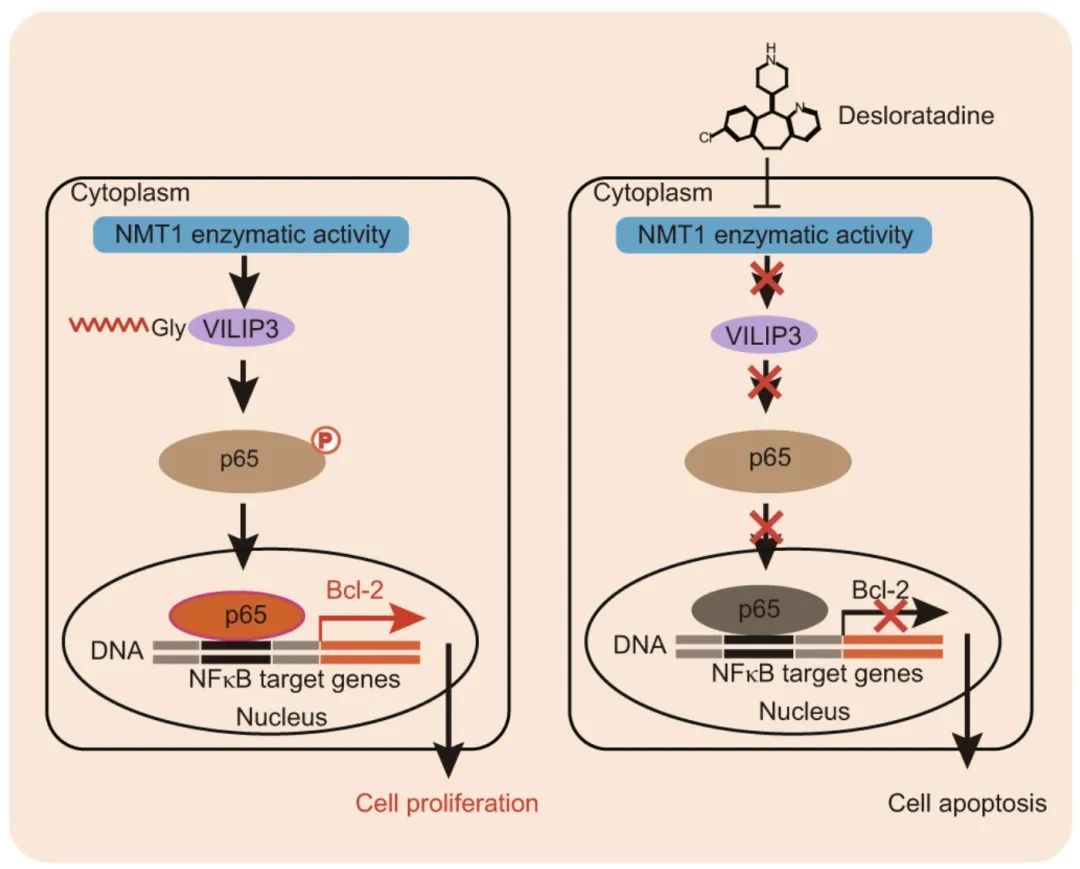
地氯雷他定如何抑制NMT1酶活性和肿瘤发生的示意图(图源自Signal Transduction and Targeted Therapy )
综上所述,这项研究表明地氯雷他定可使HCC细胞对传统化疗药物增敏。研究证明了NMT1通过增强VILIP3蛋白的肉豆蔻酰化和稳定性来促进肝癌的发生。地氯雷他定直接与NMT1结合,通过抑制NMT1的酶活性和随后的VILIP3/NFκB/Bcl-2信号通路来抑制HCC的进展。这些发现不仅强调了NMT1作为HCC预后生物标志物和治疗靶点的潜力,而且支持地氯雷他定在癌症治疗中的使用。
原文链接:
https://www.nature.com/articles/s41392-022-01248-9


