Mol Cell:2篇!中山大学崔隽团队发现IRF3焦磷酸化促进先天性免疫应答
时间:2023-01-10 18:01:53 热度:37.1℃ 作者:网络
蛋白质的翻译后修饰(PTMs)对于保证免疫应答中正常的生物学功能至关重要。虽然蛋白质磷酸化已经得到了广泛的研究,但目前对蛋白质焦磷酸化的认识非常有限。蛋白质焦磷酸化最初被认为是一个非酶的过程,其在免疫信号中的功能尚不清楚。
2023年1月4日,中山大学崔隽团队在Molecular Cell(IF=19)在线发表题为“Metabolic enzyme UAP1 mediates IRF3 pyrophosphorylation to facilitate innate immune response”的研究论文,该研究表明代谢酶UAP1介导IRF3焦磷酸化促进先天性免疫应答。
该研究确定了一种代谢酶,UDP-N-乙酰葡萄糖胺焦磷酸化酶1 (UAP1),作为蛋白质丝氨酸焦磷酸化的焦磷酸化酶,通过催化干扰素调节因子3 (IRF3)在丝氨酸(Ser) 386上的焦磷酸化来促进强大的I型干扰素(IFN)反应。Uap1缺陷显著损害DNA和RNA病毒诱导的I型IFN通路的激活,Uap1缺陷小鼠对致命病毒感染高度敏感。总之,该研究的发现证明了蛋白质焦磷酸化在抗病毒反应调节中的功能,并为代谢和先天免疫之间的串扰提供了见解。

病原体相关分子模式(PAMPs)诱导的先天免疫反应是宿主免疫防御的第一道防线。病毒感染后,利用模式识别受体(PRRs)检测病毒核酸,分级触发信号级联,激活下游转录因子,包括干扰素(IFN)调节因子3 (IRF3)和活化B细胞核因子κ-轻链增强子(NF-κB),产生I型IFN和促炎细胞因子。分泌的IFN诱导数百种IFN刺激基因(ISGs)的转录,从而建立对抗入侵微生物的先天免疫状态。先天免疫信号必须及时激活,以建立对病原体的有效免疫,然后关闭,以避免过度和潜在有害的免疫反应。
由于免疫细胞在其整个生命周期中经历动态和适应性的代谢变化,免疫细胞中的代谢编程已成为通过不同信号通路进行免疫识别、信号传递和反应的重要决定因素。代谢产物对蛋白质的翻译后修饰(PTM)是先天性免疫代谢变化的关键输出。据报道,STING(干扰素基因的刺激因子)在高尔基体的棕榈酰化对于STING的激活引起I型IFN的产生至关重要。MAVS(线粒体抗病毒信号蛋白)的O-GlcNAcylation是k63连接的MAVS泛素化和随后的下游抗病毒信号激活所必需的。虽然已经发现了一组在不同情况下调节先天免疫的PTM,但先天免疫反应中非典型代谢修饰的功能和潜在的调节机制仍然不清楚。
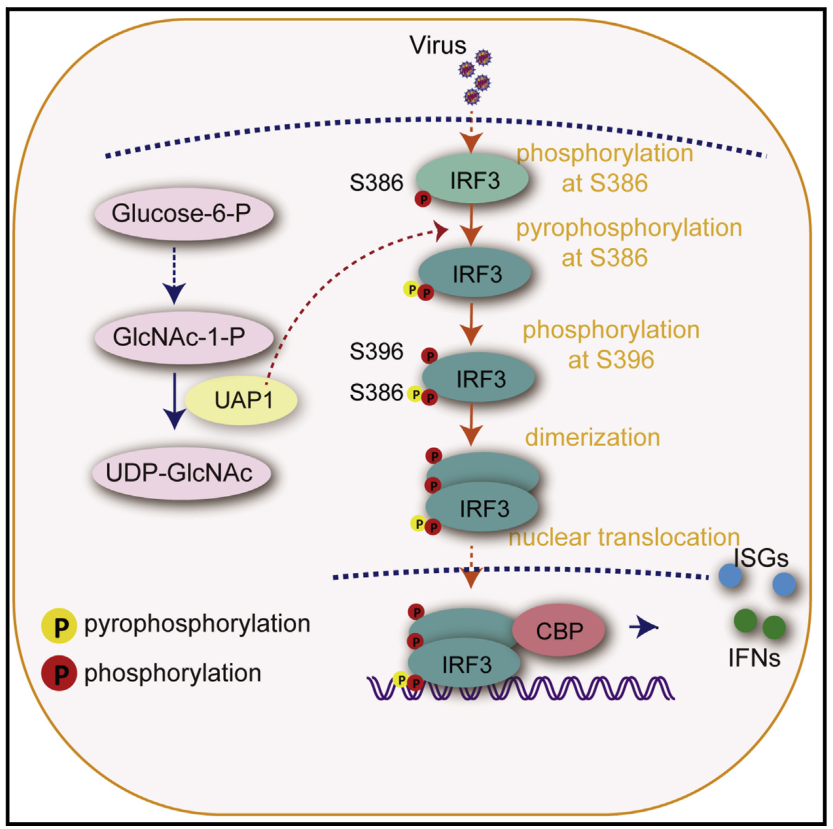
机理模式图(图源自Molecular Cell )
蛋白质焦磷酸化是新近发现的一种由肌醇焦磷酸盐驱动的PTM。到目前为止,蛋白质焦磷酸化在细胞信号传导中的作用尚不清楚,导致蛋白质焦磷酸化的酶尚未确定,因此认为蛋白质焦磷酸化是一个非酶的过程。适配蛋白3的β亚基的焦磷酸化阻止了它与驱动蛋白样蛋白3A的相互作用,从而抑制了HIV-1病毒样颗粒从宿主细胞中释放。另一份报告显示动力蛋白的焦磷酸化作为一个调节信号,以加强动力蛋白驱动的运输。免疫因子是否能发生蛋白焦磷酸化还未被探索。
在这里,该研究确定了UAP1作为对抗病毒的先天性免疫反应的积极调节因子。UAP1过表达促进抗病毒先天免疫信号通路,UAP1缺陷小鼠产生较少的I型IFN,并且对致命病毒感染高度敏感。此外,该研究发现UAP1作为焦磷酸化酶直接催化IRF3的焦磷酸化。UAP1介导的IRF3 386 Ser焦磷酸化是其随后396 Ser磷酸化以及IRF3二聚化的必要步骤。综上所述,该研究结果揭示了UAP1作为IRF3焦磷酸化的重要焦磷酸化酶,以促进I型IFN信号通路的激活和先天抗病毒反应。
原文链接:
https://doi.org/10.1016/j.molcel.2022.12.007


