Her2靶向ADC的新发展策略和挑战
时间:2023-01-11 12:01:16 热度:37.1℃ 作者:网络
前言
人表皮生长因子受体2(Her2)是酪氨酸激酶的跨膜受体,是表皮生长因子受体(EGFR)家族的一员,该家族还包括Her1(EGFR)、Her3和Her4。所有四个成员都是通过配体依赖或独立的同源或异源二聚化的活性形式调节细胞增殖和分化。然而,与其他三个成员不同的是,Her2是唯一一个可以与任何其他成员形成二聚体,从而触发调节细胞增殖和存活信号通路的受体。
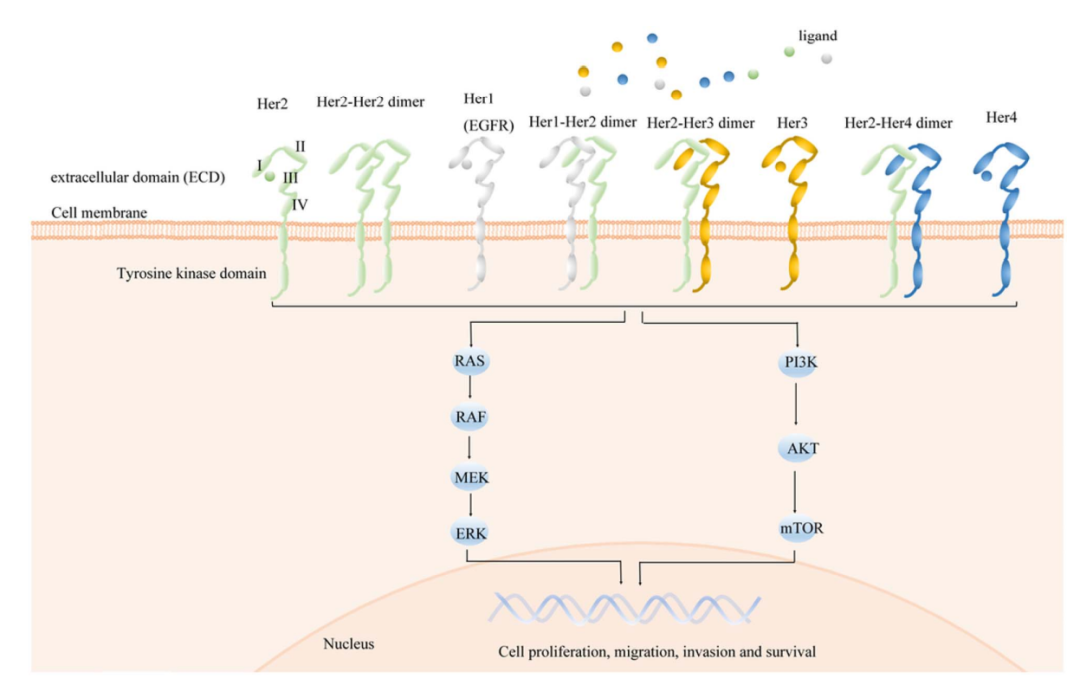
Her2靶向治疗显著地改善了Her2阳性乳腺癌患者和胃癌患者的预后。目前,已批准几种抗Her2靶向药物用于乳腺癌的治疗:trastuzumab和pertuzumab,两者均为抗Her2人源单克隆抗体,联合化疗被批准为转移性乳腺癌的一线治疗。抗体偶联药物(ADC)结合了小分子药物的强大细胞毒性和单克隆抗体的选择性以及良好的药代动力学特征,Her2靶向ADC成为治疗Her2阳性癌症非常有前景的方向。
Her2靶向ADC的研究现状
截止2021年,有30个靶向Her2的ADC药物处于临床阶段,其中23个仍在取得良好进展,已有三家获准上市。T-DM1(Kadcyla)是第一个被FDA批准用于治疗晚期HER2+乳腺癌的Her2靶向ADC药物,同时也被批准用于新辅助治疗后残存病灶的早期高危患者。2019年,T-DXd(DS-8201;ENHERTU) 成为第二个获批的新型Her2靶向ADC药物,它在治疗难治性Her2+转移性乳腺癌患者中显示出显著的抗肿瘤活性。另外,2021年荣昌生物的RC48在中国获准上市,用于治疗至少接受过2种系统化疗的Her2过表达局部晚期或转移性胃癌患者。
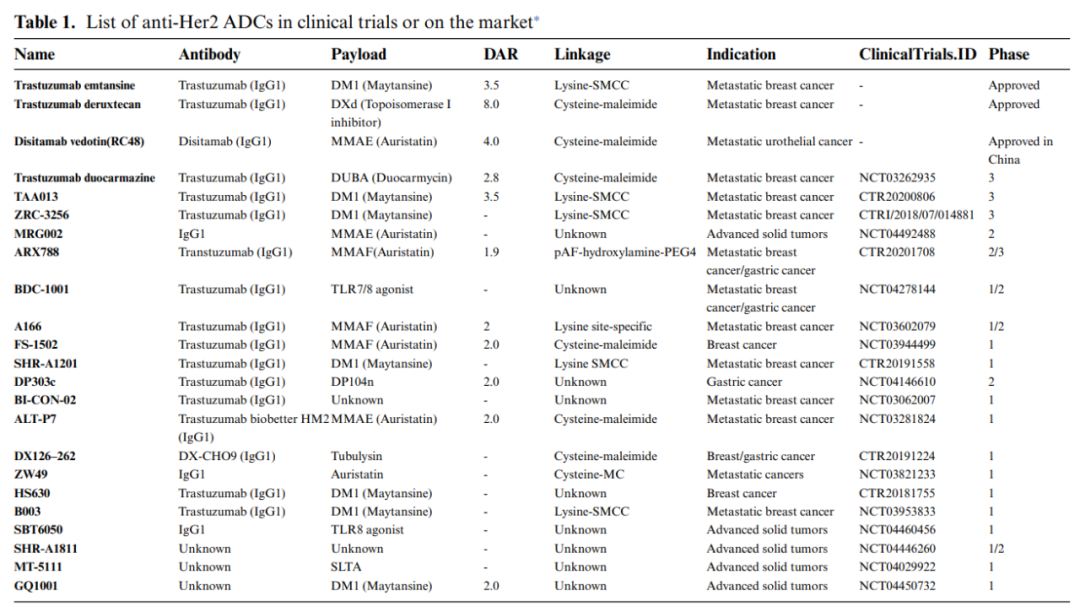
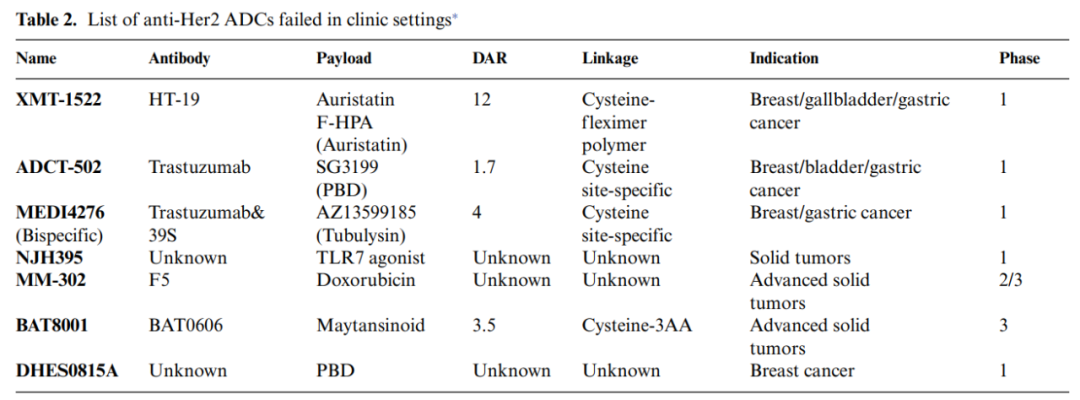
此外,有七个Her2靶向的ADC被宣布终止临床试验。
这些数据显示,靶向Her2的 ADC的临床失败率相对较低(23.3%),表明Her2是ADC非常理想的靶点。
Her2靶向ADC的有效载荷
到目前为止,ADC最常见的有效载荷是细胞毒素,在很长一段时间里,只有少数几种细胞毒素被用作ADC的有效载荷。随着该领域竞争的日益激烈,超过10种新的细胞毒素被用作Her2靶向ADC的有效载荷,这些ADC正在临床前或早期临床试验中进行评估。
靶向微管的有效载荷
微管蛋白抑制剂,尤其是Auristatin和maytansine,在临床试验中被用作大多数ADC的有效载荷。这些细胞毒素在纺锤体形成过程中靶向并抑制动态微管,然后进一步诱导有丝分裂细胞凋亡。auristatin的典型代表是单甲基auristatin E(MMAE),maytansine的典型代表是DM1,MMAE和DM1是临床试验中常用的Her2靶向ADC的有效载荷类型。
靶向DNA的有效载荷
DNA靶向剂,如卡奇霉素、杜卡霉素和吡咯苯二氮杂卓(PBD),可以通过共价键不可逆地附着在DNA的小凹槽上,从而破坏DNA的空间结构,进而导致细胞死亡。与只杀死有丝分裂期肿瘤细胞的微管蛋白抑制剂不同,DNA靶向剂可以作用于增殖和非增殖细胞。
杜卡马嗪是杜卡霉素的衍生物,与曲妥珠单抗偶联形成一种名为SYD985的ADC,其在乳腺癌中的抗肿瘤活性已在临床试验中得到阐明。PBD二聚体对许多肿瘤细胞具有异常强大的活性,引发了人们对ADC开发的热情。然而,评估ADCT-502和DHES0815A(与PBD偶联)在Her2阳性乳腺癌患者中的药代动力学、安全性和耐受性的临床试验因疗效差和安全性问题而终止。
靶向DNA拓扑异构酶1的有效载荷
喜树碱及其类似物是一种有效的拓扑异构酶1抑制剂,已成为ADC的潜在有效载荷。DS-8201a已经获得FDA的批准,它将DX-8951f衍生物与曲妥珠单抗偶联,DX-8951f是一种喜树碱类似物,其抗肿瘤活性高于其他喜树碱衍生物。
此外,sacituzumab和labetuzumab是分别针对TROP2和CEACAM5设计的ADC,它们采用SN-38作为有效载荷。SN-38是半合成喜树碱,是伊立替康的活性代谢产物。尽管SN-38遇到了一些挑战,例如高疏水性和有限的有效结合位点,但Trodelvy的获批意味着SN-38类似物可以满足ADC有效载荷的标准。
其他新型有效载荷
除了上述三种类型的有效载荷外,在临床前试验中还研究了几种新的有效载荷。例如,MT-5111是一种临床开发中的新型Her2靶向ADC,它结合Her2上不同于trastuzumab或pertuzumab的表位,使用核糖体抑制剂志贺毒素作为有效载荷。
BDC-1001、SBT6050和NJH395选择Toll样受体(TLR)激动剂作为有效载荷,以刺激强烈的局部抗肿瘤免疫反应,正在表达Her2的实体瘤患者的I期临床试验中进行评估。MM-302利用了细胞毒性化疗脂质体阿霉素,临床前研究表明其活性优于蒽环类药物和脂质体阿霉素,但在II期试验中未达到终点。
Her2靶向ADC的连接子
为了成功地连接抗体和有效载荷,ADC的连接子构建必须满足一些关键标准。首先,连接子必须足够稳定,在血液循环中不会过早断裂,这可以有效避免ADC的靶向毒性。其次,一旦ADC被内化到靶细胞中,连接子还允许从抗体分子有效释放高度细胞毒性的有效载荷。第三,为了抑制ADC的聚集,还对CMC提出了重大挑战,必须考虑连接子的疏水性。连接子分为两类:不可切割型和可切割型。
大多数ADC连接子采用可切割连接子,可通过环境(如低pH值)或特定溶酶体酶(如组织蛋白酶B)条件性的切割。含有二肽的连接子依赖于组织蛋白酶B,组织蛋白酶B在多种恶性细胞中过表达,其具有羧基肽酶活性,并选择性识别某些氨基酸序列,以在序列的C端切割二肽连接体,如Phe-Lys、Val-Cit、Glu-Val-Cit和GGFG。
许多Her2靶向ADC采用了酶裂解型可切割连接子,如SYD985: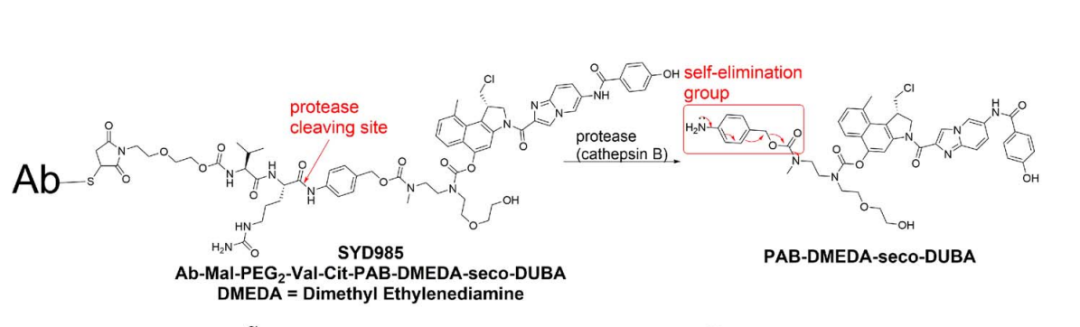
DS-8201a:
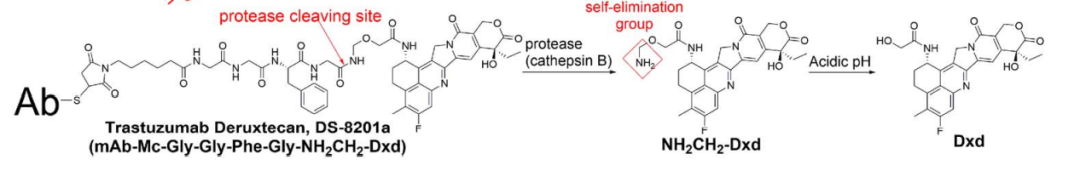
RC48:
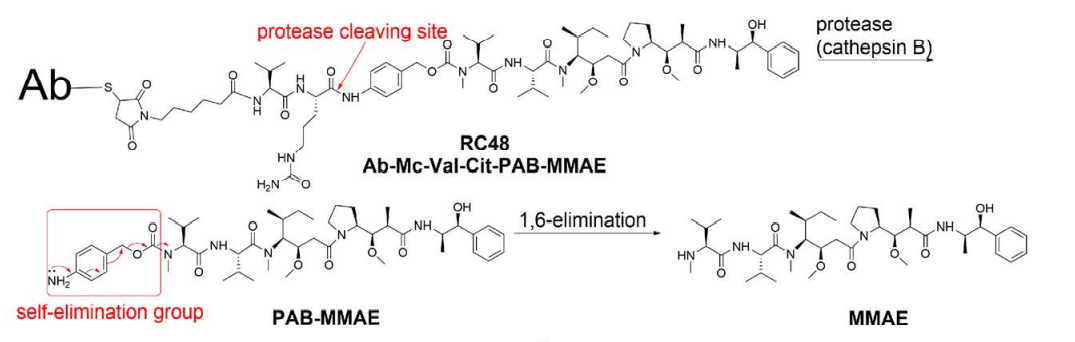
另外一些ADC利用不可切割的连接子在有效载荷和抗体之间构建比可切割连接子更稳定的偶联。带有不可切割连接子的ADC通常具有更复杂的药物释放机制,依赖于抗体的完全蛋白水解降解,由于渗透性差只具有有限的旁观者效应。这类Her2靶向ADC例如T-DM1:
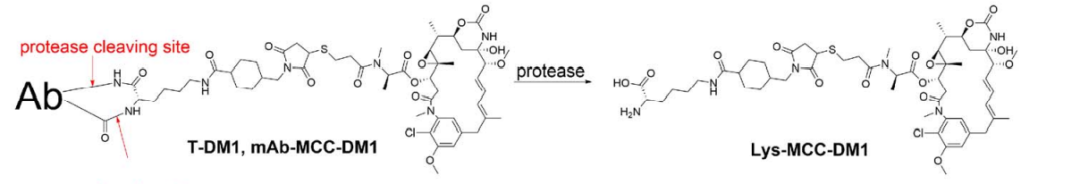
BAT8001:
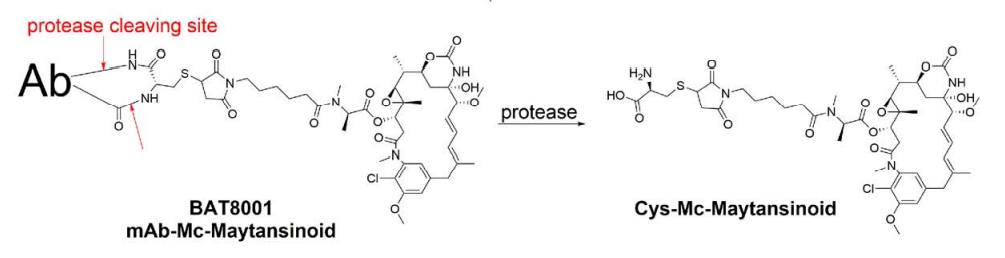
和ARX788:
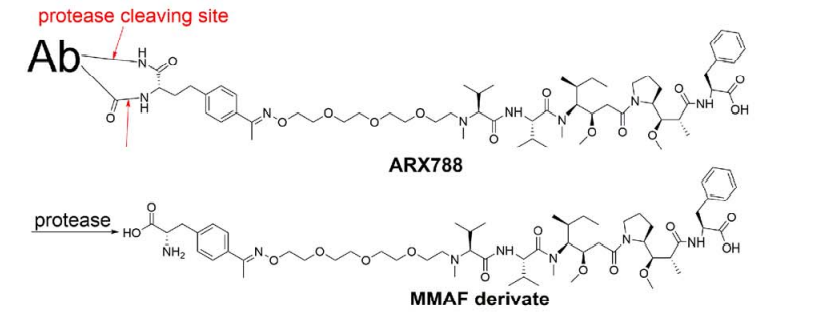
Her2靶向ADC的偶联技术
目前,临床试验中Her2靶向ADC的主要偶联策略是半胱氨酸偶联,如RC-48和SYD985,其次是赖氨酸偶联。此外,近年来,与抗体上的工程氨基酸或天然氨基酸进行位点特异性偶联成为一种趋势,例如ARX788和A166。
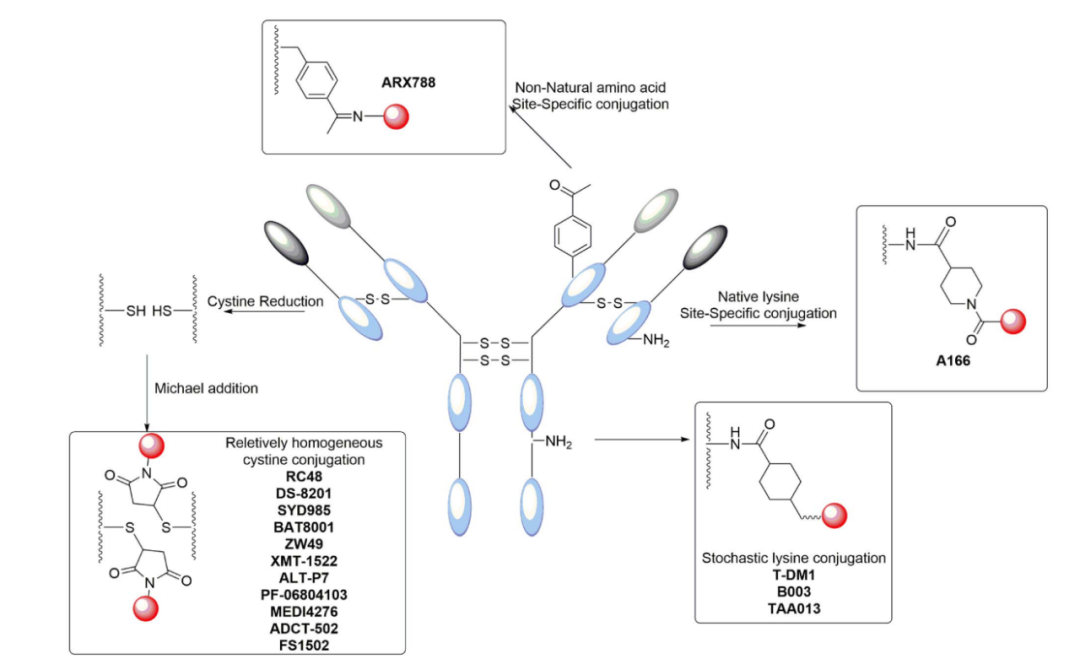
赖氨酸偶联
最常见的偶联方法之一是利用抗体的赖氨酸残基,氨基酸亲核NH2基团与有效载荷上亲电的N-羟基琥珀酰亚胺(NHS)基团发生反应。这种技术已成功应用于批准的首个Her靶向ADC,即T-DM1。
然而,典型的IgG1抗体有80到90个赖氨酸残基,其中约10个可以在强制条件下进行修饰。赖氨酸残基上的偶联导致ADC药物抗体比(DAR)的异质性。此外,连接子可能会附着到一些在抗体-抗原相互作用中至关重要的赖氨酸残基上,导致亲和力降低。
半胱氨酸偶联
半胱氨酸偶联方法是基于抗体的半胱氨酸残基与锚定在连接子上的特定硫基之间的反应。然而,与赖氨酸不同,野生型抗体中几乎不存在游离巯基,它们主要通过减少二硫键生成。IgG1含有4个链间和12个链内二硫键用于ADC构建,幸运的是,4个链间二硫键通常对IgG1的结构稳定性不起关键作用,可以在温和的条件下选择性还原,生成2、4、6或8个游离硫基,同时保持12个链内二硫键的完整性。
因此,与基于赖氨酸的偶联相比,明确的偶联位点和特定的硫基反应有助于ADC控制DAR和异质性。这种偶联方法是ADC构建的主要选择,许多Her2 靶向ADC,如RC48和SYD985等,都使用了这种偶联方法。
位点特异性偶联
利用带有工程化活性氨基酸残基的抗体与连接子有效载荷偶联是获得位点特异性ADC的可行方法。这些ADC的特点是偶联均匀,DAR为2或4,表现出比传统ADC更好的耐受性。ADCT-502和MEDI4276就是基于这种技术生产的,不同之处在于,ADCT-502将参与链间二硫键形成的八个半胱氨酸残基中的六个突变为丝氨酸,在重链220位留下两个半胱氨酸用于位点特异性偶联,而MEDI4276将Fc区的S239和S442突变为半胱氨酸用于偶联。不幸的是,这两种ADC的临床试验都已经终止,可能是因为无法忍受的毒性。
该技术的另一个应用是将对乙酰苯丙氨酸基团带入抗Her2抗体,以提供酮基作为与烷氧基胺衍生药物形成稳定肟的反应位点。ARX788 ADC是一种抗Her2-p-乙酰苯丙氨酸-MMAF偶联物,可抑制异种移植肿瘤生长,目前处于I/II期临床试验阶段。这种ADC的清除率和暴露参数与相应的裸抗非常相似。
此外,不同于抗体工程化产生位点特异性偶联,人们尝试在抗体上产生化学和区域选择性赖氨酸修饰,从而生成同质化的ADC。A166就利用了这种技术,其连接子偶联到曲妥珠单抗上的轻链,目前处于I/II期临床试验阶段。
Her2靶向ADC的临床进展
处于研发前沿的几种抗Her2靶向ADC,如DS-8201a、SYD985、RC48和ARX788,类似于T-DM1,在乳腺癌治疗中表现出优异的抗肿瘤活性。同时,其中一部分对其他Her2阳性癌症显示出显著的临床益处。
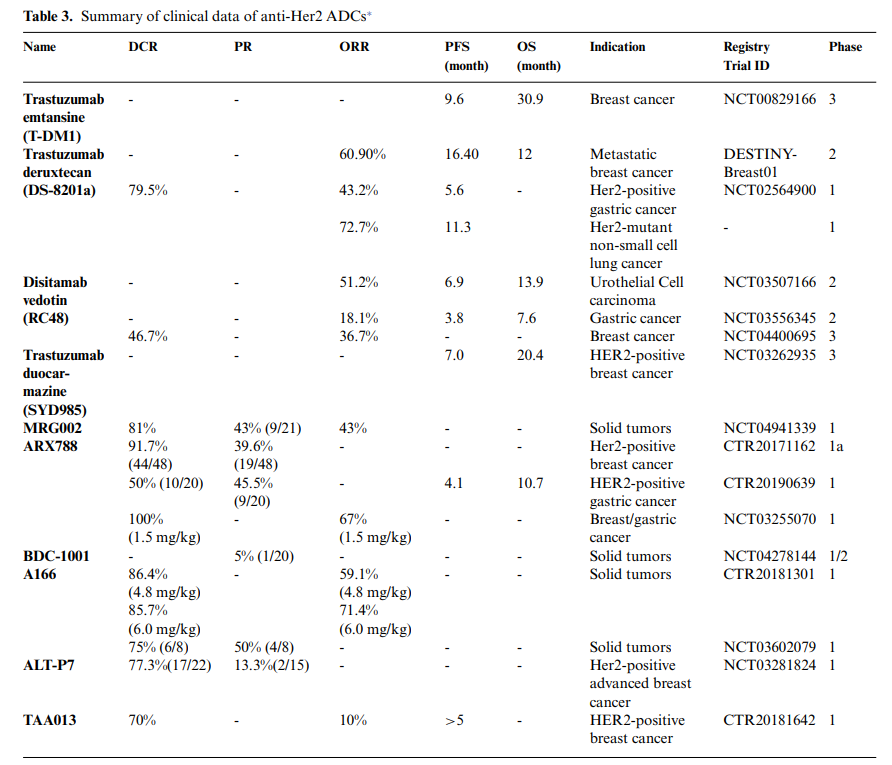
在II期临床试验中,DS-8201a在转移性乳腺癌患者的治疗方面取得了显著改善,包括60.9%的客观响应率(ORR)、16.4个月的无进展生存期(PFS)和12个月的总生存期(OS)。Her2阳性胃癌患者也从DS-8201a中获得了显著的临床益处,ORR为43.2%,疾病控制率(DCR)为79.5%,PFS 为5.6个月。在Her2突变型非小细胞肺癌中,ORR为72.7%,PFS中位数为11.3个月。
RC48在治疗尿路上皮癌(ORR 51.2%,OS 13.9个月,PFS 6.9个月),胃癌(ORR 18.1%,PFS 3.8个月,OS7.6个月)和乳腺癌(ORR 36.7%,SD 60.0%)方面也表现出优越的临床疗效。
此外,DS-8201a和RC48在治疗Her-2低表达患者方面也显示出显著的疗效。在Her2 IHC1+或IHC2+乳腺癌分期试验中,DS-8201a的ORR为37%,DCR为87%。在Her2阴性尿路上皮癌(IHC0或IHC1+)的多中心II期试验中,RC48的ORR为25%,DCR为75%。
值得注意的是,ARX788在治疗Her2阳性胃癌患者方面显示出显著疗效,20名患者中有9名(45.5%)获得PR。2021年3月,FDA授予了ARX788针对HER2+胃癌的孤儿药资格。此外,Her2靶向ADC的开发也不可避免地遇到了挫折,例如,BAT8001由于未能达到III期临床试验的终点而被终止,但整体的Her2靶向ADC药物在Her2阳性癌症治疗中显示出良好的前景。
Her2靶向ADC设计面临的挑战
ADC分子的性质由各个组分的整体决定。对于mAb、连接子、有效载荷、位点、偶联类型和所获得的DAR的任何给定组合,产生的产物将由具有不同物理化学性质的ADC的混合物组成。产生的异质性可能会影响其稳定性、药代动力学和清除率,从而对ADC的整体安全性和有效性产生不利影响。因此,精心选择的组件集成是ADC成功的一个关键方面。
随着ADC技术的发展,ADC分子的设计越来越多样化,这既是机遇也是挑战。在抗体方面,除了单克隆抗体,还可以选择双特异性抗体和纳米抗体。有效载荷不仅限于细胞毒素,还包括蛋白质毒素、酶、放射性核素、核糖体抑制剂、siRNA和免疫刺激剂等。
在偶联方面可选择两种类型的连接子:可切割和不可切割。偶联技术方面,除了最常见的随机、赖氨酸或半胱氨酸偶联外,还有多种位点特异性偶联,包括通过工程半胱氨酸残基、非天然氨基酸、特异性赖氨酸、糖基和酶介导的偶联。DAR值可以低至2,也可以高至12。
新技术或新分子设计概念的引入是否一定能提高ADC的成功率?答案不得而知。例如,MEDI4276是一种靶向HER2不同结构域的双抗,与基于微管溶素的微管抑制剂有效载荷进行位点特异性偶联,平均DAR为4。它在体外显示Her2阳性肿瘤细胞的细胞内化和细胞溶解增强,但在I期临床试验中,在剂量>0.3 mg/kg时,表现出不可耐受的毒性。
XMT-1522是另一种ADC,由一种新型的全人抗Her2单抗和一种新型的基于auristatin的细胞毒性有效载荷组成,具有高DAR值。但该公司最终放弃了XMT-1522,因为在一项针对乳腺癌患者的1期研究中,风险效益比令人失望。因此,分子设计仍然是ADC开发的重点和难点。
小结
ADC的发展将受益于治疗性单克隆抗体设计的改进,以允许有效载荷在特定位点偶联,从而实现更均匀的ADC药物。偶联策略和有效载荷释放机制的多样化可以提供更多的可能性来产生具有更好疗效和安全性的ADC。Her2是一个经典靶点,目前有多款Her2靶向的ADC处于临床阶段。相信随着ADC技术的进步,在Her2阳性肿瘤的治疗中,这些ADC药物将显著改善患者的生存状况。
参考文献:
1.Novel development strategies and challengesfor anti-Her2 antibody-drug conjugates. Antib Ther. 2022 Jan; 5(1): 18–29.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


