广州医科大学李仕颖教授团队《Small》:自组装免疫调节剂通过抑制CDK5促进光动力肿瘤免疫治疗
时间:2024-06-14 20:00:20 热度:37.1℃ 作者:网络
治疗诱导的免疫激活在转移性肿瘤治疗中显示出巨大的潜力,但由于肿瘤细胞的免疫抑制表型和获得性免疫抵抗,免疫应答存在差异。临床可用的治疗方法,包括化疗、放疗和光动力疗法(PDT),不仅可以杀死细胞抑制肿瘤生长,还可以触发肿瘤相关抗原(TAAs)的剧烈释放,激活抗肿瘤免疫。尽管如此,传统疗法诱导的免疫效果并不令人满意,肿瘤免疫抑制特性有待进一步挖掘,以理性设计药物组分和免疫协同机制。值得注意的是,肿瘤细胞过度表达免疫抑制蛋白,如程序性死亡受体配体免疫检查点1 (PD-L1),导致细胞毒性T细胞活性降低,诱导免疫耐受。最近的研究表明,化疗、放疗和PDT等治疗可以反馈地提高PD-L1的表达,促进肿瘤细胞的免疫逃逸,导致肿瘤复发。此外,T细胞和自然杀伤细胞的激活会分泌干扰素γ(IFN-γ)来增强全身和局部抗肿瘤免疫,但IFN-γ也是高效的PD-L1诱导剂,损害免疫激活并引起获得性免疫抵抗。因此,逆转治疗诱发的获得性免疫抵抗,有望增强PDT诱导的抗肿瘤免疫治疗效应。
近日,广州医科大学李仕颖教授团队报道了一种无抗体的程序性死亡受体配体1 (PD-L1)下调剂(CeSe),通过抑制细胞周期蛋白依赖性激酶5(CDK5)来促进光动力肿瘤免疫治疗。其中,CeSe具有良好的稳定性和药物递送效率,能诱导肿瘤细胞免疫原性死亡(ICD)释放肿瘤相关抗原。更重要的是,CeSe抑制CDK5可以下调PD-L1,通过减少肿瘤免疫逃逸和治疗诱导的获得性免疫抵抗,激活全身抗肿瘤免疫效应,协同抑制原发瘤和转移瘤的生长。相关工作以“Self-Assembled PD-L1 Downregulator to Boost Photodynamic Activated Tumor Immunotherapy Through CDK5 Inhibition”为题发表在《Small》期刊,广州医科大学李仕颖教授为该论文的通讯作者,硕士研究生俞白雪为本文的第一作者。

【文章要点】
本研究以临床前可用的CDK5抑制剂和FDA批准的光敏剂为纳米药物构筑基元,制备了一种自组装的PD-L1调节剂(CeSe),在不引入药物载体材料的情况下,显著提高了药物稳定性。值得一提的是,CeSe还能增强药物在肿瘤组织和细胞中的蓄积,促进了药物的有效传递。因此,CeSe通过PDT破坏原发瘤肿瘤细胞,并诱发强大的免疫原性细胞死亡(ICD)效应,触发TAAs的释放。除此之外,CeSe通过抑制CDK5下调肿瘤细胞PD-L1,从而减少肿瘤免疫逃逸和改善治疗诱导的获得性免疫抵抗,增强PDT诱发的抗肿瘤免疫应答。体外和体内研究证实,CeSe能激活系统性抗肿瘤免疫效应,抑制原发肿瘤并减少肿瘤肺转移,并不呈现明显副作用。这种无抗体免疫激活的免疫治疗策略,将为转移性肿瘤免疫治疗提供新的视角,有望促进转化纳米医学的发展。
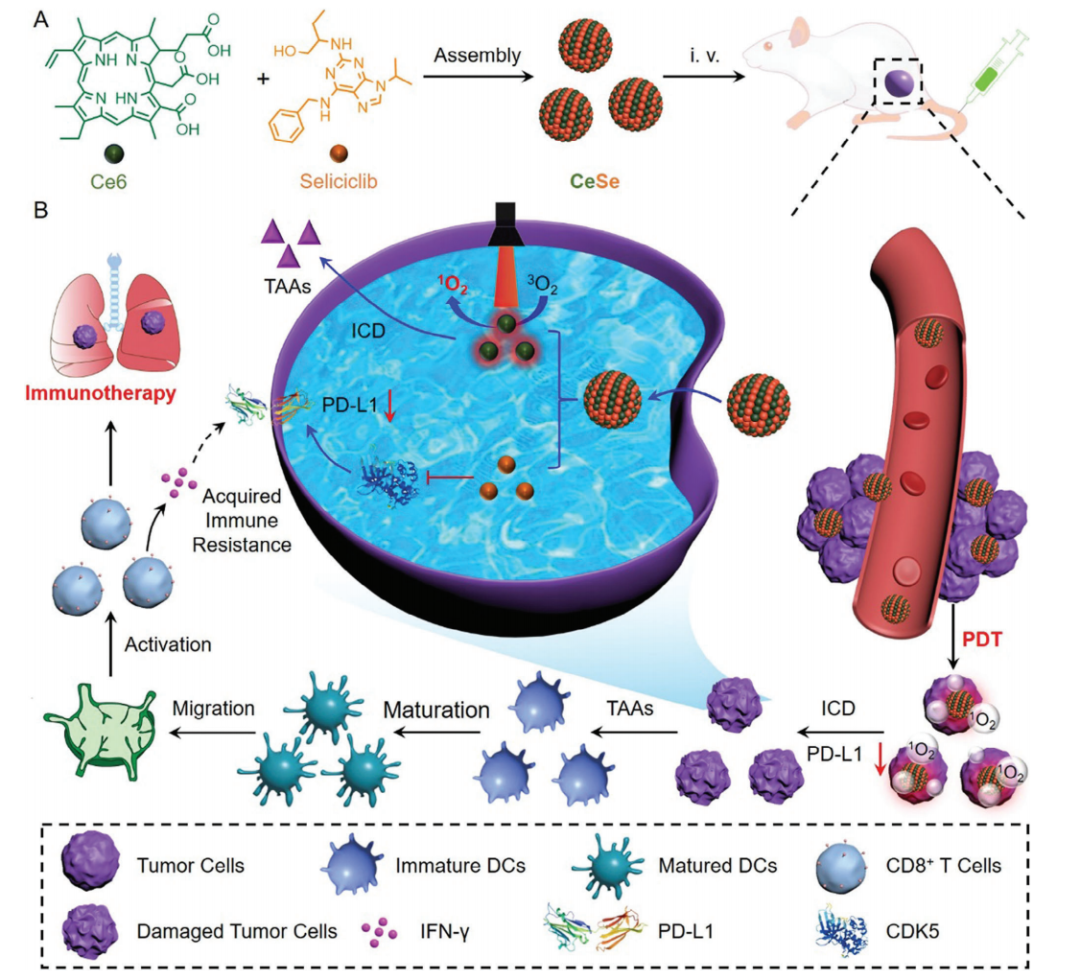
图1. Ce6与Seliciclib制备CeSe的自组装行为,以及CeSe用于光动力肿瘤免疫治疗的分子机制。
原文链接:
https://onlinelibrary.wiley.com/doi/epdf/10.1002/smll.202311507


