中国学者发布:全球首个万人缺血性卒中全基因组研究
时间:2023-08-02 15:25:30 热度:37.1℃ 作者:网络
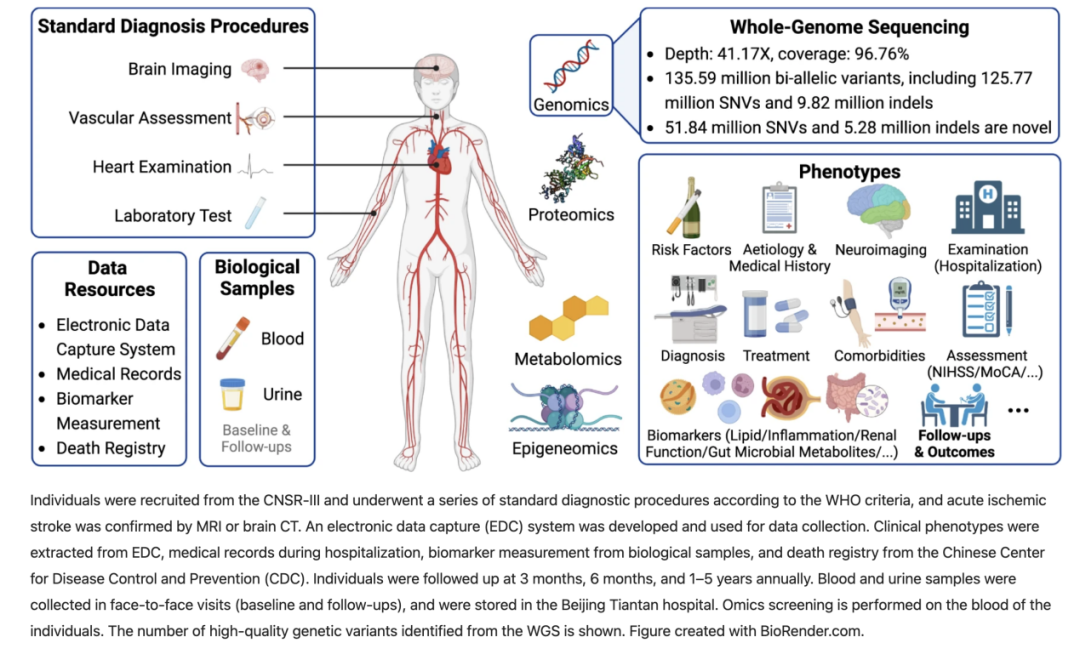
卒中是世界范围内导致死亡和长期残疾的主要原因。卒中是一种危险因素多样、临床表现多样、发病过程复杂的疾病,根据中小规模双胞胎研究和全基因组复杂性状分析,其遗传遗传率估计在16.1% ~ 40.3%之间[2、3]。因此,确定序列变异与多样的脑卒中表型之间的关系,对了解脑卒中的发病机制和预后,及为疾病防治制定新的治疗策略至关重要。 目前,国际上很多卒中全基因组相关研究已取得一定进展,MEGASTROKE等项目揭示了包含常见基因变异的32个卒中风险位点;最近的GIGASTROKE研究也使用相同的荟萃分析策略报道了89个独立的卒中风险位点。 另外,还一些研究揭示了卒中预后的遗传风险因素。虽然这些研究大多是基于阵列的纵向研究,并且主要集中在欧洲人群,但更好地了解整个等位基因频谱中编码和非编码变异的完整集合对明确的中间表型和临床结果的遗传影响,以及祖先差异的影响,系统阐明疾病发生和进展的分子机制。 然而,上述研究的东亚人群中代表性不足,对此,中国学者,来自首都医科大学附属北京天坛医院的王拥军教授团队与中山大学刘斯洋副教授团队发起了STROMICS研究,通过对来自中国的10,241名卒中患者进行深度测序和分析,提出了缺血性卒中的第一个全基因组分析,相关成果发表在Cell Discovery,该研究首次发布全球万人卒中疾病队列的全基因组研究,建立了卒中领域最大的多组学平台STROMICS。 图片来源:Cell Discovery 研究发现了13559万个变异,其中42%以上是新变异。在中国和其他国家人群中,有89个与卒中风险相关的变异和10个与卒中药物反应相关的变异在等位基因频率上存在显著差异。 研究人员构建了一个高质量的变异数据集,由13559万个单核苷酸变异(snv)及插入和删除(indel)组成,包括42%的dbSNP中不存在的新变异(Build 155)。 图片来源:Cell Discovery 研究人员解剖了参与者的精细遗传结构,报道了迄今为止最全面的自然选择下的遗传位点图谱,跨越了中国的纬度和纵向梯度,并阐述了群体遗传史知识如何影响疾病预防和药物治疗策略。 研究人员从常见和罕见变异的角度进一步研究了18个卒中相关性状的遗传-表型关联,包括14个生化指标、2个神经影像学指标和2个行为性状。最后,研究人员系统分析了携带遗传性多发脑梗死性痴呆(CADASIL)的致病基因NOTCH3人群的个体表型谱。 通过研究参与者的群体结构,生成了由31个自适应信号组成的遗传选择图谱。MTHFR rs1801133-G等位基因与中国南方患者的VB9(叶酸)相关,这表明了一种基因特异性叶酸补充策略。 通过对18个卒中相关性状的全基因组关联分析,研究人员在6个与治疗相关的脂质性状位点上发现了10个新的遗传-表型关联和广泛的跨性状多效性。 此外,研究人员发现常染色体显性卒中疾病CADASIL的致病基因NOTCH3中存在的一组功能丧失和半胱氨酸改变变异显示出广泛的神经影像学谱。这些发现加深了对卒中患者群体和个体基因布局与临床表型之间关系的理解,并为未来利用人类遗传知识研究缺血性卒中结局的机制、发现新的治疗靶点和推进精准医学奠定了基础。 参考文献: [1]Cheng, S., Xu, Z., Bian, S. et al. The STROMICS genome study: deep whole-genome sequencing and analysis of 10K Chinese patients with ischemic stroke reveal complex genetic and phenotypic interplay. Cell Discov 9, 75 (2023). https://doi.org/10.1038/s41421-023-00582-8 [2]Bak, S., Gaist, D., Sindrup, S. H., Skytthe, A. & Christensen, K. Genetic liability in stroke: a long-term follow-up study of Danish twins. Stroke 33, 769–774 (2002). [3]Bevan, S. et al. Genetic heritability of ischemic stroke and the contribution of previously reported candidate gene and genomewide associations. Stroke 43, 3161–3167 (2012).