PCR实验室核酸检测的常见问题及异常结果分析
时间:2023-01-11 21:03:55 热度:37.1℃ 作者:网络
这3年来,检验的工作日常一定是离不开核酸检测的,毕竟检验人员是核酸检测工作的主力军,我们不但要保证检测结果的有效性,还时刻面临着被感染的风险。本文为大家讲解《PCR实验室新冠核酸检测操作注意事项》,重点从新冠病毒生理特性、荧光PCR原理、PCR实验室筹备规范、样本检测环节操作、实验室数据分析、常见问题解析等几个方面讨论学习。
 1、传染源
1、传染源
目前所见传染源主要是新型冠状病毒感染的患者。无症状感染者也可能成为传染源。
2、传播途径
经呼吸道飞沫和密切接触传播是主要的传播途径。在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能。由于在粪便及尿中可分离到新型冠状病毒,应注意粪便及尿对环境污染造成气溶胶或接触传播。
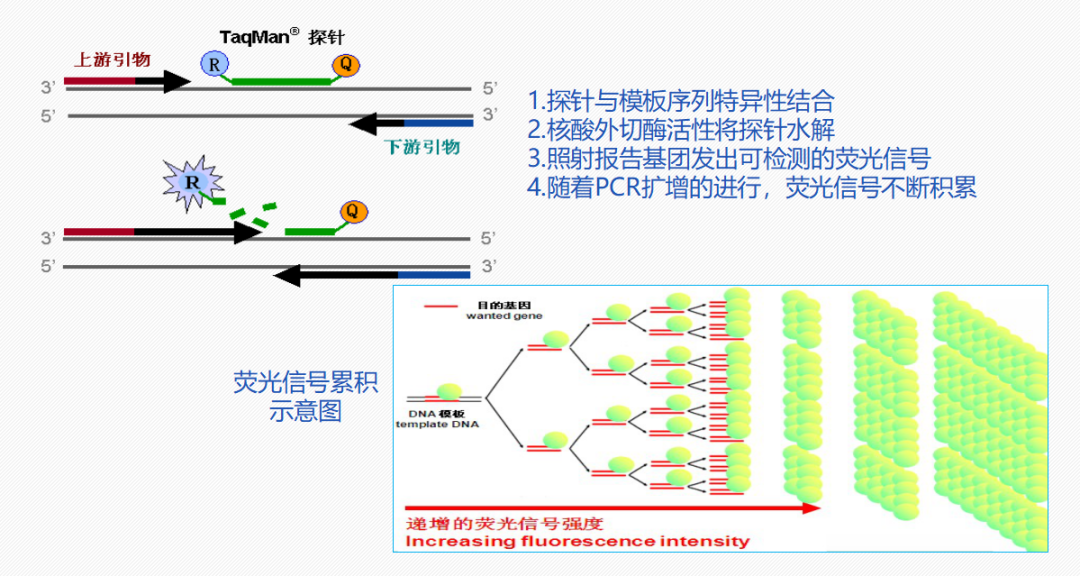
3、荧光PCR原理重复进行“变性 - 退火 - 延伸” 三个过程,模板DNA的量就会呈指数倍增加,理论上讲经过 n 个循环之后,模板量就会达到2的n次方。
 4、常见问题解析
4、常见问题解析
 ①新冠试剂出现翘尾,怎么处理?
①新冠试剂出现翘尾,怎么处理?
答:如果是个别单一通道翘尾,不管是FAM还是VIC通道,首先按照要求复查,复查建议重新采样,如果不方便重新采样建议对原有样本进行重新提取核酸验证,如果复查阴性判读阴性,如果复查还是同一通道翘尾,就要对结果仔细审核,一是要排除实验室污染,二是要对病人信息了解清楚,从临床症状及接触史排查,如果没法确认,建议必须重新采样复查,如有必要可以采用另一家试剂来验证。如果出现大量的弱阳性扩增翘尾,首要原因是考虑实验室污染,可以通过做环境样本和阴性对照做验证排除。
②N基因和1ab基因是新冠病毒的特有基因吗,灵敏度哪个更高?是否会和其他冠状病毒片段重叠?
答:N基因跟1ab都是特异的,不会跟其他呼吸道病原体交叉反应。设计时候,两个基因的序列不一样,导致灵敏度不一样,N基因的灵敏度比1ab灵敏度高。
③新冠检测结果和临床诊断不符合,怎么解读?
答:新冠病毒由于是RNA病毒,容易降解,另外检测结果也和取样,核酸提取以及样本本身的核酸浓度有关,需要逐一分析,同时可以结合临床症状判读。
④采用生理盐水做阴性对照,内标也会增长,怎么解释?
答:因为试剂采用的是内源性内标,内源性内标是用人源基因标记,此基因存在于人的表皮细胞内,操作过程中就可能会出现人源性的污染,另外环境污染也有可能导致内标增长,这也是前面提到的建议做环境样本质控。
⑤新冠样本内标不出如何处理?
答:如果新冠样本内标不出,该样本必须复查,可重新混匀该样本提取核酸,如果重新提取该样本内标还是不出,在排除提取问题的情况下,说明采样不合格,要通知临床重新采样复查。
⑥采集环境样本检测新冠状病毒,为啥大部分样本内标不出,偶尔个别样本检测出内标?
答:因为新冠试剂检测的是人内源性内标,环境样本一般不含有人源细胞,所以检测不出内标;偶尔检出内标,可能该环境样本上有人源性细胞粘附,故而检出内标。
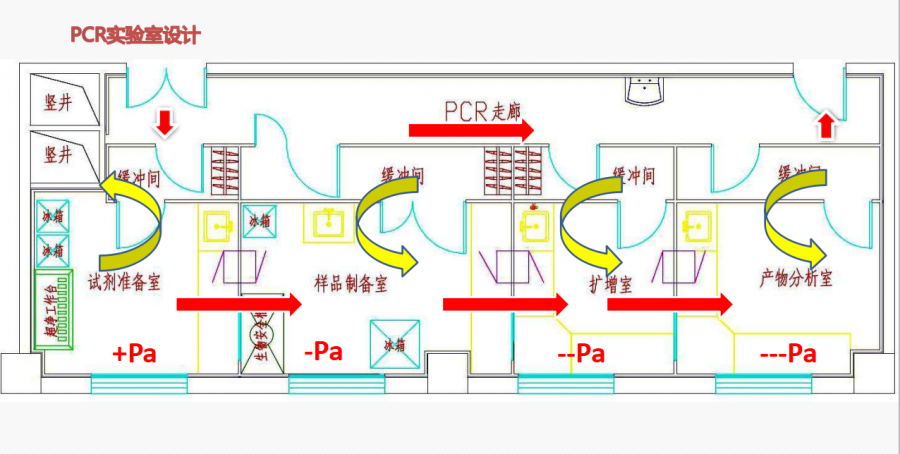 除了以上检验人经常遇到的核酸检测的常见问题外,小龙今天还给大家整理了一下关于荧光PCR常见异常结果分析。荧光PCR方法检测病原体已成为常规检测技术,在工作过程中我们也遇到了各种各样、千奇百怪的问题,下面就我们实验室遇到的一些关于PCR扩增曲线的异常情况及一些经验体会跟大家分享。
除了以上检验人经常遇到的核酸检测的常见问题外,小龙今天还给大家整理了一下关于荧光PCR常见异常结果分析。荧光PCR方法检测病原体已成为常规检测技术,在工作过程中我们也遇到了各种各样、千奇百怪的问题,下面就我们实验室遇到的一些关于PCR扩增曲线的异常情况及一些经验体会跟大家分享。
1、首先我们看一下PCR正常扩增曲线,是比较平滑的S型曲线,见下图:
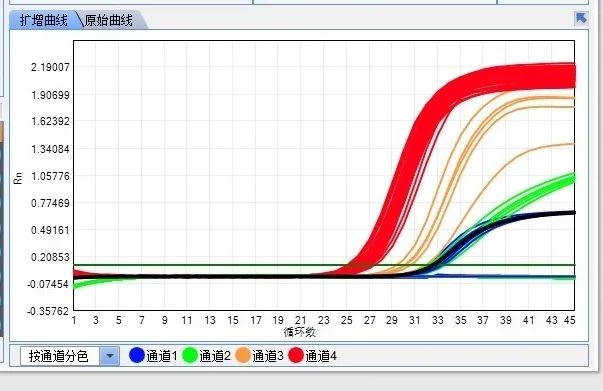 2、常见异常结果分析
2、常见异常结果分析
2.1 案例1
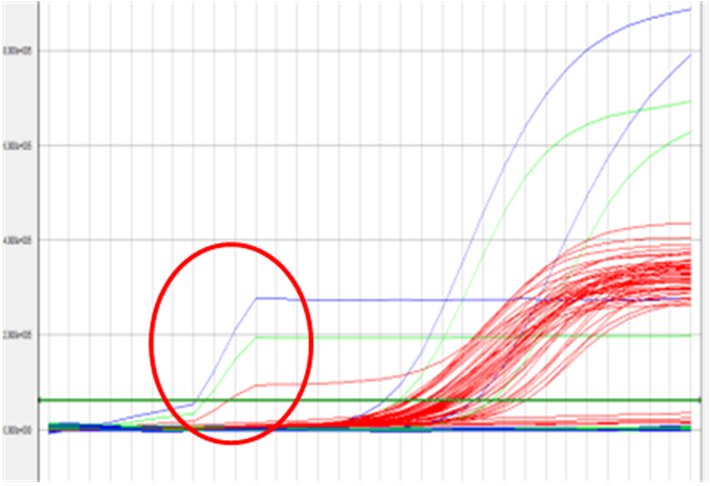
2.1.1现象:常见单基因翘尾且出现较大的Ct值和单基因翘尾无Ct值现象,见下图:
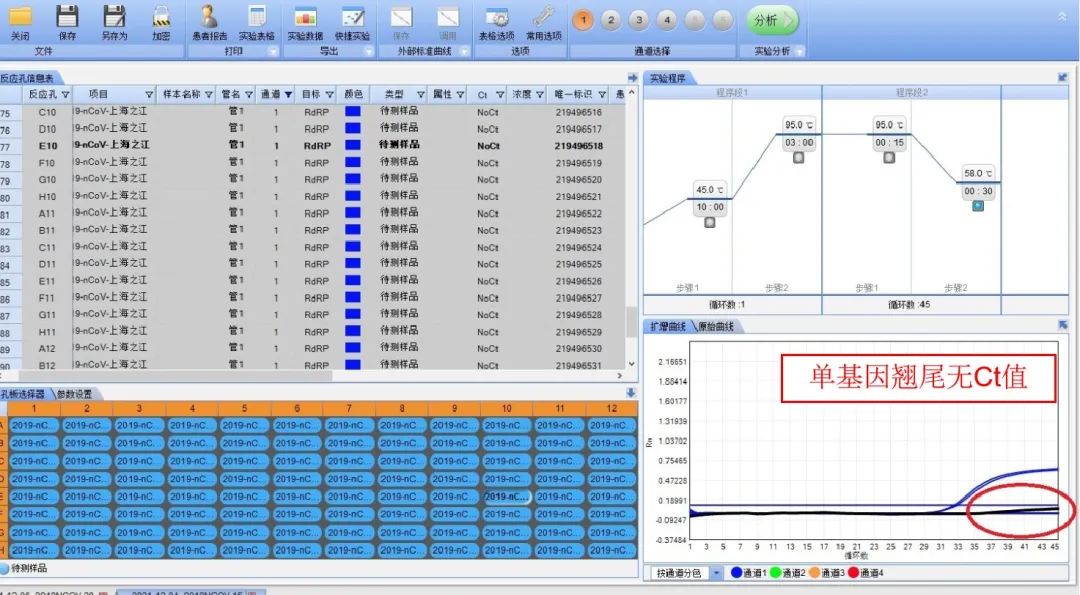 2.1.2 常见原因:阴性质控曲线翘尾,存在阳性质控或阳性标本污染;样本曲线翘尾,表示目的基因浓度低或者存在非特异性扩增或者存在污染。
2.1.2 常见原因:阴性质控曲线翘尾,存在阳性质控或阳性标本污染;样本曲线翘尾,表示目的基因浓度低或者存在非特异性扩增或者存在污染。
2.1.3解决方案:首先排除是否存在污染;排除污染原因后复检样本,如果复检后曲线为阴性直线则说明之前的翘尾为非特异性扩增,如果复检后曲线仍与之前一致则说明该样本中待检病毒核酸的浓度偏低。
2.2 案例2
2.2.1 现象:向PCR反应体系中加入提取好的核酸模板后需要加盖PCR管管盖,由于每天标本量大,难免出现管盖盖得不严的情况。PCR结束以后,出现反应体系中液体减少(见下图2c),各荧光通道均出现扩增曲线呈斜直线型(见下图2a、2b),严重时造成实验室污染。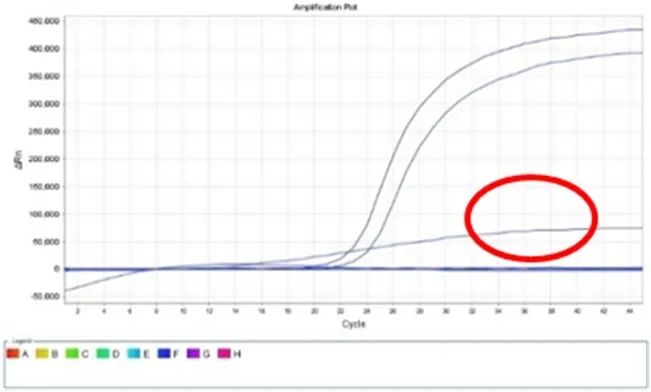
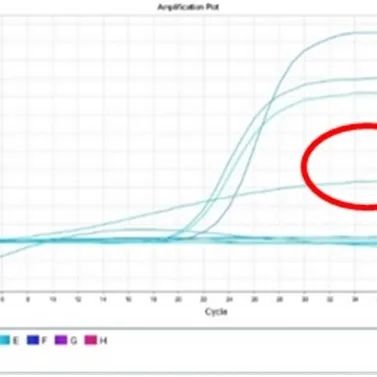
 2.2.2 常见原因:由于管盖没盖紧,反应液蒸发,管内体积减少,读取荧光的标准产生变化,导致曲线呈斜直线上升。
2.2.2 常见原因:由于管盖没盖紧,反应液蒸发,管内体积减少,读取荧光的标准产生变化,导致曲线呈斜直线上升。
2.2.3 解决方案:操作时,注意盖紧管盖,使用质量合格、管和盖匹配的耗材。
2.3 案例3
2.3.1现象:类似S型的曲线,但不是平滑的典型S型曲线,与阳性质控有明显差异,见下图:
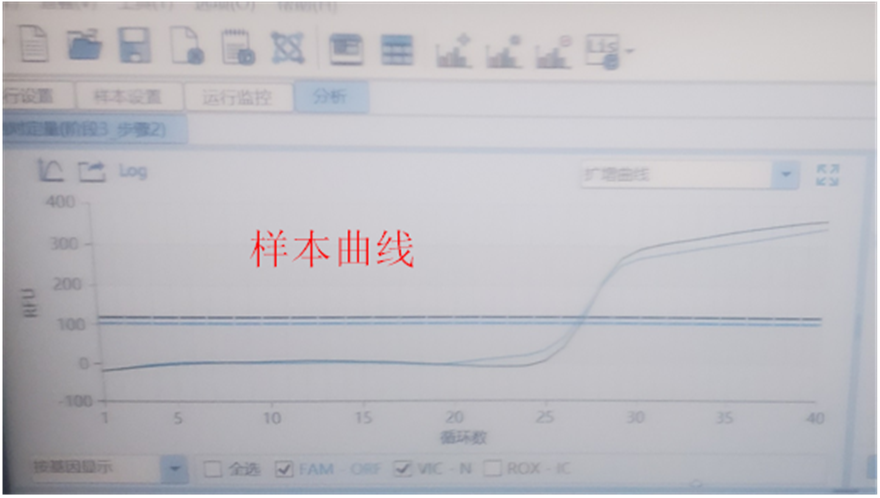
 2.3.2常见原因:样本中可能存在干扰物质、提取纯化不完全、PCR仪热盖出现异常等。
2.3.2常见原因:样本中可能存在干扰物质、提取纯化不完全、PCR仪热盖出现异常等。
2.3.3解决方案:复测;重新提取,或使用不同试剂盒提取。
2.4案例4
2.4.1现象:不规则的扩增曲线(见下图):
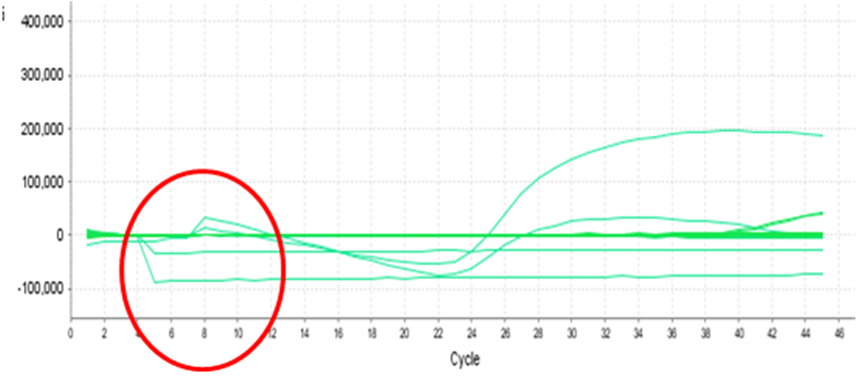
 2.4.2常见原因:整板其他孔位曲线没有异常情况出现,可能该孔位溶液有气泡影响,气泡可以让光路发生折射,在气泡破掉的时候会导致荧光信号发生急剧的变化,干扰仪器对荧光信号的采集。
2.4.2常见原因:整板其他孔位曲线没有异常情况出现,可能该孔位溶液有气泡影响,气泡可以让光路发生折射,在气泡破掉的时候会导致荧光信号发生急剧的变化,干扰仪器对荧光信号的采集。
2.4.3解决方案: ①加样时减少气泡产生 ;②上机前注意弹掉气泡再离心。
2.5案例5
2.5.1现象:内源性内参曲线异常。
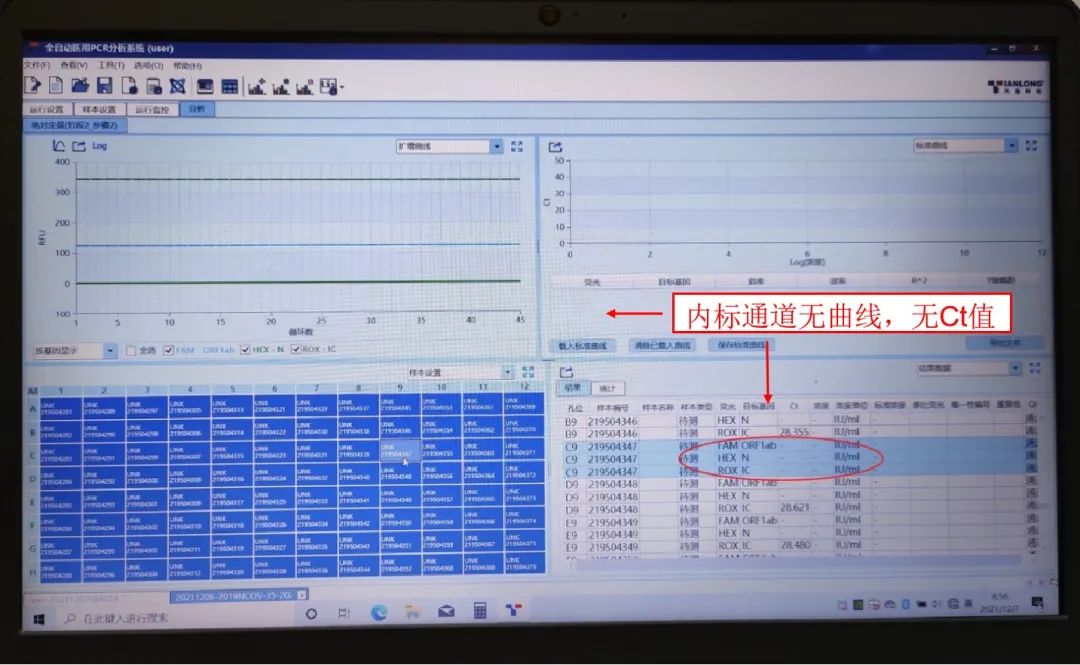 2.5.2常见原因:该孔有异物;温度或荧光信号采集异常;该检测的反应体系中存在抑制物;提取核酸失败;样本采集不合格;样本/核酸漏加。
2.5.2常见原因:该孔有异物;温度或荧光信号采集异常;该检测的反应体系中存在抑制物;提取核酸失败;样本采集不合格;样本/核酸漏加。
2.5.3解决方案:打开PCR仪盖,查看孔内是否有异物,假如有异物,用镊子夹出异物,或用洗耳球吹出异物;分析前一批结果中,该孔内标是否扩增,假如连续两次内标无扩增,考虑该孔温度异常或荧光信号采集异常,需要进行校准或报修。排除以上情况后,对原标本复检,若内标正常可以正常发报告;若内标仍然无扩增,则需重新采样复检。
2.6案例6
2.6.1现象:外源性内标曲线异常
外源性加入的内标均一性较好(如G行12孔均有内标曲线,且其CT值均一,见下图)
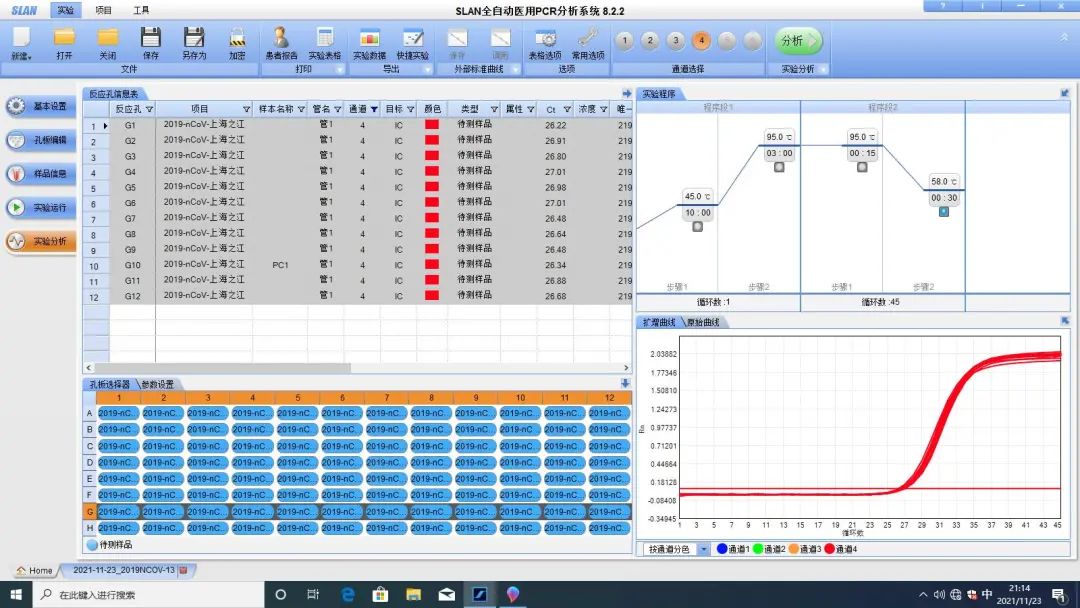
但工作中有时会发现同一排或同一行中内标比较离散,甚至有多个内标不起(如F行的F7、F9、F10、F11孔均无内标曲线,无CT值,其余各孔CT值比较离散,见下图)
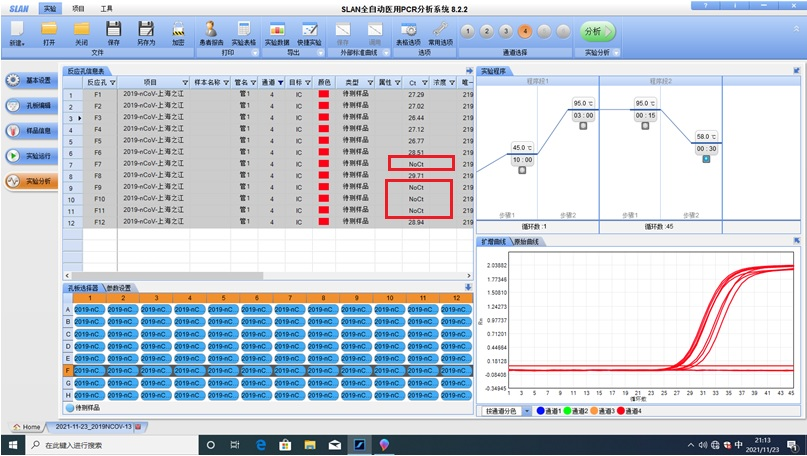 2.6.2常见原因:①排枪与枪头不匹配,结合不严密,导致加样量不足/不均一;②使用排枪吸取内标混合液时,液体堵住了部分枪头滤芯,导致向裂解板加样时加样量不均一,甚至部分孔没有液体加入。
2.6.2常见原因:①排枪与枪头不匹配,结合不严密,导致加样量不足/不均一;②使用排枪吸取内标混合液时,液体堵住了部分枪头滤芯,导致向裂解板加样时加样量不均一,甚至部分孔没有液体加入。
2.6.3解决方案:建议使用配套量程的枪头,移液器要慢放慢吸;分装试剂和加样时仔细观察液体是否打出。


