免疫检查点抑制剂治疗独特的临床特征
时间:2023-01-13 21:02:06 热度:37.1℃ 作者:网络
前言
免疫肿瘤学(I-O)疗法已经彻底改变了癌症治疗的模式,当代I-O治疗包括一系列治疗,如免疫检查点抑制剂(ICIs)和嵌合抗原受体T细胞免疫疗法。免疫检查点阻断性抗体药物,包括细胞毒性T淋巴细胞抗原4(CTLA-4)、程序性死亡-1受体(PD-1)和程序性死亡配体1(PD-L1)抑制剂,已经在临床中显示出显著的抗肿瘤活性,并正在与其他药物联合以增加临床效益。
随着ICIs在肿瘤临床治疗中的更多批准,这引发了经典肿瘤学疗效评价是否能够充分描述这些药物观察到的独特反应的问题。因此,有必要定义这些药物的独特临床特征及其相关评估,以更好地对患者和医生反映治疗效果。虽然总体生存率(OS)仍然是金标准终点,但ICI相关的临床益处现在已经超越了生存率和客观反应的传统结果。其他长期指标,如反应深度和持久性、无治疗生存期、脑转移疗效、改善的健康相关生活质量(HRQOL)以及独特的安全性,已演变为与ICI疗法相关的额外标志。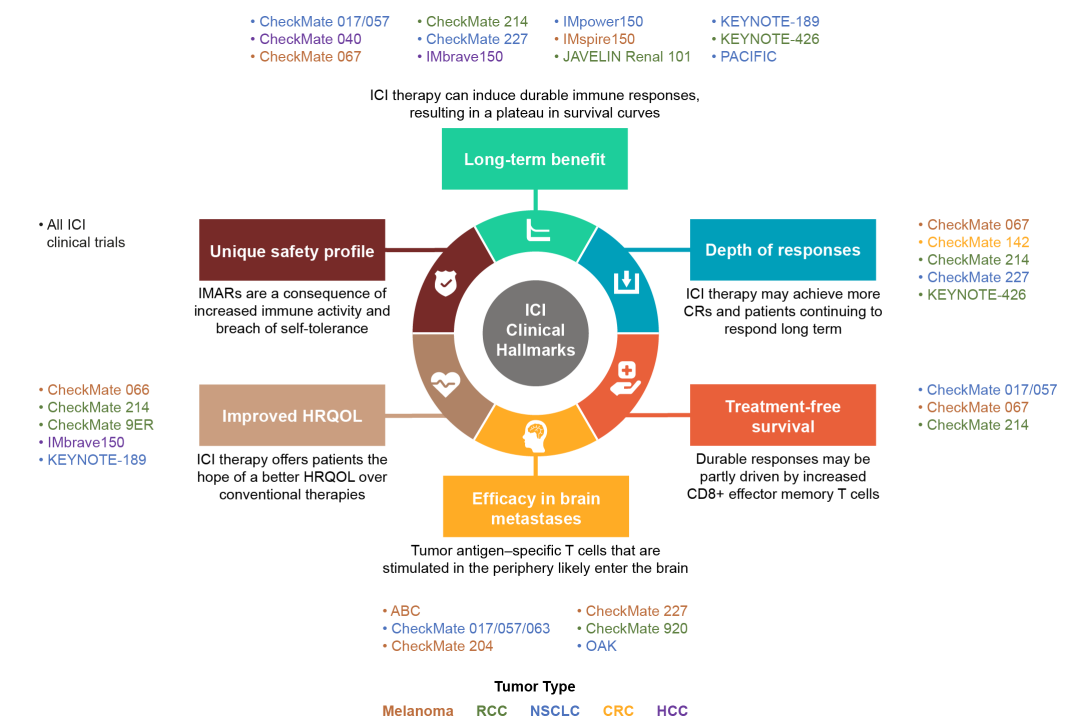
事实上,有必要在临床试验设计中提高认识并更广泛地纳入这些特征。这不仅将重新评估ICI治疗的结果,还将导致对ICI治疗有效性的更高评价。
长期生存收益
生存益处很难量化,尤其是在基于短期随访的初始报告试验中。然而,随着随访时间的延长,ICI疗法的一个新的临床特征是延迟分离的Kaplan-Meier生存曲线,观察到的平台从3年左右开始,显示出长期的生存益处。这与化疗形成了鲜明的对比,后者的早期临床反应经常出现,但寿命很短。

首次报道的晚期黑色素瘤中ipilimumab的长期结果显示,尽管客观应答率(ORR)较低,但应答是持久的,显示出一个约20%的3年OS的平台,并且在10年的随访中,平台是持续的。几项早期ICI试验目前报告了长达5年或更长时间的数据,在第3年出现了类似的平稳期。ICI联合疗法提供了提高平稳期的机会,从而为更多患者提供了持久的OS益处。
增加的响应强度
响应深度(DepOR)定义为从基线检查时肿瘤减少的最大百分比,可能被证明是一种有用的效益指标,可以提供比事件时间终点更早的读数,提供一种比较治疗反应的额外方法。与传统抗癌治疗不同,基于ICI的治疗的一个标志是随着时间的推移反应加深,表现为更持久的完全响应(CRs)和患者的持续长期反应。
DepOR对某些癌症的长期生存具有预测价值。在FDA对晚期黑色素瘤患者的DepOR和生存率的分析中,ICI治疗的DepOR越大,OS发生的时间越长,发生率越高。另一项对接受PD-1抑制剂治疗的晚期非小细胞肺癌患者进行的DepOR分析发现,肿瘤最大缩小百分比越高的患者获得的OS益处越高。同样,nivolumab联合ipilimumab治疗晚期RCC患者也证明了DepOR和OS之间的相关性。
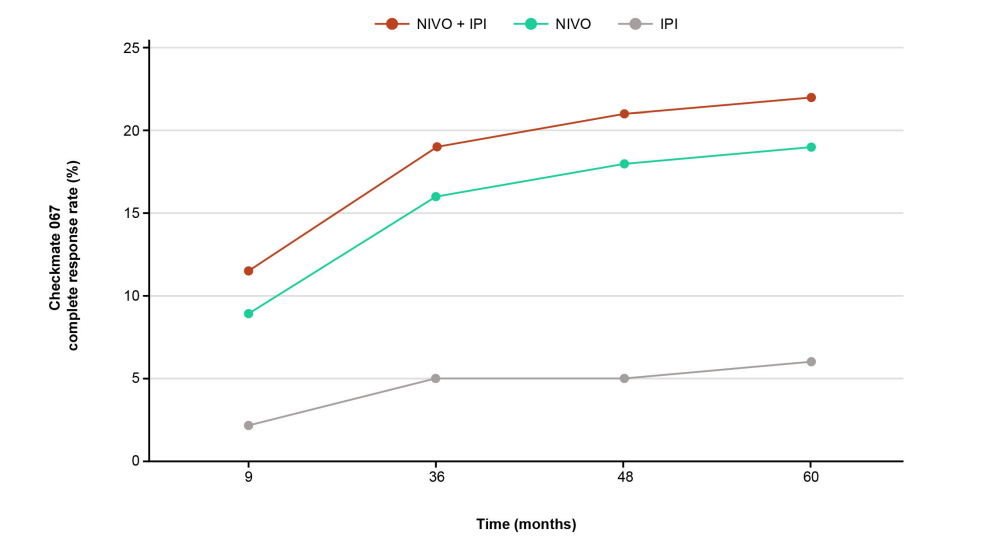
与单一疗法相比,ICI联合疗法治疗的患者,总体上CR率更高。随着随访时间的延长,观察到较高的CR率,例如在黑色素瘤、RCC和CRC患者中使用nivolumab联合ipilimumab。晚期黑色素瘤患者在至少9个月的随访后,nivolumab联合ipilimumab治疗的CR率高于单药治疗的CR率,ORR也是如此。在5年的随访后,使用nivolumab和ipilimumab的ORR没有改变,但CRs的百分比更高,这表明随着时间的推移,更多部分缓解(PR)患者转为CR。
无治疗生存期
几项ICI研究表明,即使在停止联合治疗后,仍有持久的反应,导致无治疗间隔延长,这可能会降低新的或进一步毒性的可能性,并可能产生节约成本的影响。TFS是一个新的终点,定义为从治疗中断到后续系统治疗之间无治疗间隔或死亡的时间。停止ICI治疗的患者可能会经历持久的疾病控制,而无需后续系统治疗。
在晚期黑色素瘤中,nivolumab加ipilimumab与单一疗法的对比研究将TFS定义为Kaplan-Meier曲线之间的区域。为了使用这些终点,曲线分为三个阶段:方案治疗时间、TFS和随后开始治疗后的生存期。
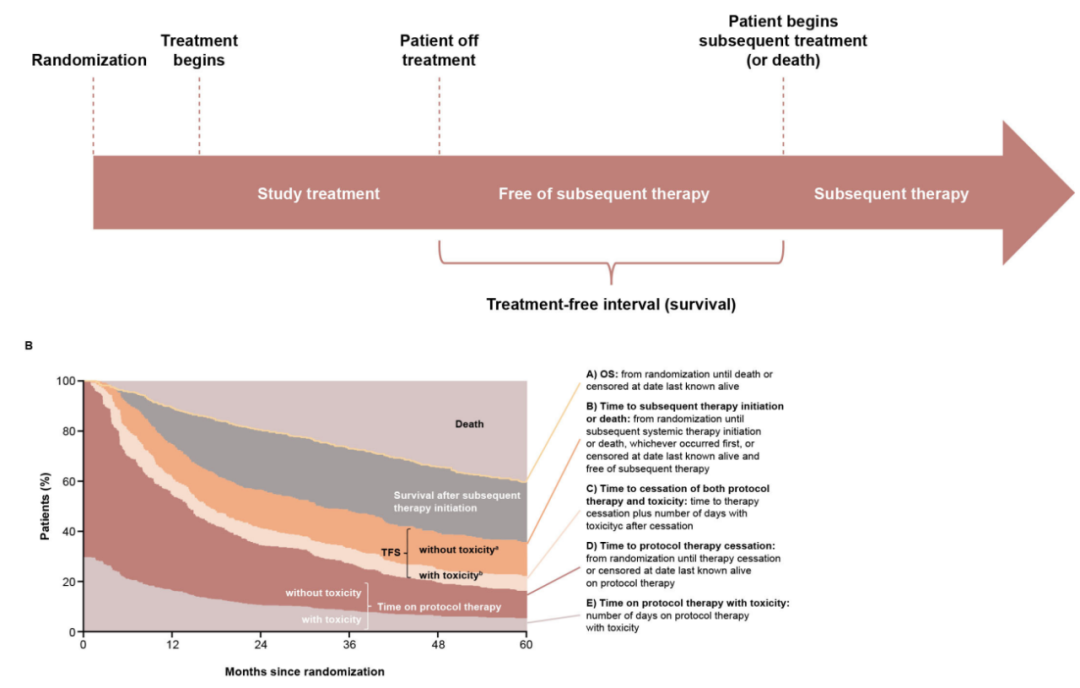
与nivolumab或ipilimumab相比,接受nivolumab加ipilimumab治疗的患者存活率更高,且在TFS中存活长达5年(分别为33%、17%和20%)。此外,nivolumab加ipilimumab组的限制性平均TFS比单一治疗组更长(分别为19.7、9.9和11.9个月)。平均分级≥3级的治疗相关不良事件(AE)仅占60个月期间的一小部分。 脑转移瘤的疗效
脑转移瘤的疗效
脑转移是晚期恶性肿瘤的常见并发症,难以治疗,且预后不佳。ICI在脑转移中的作用在很大程度上是未知的,因为这些患者传统上被排除在ICI临床试验之外。脑转移瘤的炎性肿瘤微环境(TME)高度复杂且具有免疫抑制作用,由多种免疫细胞和癌细胞之间的相互作用组成,可能导致转移进展并损害治疗反应。
支持ICI治疗脑转移瘤疗效的临床证据有限,但已证明颅内反应和生存率良好,表明ICI在各种实体瘤引起的脑转移瘤中具有活性。pembrolizumab、nivolumab、atezolizumab和durvalumab作为单一疗法正在探索脑转移瘤的疗效,这些疗法显示出良好的活性。关于PD-1抑制剂在未经治疗的脑转移瘤中的首次研究是pembrolizumab,在黑色素瘤和非小细胞肺癌的颅内有效率分别为22%和33%。中枢神经系统反应是持久的,与全身反应强烈一致。在黑色素瘤、NSCLC或RCC患者的初始单剂ICI研究中,从治疗开始到颅内反应的中位时间为~2个月。对于未经治疗的肾细胞癌脑转移患者,nivolumab单药治疗的颅内有效率为12%;然而,多发性或大于1cm的脑损伤患者没有客观反应。
与ICI单一疗法相比,联合疗法表现出更高的颅内疗效。在黑色素瘤患者中,nivolumab联合ipilimumab治疗的颅内ORR和CR约为nivolumab单药治疗的两倍。对于无症状、未经治疗的黑色素瘤脑转移瘤,nivolumab联合ipilimumab治疗的颅内反应与颅外反应基本一致,且发展迅速(平均2.3个月)。颅内ORR为57%(其中26%为CRs),总ORR为53%。颅内反应的PFS为6和9月占比分别为64.2%和59.5%,颅外反应分别为75.9%和70.4%。在脑转移患者中,在ICI治疗的脑转移中OS也得以保持,例如,在晚期非小细胞肺癌患者中,nivolumab加ipilimumab的OS与无脑转移的患者相当。
提高的生活质量
ICI治疗对HRQOL有良好影响,这对于评估癌症的全面影响很重要。与化疗相比,PD-(L)1疗法与实体瘤持续延长的症状恶化时间相关。在一项系统性综述中,PD-(L)1疗法与不同随访点更好的症状控制相关。
由于联合疗法显示出更大的毒性,人们担心HRQOL可能会降低。然而,在5年的分析中,nivolumab加ipilimumab以类似于nivolumab单一疗法的方式维持晚期黑色素瘤患者的HRQOL,尽管在免疫介导的不良反应(IMAR)发生率方面存在显著差异。在使用nivolumab加ipilimumab或nivolumab单药治疗期间或治疗后,没有出现有意义的持续HRQOL恶化。晚期肾细胞癌患者接受nivolumab联合卡博扎尼治疗,其HRQOL优于接受舒尼替尼治疗的患者。对于不能切除的HCC,atezolizumab加贝伐单抗与索拉非尼相比,HRQOL得到改善。
在联合治疗中,疾病相关症状恶化的中位时间也更长,且有临床意义的症状恶化的患者比例更低。然而,并非所有ICI组合都能改善HRQOL;例如,pembrolizumab联合阿昔替尼和舒尼替尼单药治疗对晚期肾细胞癌显示出类似的HRQOL益处。值得注意的是,欧洲医学肿瘤学会(ESMO)和ASCO分别在ESMO临床效益量表和ASCO价值框架中纳入了HRQOL的改善,强调了其作为评估癌症治疗价值的关键指标的重要性。
独特的安全性
虽然ICI治疗可以显著改善患者的预后,但它们也与称为IMAR的独特自身免疫样毒性的出现有关。IMARs的机制不同于非ICI药物的AEs,是免疫活性增强的结果,可能是自我耐受的破坏。IMARs的确切机制尚不完全清楚,但它们可能与促进抗肿瘤反应的机制相似。
ICI单药治疗与和化疗相关不良事件(如疲劳、恶心、腹泻和血液毒性)的风险显著降低相关,总体耐受性优于化疗,所有级别和3-4级不良事件的风险显著降低。然而,它也与IMAR增加有关,包括皮疹、瘙痒、结肠炎、甲状腺功能减退、甲状腺功能亢进和肺炎。最常见的受累器官是皮肤、胃肠道和内分泌,然而,也可能出现多个IMAR,并可能出现严重或危及生命的IMAR。
大多数IMAR在ICI治疗开始的前6个月内出现,然而,即使在ICI停药数月后,也可能出现晚发性IMAR,并可能使新出现的诊断更加复杂。“延迟免疫相关事件”定义为ICI停用后IMAR的发展≥90天。
虽然ICI单一疗法的安全性已得到充分证实,但在毒性增加的联合疗法中会出现额外的复杂性,因此确定哪种疗法是毒性的基础变得非常困难。与单一疗法相比,CTLA-4/PD-(L)1联合治疗可显著提高IMAR的发病率,且通常起病较早。每个组合都有一个独特的安全性特征,并且通常由每个单一疗法的AE特征组合产生。
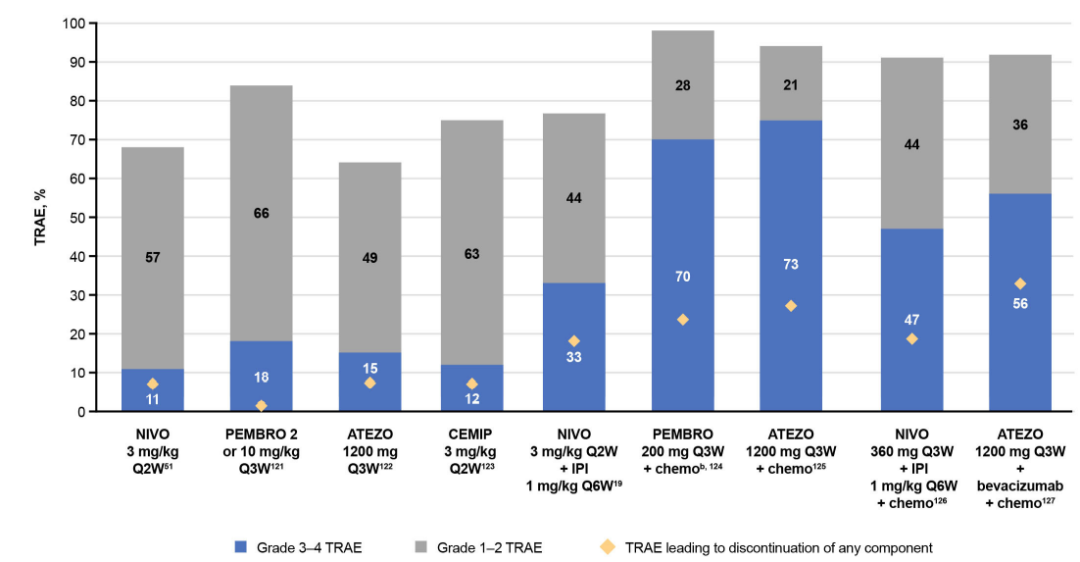
正确评估毒性的根本原因很重要,尤其是在使用不同类别的疗法时。例如,同时使用抗PD-(L)1和TKI需要了解潜在的重叠毒性,虽然TKI相关毒性的管理可能是剂量中断或减少,但IMAR通常使用皮质类固醇进行管理。任何时候ICIs作为联合治疗的支柱,IMAR都可能发生,应该被视为免疫介导的反应。有必要为可能对ICI联合治疗有反应的患者确定生物标志物,以避免与联合治疗相关的更高毒性。
小结
ICI的特征,包括长期存活率、随时间加深的反应、有希望的无治疗间隔、脑转移活动和改善的HRQOL正在出现,并丰富了许多晚期癌症的益处指标。因此需要在研究设计中以及在患者和上游医疗系统水平上更经常地使用ICI组合的特征。随着越来越多的患者长期存活,有必要制定强有力的生存护理计划。除了这些有益的标志外,免疫系统激活还导致ICIs特有的安全性。值得注意的是,IMAR可能是患者预后的生物标志物,因为它们与生存和反应有关。
联合ICI疗法有望进一步提高生存率,并旨在提高曲线的平稳性,使更多患者获得持续的OS益处。联合治疗领域正在进步,包括许多具有多个靶点的新ICI疗法。预计ICI组合在不同肿瘤类型中会获得更多批准,临床特征将需要适应不断变化的领域,这包括新的或更新的终点的可能性。
总之,基于ICI的治疗提供了独特的标志,与显著改善的临床结果和独特的安全性相关。随着我们进入一个新的双重和三重组合治疗领域,未来的研究应侧重于通过优化给药顺序更好地利用这些特征。


