Cell Research:中国科学院杨巍维/李国辉/广州大学王雄军/复旦大学李全林发现结直肠肿瘤发生的调控新机制
时间:2023-01-19 06:01:18 热度:37.1℃ 作者:网络
越来越多的证据表明,一些能磷酸化可溶性代谢物的代谢酶也能磷酸化多种蛋白质底物作为蛋白激酶,以调节细胞周期、凋亡和许多其他基本细胞过程。然而,代谢酶是否作为蛋白质磷酸酶去磷酸化蛋白质仍然未知。
2023年1月16日,中国科学院上海生物化学与细胞生物学研究所杨巍维、中国科学院大连化学物理研究所李国辉、广州大学王雄军及复旦大学李全林共同通讯在Cell Research(IF=46)在线发表题为“Fructose-1,6-bisphosphatase 1 dephosphorylates IκBα and suppresses colorectal tumorigenesis”的研究论文,该研究表明果糖-1,6-二磷酸酶1去磷酸化IκBα并抑制结直肠肿瘤发生。该研究通过分子对接和分子动力学(MD)模拟对代谢磷酸酶进行高通量筛选,揭示了糖异生酶果糖-1,6-双磷酸酯酶 (FBP1)作为蛋白质磷酸酶催化1,6-二磷酸果糖(F-1,6-BP)水解为果糖6-磷酸(F-6-P)。此外,通过磷酸化蛋白组学分析,作者确定IκBα是fbp1介导的去磷酸化的底物。
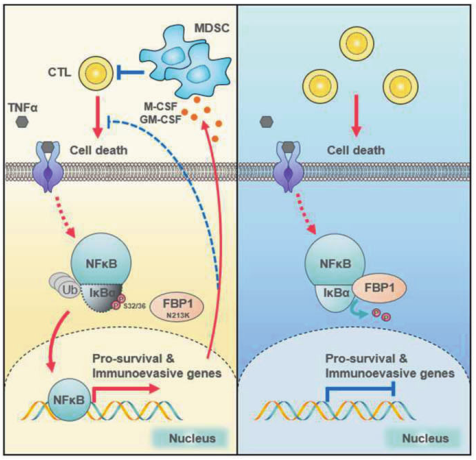
在机制上,FBP1在TNFα刺激下直接与IκBα的丝氨酸(S) 32/36相互作用并去磷酸化,从而抑制NF-κB的激活。MD模拟表明,fbp1介导的IκBα去磷酸化的催化机制与F-1,6-BP去磷酸化相似,只是IκBα去磷酸化存在更高能量的障碍。在功能上,fbp1依赖的NF-κB失活通过使肿瘤细胞对炎症应激敏感和阻止骨髓源性抑制细胞的动员来抑制结直肠肿瘤的发生。作者的发现揭示了FBP1作为蛋白磷酸酶之前未被认识到的作用,并确定了FBP1介导的IκBα去磷酸化在结直肠肿瘤发生中的关键作用。
磷酸化在细胞周期、生长、凋亡和信号转导通路等许多细胞过程中起着重要的调节作用。蛋白质的可逆磷酸化是通过激酶和磷酸酶的相反活性来完成的。可磷酸化可溶性代谢物的代谢酶也可作为蛋白激酶,磷酸化多种蛋白底物,调节Warburg效应、基因表达、凋亡、自噬等多种细胞基本功能。然而,代谢酶是否具有蛋白磷酸酶的功能,如果是的话,它参与了哪个细胞过程还没有被探索。
FBP1在二价阳离子存在下催化F-1,6-BP水解为F-6P,在糖异生过程中起着速率限制酶的作用。FBP1被越来越多地认为是一种肿瘤抑制因子,通过其代谢活性拮抗糖酵解,抑制细胞核中缺氧诱导因子的转录活性,或限制肝星状细胞的激活,并在基底样乳腺癌、透明细胞肾细胞癌和肝细胞癌中被沉默。然而,相对于其F-1,6-BP去磷酸化的代谢功能,FBP1是否作为蛋白磷酸酶去磷酸化蛋白质的功能尚不清楚。
FBP1介导的IκBα去磷酸化在肿瘤发生中的抑制作用(图源自Cell Research )
NF-κB在协调炎症的多个方面具有关键而复杂的功能,并控制在免疫,炎症和肿瘤发生过程中驱动细胞活化和增殖的重要调节基因的表达。在规范途径中,NF-κB/Rel蛋白被抑制性IκB 蛋白结合和抑制。促炎细胞因子、脂多糖、生长因子和抗原受体激活 IKK 复合物(IKKβ、IKKα和NEMO),其磷酸化IκB蛋白的丝氨酸(S)。IκB的磷酸化导致其泛素化和蛋白酶体降解,释放NF-κB/Rel复合物。活性NF-κB/Rel复合物易位到细胞核,在那里它们单独或与其他转录因子联合作用,以诱导靶基因表达。
在该研究中通过使肿瘤细胞对炎症应激诱导的细胞死亡敏感,建立了FBP1在CRC初始肿瘤生长中的抑瘤作用。在机制上,FBP1在TNFα刺激下与IκBα相互作用并去磷酸化,从而阻止IκBα降解并减弱随后的NF-κB激活。在启动的恶性细胞中,失活的NF-κB通过下调细胞生存基因来降低其在炎症微环境中的生存。同时,在NF-κB失活的细胞中,Tgfb1、Csf1、Csf3和Kitl的表达水平也下降,这通过阻止MDSCs的动员来促进ctl的浸润和抗肿瘤免疫。这两种机制都参与了FBP1的肿瘤抑制活性。
原文链接:
https://www.nature.com/articles/s41422-022-00773-0