传奇生物CAR-T细胞西达基奥仑赛二线治疗多发性骨髓瘤III期研究到达PFS主要终点
时间:2023-01-28 09:01:53 热度:37.1℃ 作者:网络
1月27日,传奇生物和强生宣布,BCMA CAR-T细胞疗法Carvykti(西达基奥仑赛,Cilta-cel)用于既往接受过1-3线治疗(包括蛋白酶体抑制剂和免疫调节药物)且来那度胺耐药的多发性骨髓瘤患者的III期开放标签研究在第一次预先指定的中期分析中,达到了无进展生存期(PFS)显著改善的主要终点。
在CARTIFAN-1试验中,Cilta-cel治疗的总体缓解率 (ORR) 为 89.6%(95% CI,77.3%-96.5%)。 首次缓解的中位时间为 0.95 个月(95% CI,0.9-5.2)。在中位随访 18.0 个月(范围,0.2-28.0)时,77.1%(95% CI,62.7%-88.0%)的患者达到完全缓解(CR)或更好。 达到 CR 或更好的中位时间为 3.32 个月(范围,0.9-15.1)。

此次公布的是CARTITUDE-4试验
CARTITUDE-4(NCT04181827)研究是一项国际、随机、开放标签的III期研究,以评估CAR-T疗法 vs 泊马度胺、硼替佐米和地塞米松(PVd)或达雷妥尤单抗(CD38单抗)、泊马度胺和地塞米松(DPd)在复发性和来那度胺难治性多发性骨髓瘤成人患者中的疗效和安全性。该研究的主要终点是PFS。次要终点包括安全性、总生存期(OS)、微小残留病(MRD)阴性率和总缓解率(ORR)。作为 CARTITUDE-4 研究的一部分,研究将继续跟踪患者的主要和次要终点。
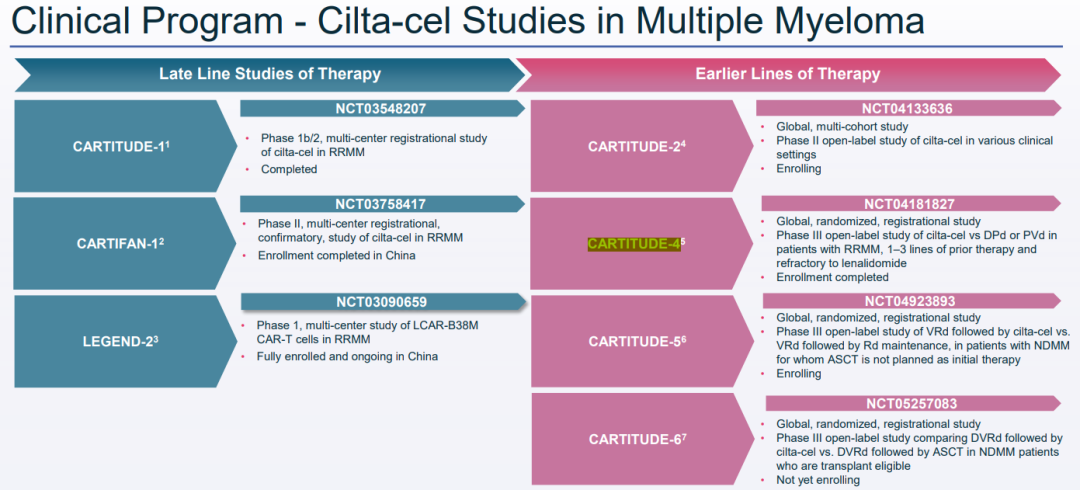
CARTITUDE-4研究的结果将提交给即将召开的医学会议,并将用于支持与药品监管机构就潜在的审批提交进行沟通。
Carvykti是传奇生物自主研发的一款结构差异化的CAR-T细胞疗法,2017年12月,强生引入Carvykti的开发和商业化权益,并向传奇生物支付3.5亿美元首付款和相关里程碑款。据悉,在除大中华区以外的全球市场中,传奇生物和杨森公司的成本和利润分摊比例为50/50,在大中华区该分摊比例为70/30(传奇生物/杨森公司)。
2022年3月,Carvykti获FDA批准上市,用于治疗复发/难治性多发性骨髓瘤(r/r MM)患者,成为首款获得FDA批准的国产CAR-T细胞疗法。此外,该产品于2022年5月、9月分别在欧盟和日本上市,在中国也已在2022年年底申报上市,并在今年1月20日被CDE正式纳入优先审评审批程序。
1月24日,传奇生物宣布Carvykti在2022年第四季度收入5500万美元,加上第二季度2400万美元和第三季度5500万美元的销售额,Carvykti在2022年的总销售额为1.34亿美元。
参考资料:
https://www.prnewswire.com/news-releases/janssen-announces-unblinding-of-phase-3-cartitude-4-study-of-carvykti-cilta-cel-as-primary-endpoint-met-in-treatment-of-patients-with-relapsed-and-refractory-multiple-myeloma-301732398.html


