【论著】| 青藤碱衍生物调变多发性骨髓瘤细胞趋化因子受体的实验研究
时间:2023-08-07 17:33:36 热度:37.1℃ 作者:网络
[摘要]
背景与目的:多发性骨髓瘤(multiple myeloma,MM)细胞表面CXC族趋化因子受体(CXC motif chemokine receptor,CXCR)与骨髓微环境内趋化因子相互作用参与MM细胞生存、增殖和髓外侵袭。青藤碱衍生物YL064通过靶向MM细胞内信号转导通路分子发挥其生物学效应。本研究探究青藤碱衍生物YL064对MM细胞表面CXCR3的调变作用及其生物学效应。
方法:以MM细胞系H929和MM1.S细胞为模型,利用慢病毒载体构建过表达CXCR3的H929-OE和MM1.S-OE细胞,采用克隆形成和体外迁移实验检测并比较H929、H929-OE、MM1.S和MM1.S-OE细胞克隆形成和迁移率;采用流式细胞术检测YL064处理后H929、H929-OE、MM1.S和MM1.S-OE细胞凋亡率;进一步以不同浓度YL064处理H929和MM1.S细胞,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)检测细胞内CXCR3基因转录和蛋白水平及其下游信号转导通路关键分子细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)和p-蛋白激酶B(p-protein kinase B,p-AKT)蛋白水平的改变。
结果:CXCR3过表达H929-OE和MM1.S-OE细胞克隆形成率分别为81.33%±5.79%和73.00%±4.90%,显著高于H929的58.33%±3.30%和MM1.S细胞的41.00%±3.14%;H929-OE和MM1.S-OE细胞迁移率分别为7.90%±0.81%和23.00%±1.63%,显著高于H929的4.63%±0.37%和MM1.S细胞的14.63%±1.04%;经YL064处理后,H929-OE和MM1.S-OE细胞凋亡率分别为29.80%±0.30%和14.2%±0.26%,显著低于H929的33.40%±0.25%和MM1.S细胞的21.60%±0.21%;上述结果比较差异有统计学意义(P均<0.05)。进一步研究发现YL064能够降低H929和MM1.S细胞克隆形成率和迁移率,同时抑制细胞内CXCR3基因转录并下调CXCR3、ERK和AKT蛋白表达。结论: CXCR3可以促进MM细胞增殖和迁移,青藤碱衍生物YL064能够下调MM细胞内CXCR3表达并抑制其下游信号转导通路进而干扰其增殖和迁移并诱导凋亡。
[关键词]多发性骨髓瘤;青藤碱衍生物;CXCR3;细胞凋亡
多发性骨髓瘤(multiple myeloma,MM)是血液系统第二常见肿瘤,近20年来,MM治疗路线图日新月异,新型免疫调节药物、蛋白酶体抑制剂、抗体靶向类药物和细胞免疫治疗显著提高了MM患者的临床缓解率并延长其生存期,但目前仍缺乏治愈性治疗方案[1]。因此,积极探索新型“货架型”治疗药物有其必要性和临床意义。
研究显示,CXC族趋化因子受体3(CXC motif chemokine receptor 3,CXCR3)参与多种恶性肿瘤细胞(包括胃癌、前列腺癌、肾癌和子宫颈癌等)的发生、发展[2-5]。近期临床和基础研究[6-7]还发现,CXCR与MM细胞髓外浸润密切相关,靶向CXCR成为调变MM细胞生物学行为的有效途径之一。研究[8]显示,青藤碱衍生物YL064可以抑制MM细胞增殖并诱导其凋亡,进一步研究还显示,YL064对MM细胞内多个靶蛋白具有调变效应。有鉴于此,本研究以MM细胞系H929和MM1.S细胞为体外模型,观察YL064对MM细胞内CXCR3蛋白及其下游信号转导通路的影响并探究其可能的作用机制。
1 资料和方法
1.1 制剂
青藤碱衍生物YL064(上海交通大学医学院病理生理学系提供)溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中配制成浓度为50 mmol/L的储存液。CXCR3特异性抑制剂AMG487(美国MedChem Express公司No.:473719-41-4)溶于DMSO中配制成浓度为5 mmol/L的储存液。
1.2 细胞培养
人MM细胞系H929和MM1.S细胞由上海交通大学医学院病理生理学系提供。将H929和MM1.S细胞接种于含10%胎牛血清(fetal bovine serum,FBS)、100 μg/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基(美国Sigma公司)中,每隔两天换液保持细胞密度维持在最佳生长状态(5×105个/mL)。HEK-293T细胞接种于含10%FBS、100 μg/mL青霉素和100 μg/mL链霉素的DMEM培养液(美国Sigma公司)中,上述细胞均在37℃、CO2体积分数为5%、95%湿度的培养箱中培养。
1.3 Annexin-Ⅴ/FITC/PI双染法检测细胞凋亡
根据Annexin-Ⅴ/FITC凋亡检测试剂盒(美国BD公司)说明,将不同处理组细胞收集于Eppendorf试管中,1 000×g离心3 min弃去配液,加入1 mL磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)洗涤,再次离心弃去洗涤液,并加入500 μL结合缓冲液,轻柔吹打重悬细胞。在每组细胞悬液中加入5 μL Annexin-Ⅴ/FITC,混匀后避光温育15 min,再加入5 μL碘化丙啶(propidium iodide,PI),避光温育3 min,30 min内进行流式细胞术检测。
1.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测
H929和MM1.S细胞分别以5×106个/mL密度接种于T75培养瓶。实验组加入30 μmol/L YL064,对照组加入等体积DMSO,置于加湿培养箱内培养8 h后收集细胞,根据制造商说明,使用总RNA抽提试剂盒[爱必信(上海)生物科技有限公司]从MM细胞系中提取总RNA。使用总RNA和第一链cDNA合成试剂盒(上海翊圣生物科技有限公司)反转录;使用ABI Prism 7700序列检测系统(美国Applied Biosystems公司)和特异性引物对cDNA进行检测,采用RTFQ-PCR检测细胞内CXCR3基因表达(CXCR3有义链为5’-ACCCAGCAGCCAGAGCACC-3’,反义链为5’-TCATAGGAAGAGCTGAAGTTCTCCA-3’)。RTFQ-PCR循环参数为:95℃变性15 s,60℃退火30 s,72℃延伸1 min,共40个循环。△Ct=Ct各组的值-Ctβ-actin,用2-△△Ct计算CXCR3基因表达量。
1.5 蛋白质印迹法(Western blot)检测细胞内蛋白表达
PBS洗涤后各组细胞中加入细胞裂解液提取总蛋白,经考马斯亮蓝定量后,取各组等量总蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE),250 mA恒流转膜90 min;室温3%牛蛋白血清(bovine serum albumin,BSA)封闭1 h,加入相应一抗,包括多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]、p-蛋白激酶B(p-protein kinase B,p-AKT)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)1/2、CXCR3和tubulin[均购自艾比玛特生物医药(上海)有限公司],置于4℃冷库摇床上过夜;次日用含有0.1%Tween-20的PBS洗涤10 min,弃去洗涤液,加入1∶10 000稀释的相应二抗,摇床上室温温育1 h。温育完成后用含有0.1%Tween-20的PBS充分洗涤(洗涤3次,每次10 min),用电化学发光(electrochemical luminescence,ECL)试剂盒(上海雅酶生物科技有限公司)显影液均匀覆盖在NC膜上,使用化学发光成像仪进行蛋白印迹条带扫描。
1.6 体外迁移实验
用24孔transwell板(8 μm孔膜,美国Corning Costar公司)进行体外侵袭和迁移测定。MM细胞株以5×105个/mL的密度重悬于RPMI-1640培养基中。将总共200 µL细胞悬液(1×105/孔)添加到上腔室中,同时将750 µL含有20%FBS的RPMI-1640培养基添加到下腔室中。12 h后收集来自下室培养基并离心,普通显微镜下计数下室细胞。
1.7 克隆形成实验
细胞克隆形成实验按如下步骤进行:① 配制1.2%和0.7%琼脂,高压蒸汽灭菌后置于水浴锅维持在42℃中使其不会凝固;② 配制含20%FBS、2×双抗的RMPI-1640培养基(上海语纯生物科技有限公司);③ 将1.2%琼脂与2×培养基混合,铺入6孔板作为下层胶,每孔2 mL,37°C温育30 min使之凝固;④ 细胞计数:取对数生长期的各组MM细胞,离心弃上清液后加入新的培养基混匀稀释,调整细胞密度为5×104/mL;⑤ 将制备好的2×培养基与0.7%琼脂1∶1充分混匀,加入100 µL细胞悬液即5 000个细胞,加入6孔板作为上层胶,每孔1.5 mL。待其凝固后,再在上面加入培养基,每3天更换1次;⑥ 根据细胞的生长速度培养2~3周后倒置显微镜下观察,计算单克隆形成率。
1.8 病毒感染构建稳定过表达CXCR3的MM细胞株
根据GenBank数据库中的基因信息(NM_001504),设计合成CXCR3蛋白质编码区全长序列引物并采用重叠延伸RTFQ-PCR技术扩增目的基因片段,运用基因重组技术将其克隆至慢病毒表达载体GV492(Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin),经酶切、测序对重组质粒进行验证。接下来,将重组质粒和慢病毒包装质粒(pHelper1.0和pHelper2.0)共转染HEK-293T细胞。收集转染后48 h HEK-293T细胞上清液,于4℃、4 000×g条件下离心10 min,去除细胞及碎片。0.45 µm滤器过滤上清液后置于超速离心管中,用Beckman超速离心机25 000 r/min离心2 h,离心温度4℃。离心结束后弃去上清液,用病毒保存液轻轻吹打重悬病毒沉淀,经充分溶解后于10 000 r/min离心5 min。采用荧光法测定上清液中病毒滴度达1E+9 TU/mL,病毒上清液于-80℃分装保存。转染H929和MM1.S 细胞效率达到80%的病毒感染复数(multiplicity of infection,MOI)分别为100和20。将H929和MM1.S细胞分别稀释为6×105、1×106个/mL浓度,接种于6孔板中,每孔加入1 mL细胞悬液。将病毒上清液在冰上解冻,根据MM细胞MOI每孔分别加入60 µL与20 µL病毒液和40 µL阳离子聚合物感染增强液(上海吉凯生物科技有限公司)。轻摇混匀后用干净保鲜膜小心包裹6孔板,置入37℃恒温离心机以1 000×g离心90 min或以1 500 r/min离心2 h以促进病毒感染。离心结束后拆去保鲜膜,将6孔板放入加湿培养箱继续培养4 h,然后以600 r/min离心5 min离心收集每孔细胞,更换新鲜的RPMI-1640培养基,48 h后再次离心换液,H929细胞及MM1.S细胞分别按5和8 μg/mL的浓度加入嘌呤霉素筛选转染成功的细胞并扩大培养,同时收集一部分细胞采用Western blot验证过表达和空载组细胞内CXCR3蛋白表达情况。
1.9 统计学处理
计量资料以x±s表示,克隆形成率、迁移率及凋亡率各组均数间比较采用Ordinary one-way ANOVA检验。P<0.05为差异有统计学意义。统计分析使用GraphPad.Prism 9.0版本。
2 结 果
2.1 MM细胞CXCR3表达与MM患者临床分期和生存率相关
采用Western blot检测CXCR3在MM细胞系H929、MM1.S、OPM-2和RPMI-8226细胞中的表达,结果表明,MM细胞表达CXCR3蛋白(图1A)。通过UCSC Xena在线分析CXCR3表达与MM患者预后关系。结果显示,CXCR3表达水平与MM患者总生存率(overall survival,OS)存在相关性,与CXCR3低表达组(n=212)相比,CXCR3高表达组(n=214)的MM患者OS显著降低(P=0.000 51,图1B)。分析高通量基因表达(Gene Expression Omnibus,GEO)数据库数据集GSE6477中MM患者临床标本。结果显示,冒烟型骨髓瘤患者CXCR3蛋白表达水平显著高于意义未明单克隆免疫球蛋白血症患者(P=0.023,图1C)。
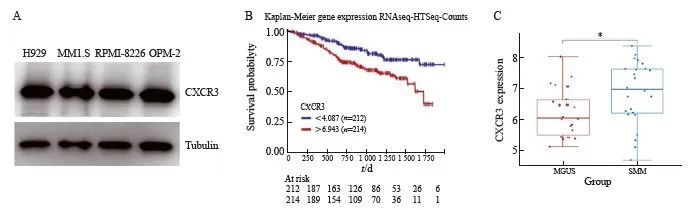
图1 MM细胞CXCR3表达与MM患者临床分期和生存率相关
Fig. 1 Expression of CXCR3 in MM cells and its relationship with clinical stage and survival of MM patients
A: Expression level of CXCR3 in MM cells was detected by Western blot; B: Kaplan-Meier survival analysis of the correlation between CXCR3 expression levels and overall survival of MM patients was performed in an online database; C: Relationship between CXCR3 expression and clinical stage was analyzed using the GEO database.
2.2 过表达CXCR3促进MM细胞迁移和增殖
利用慢病毒载体构建过表达CXCR3的MM细胞,采用Western blot检测H929-OE和MM1.S-OE细胞CXCR3过表达效率(图2A)。Transwell实验显示,与对照组细胞迁移率(H929为4.63%±0.37%,MM1.S为14.63%±1.04%)相比,过表达CXCR3的H929-OE和MM1.S-OE细胞迁移率(H929-OE为7.90%±0.81%,MM1.S-OE为23.00%±1.63%)明显增高(图2B)。同时,软琼脂克隆形成实验检测也显示,过表达CXCR3的H929-OE和MM1.S-OE细胞克隆形成率分别达81.33%±5.79%和73.00%±4.90%,明显高于对照组的H929和MM1.S细胞(H929为58.33%±3.30%, MM1.S为41.00%±3.14%,图2C)。
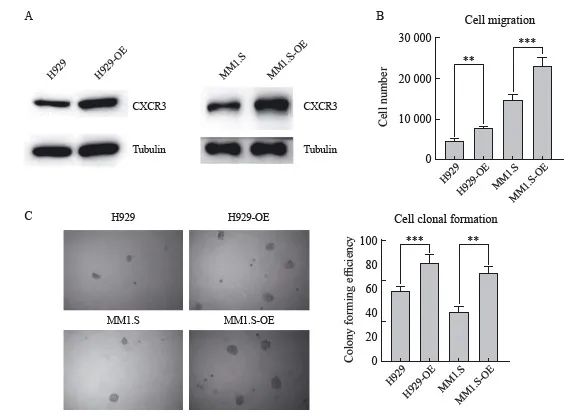
图2 CXCR3过表达对MM细胞克隆形成和迁移的影响
Fig.2 Effects of CXCR3 overexpression on migration and clonal formation of MM cells
2.3 YL064抑制MM细胞克隆形成和迁移
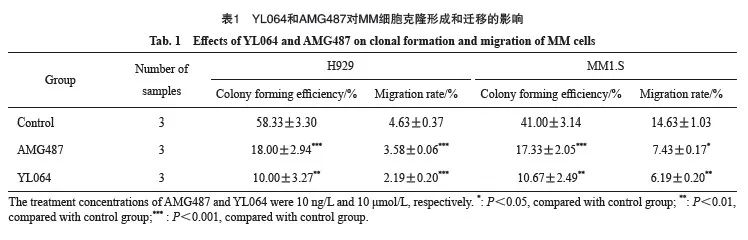
用YL064(10 μmol/L)和CXCR3特异性抑制剂AMG487(10 ng/mL)分别处理H929和MM1.S细胞12 h后,软琼脂克隆形成和transwell迁移实验检测细胞增殖和迁移情况,结果显示,YL064和AMG487可以降低H929和MM1.S细胞克隆形成率(H929为18.00%±2.94%和10.00%±3.27%,MM1.S为17.33%±2.05%和10.67%±2.49%),与未经药物处理的对照组细胞比较,差异有统计学意义(表1)。同时下调H929和MM1.S细胞迁移率(H929为2.19%±0.20%和3.58%±0.06%,MM1.S为7.43%±0.17%和6.19%±0.20%),与未经药物处理的对照组细胞比较,差异有统计学意义(表1)。
2.4 YL064下调MM细胞系CXCR3转录和表达水平并促进MM细胞凋亡
H929和MM1.S细胞经过20 μmol/L YL064处理24 h后,细胞内CXCR3mRNA表达量较DMSO处理对照组明显下降(图3A);Western blot检测结果也显示,相比对照组,不同浓度YL064(5、10、15和20 μmol/L)处理H929和MM1.S细胞24 h后,细胞内CXCR3蛋白表达水平显著下调,同时CXCR3下游信号转导通路关键分子ERK1/2和p-AKT蛋白水平明显下降(图3B);此外,Annexin-Ⅴ/PI双染法流式细胞术检测细胞凋亡率的结果显示,H929和MM1.S细胞经不同浓度YL064处理24 h后,Annexin-Ⅴ/PI双染细胞(即凋亡细胞)相比对照组均明显增多,且有明显浓度依赖性(图3C);与之相对应,YL064用药组H929和MM1.S细胞内凋亡相关蛋白PARP均发生明显剪切活化(图3B)。
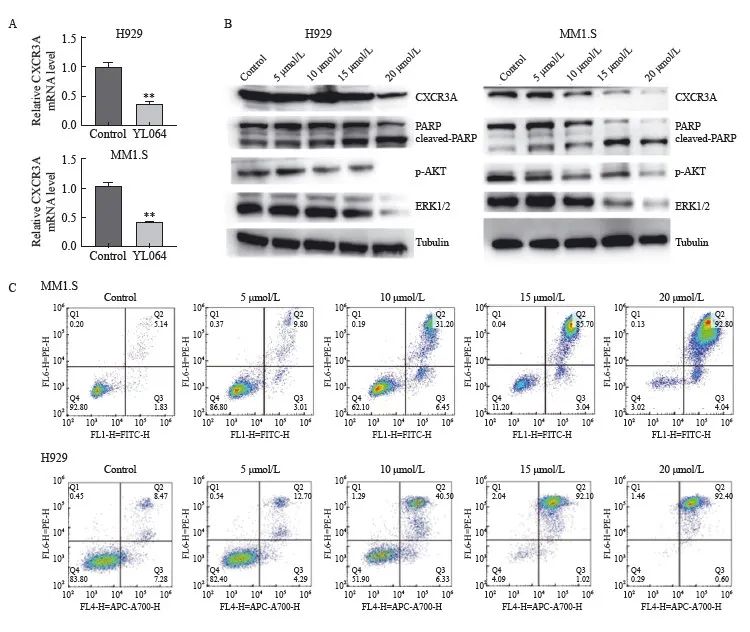
图3 YL064对MM细胞内CXCR3和信号转导通路调控分子的影响
Fig. 3 Effects of YL064 on expression of CXCR3 and signal pathway regulation of MM cells
A: Effects of YL064 on CXCR3 expression in H929 and MM1.S cells detected by RTFQ-PCR; **: P<0.01, compared with the control group; B: Effects of YL064 on CXCR3 pathway expression in H929 and MM1.S cells detected by Western blot; C: Apoptosis rate of H929 and MM1.S cells treated with different concentrations of YL064 detected by flow cytometry.
2.5 过表达CXCR3钝化YL064诱导MM细胞凋亡效应
过表达CXCR3的H929-OE 和MM1.S-OE细胞及对照组的H929和MM1.S细胞分别经过10 μmol YL064处理24 h,流式细胞术检测细胞凋亡率的结果显示,H929和MM1.S细胞凋亡率分别达到33.40%±0.25%和21.60%±0.21%,与之相比,过表达CXCR3的H929-OE和MM1.S-OE细胞凋亡率降低,分别为29.80%±0.30%和14.2%±0.26%(图4)。
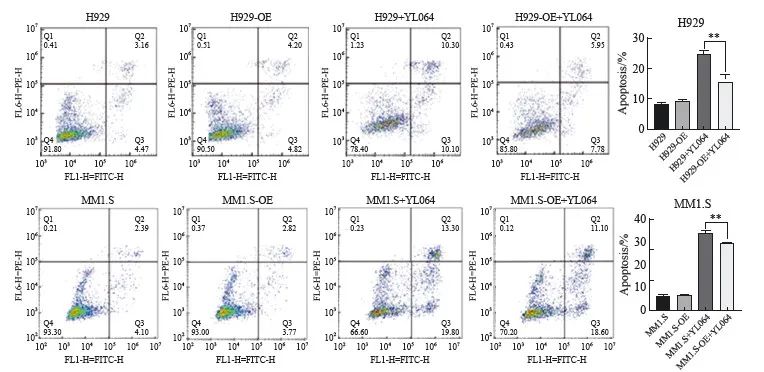
图4 CXCR3过表达对YL064诱导MM细胞凋亡的影响
Fig. 4 Effects of CXCR3 overexpression on YL064 inducing apoptosis in MM cell
The apoptosis rates of H929-OE and MM1.S-OE cells treated with 10 μmol YL064 were lower than those of H929 and MM1.S cells.
3 讨 论
骨髓微环境与MM细胞增殖、存活及耐药密切相关,MM细胞通过与特定“骨髓龛”内基质细胞相互作用,促进MM细胞迁移、增殖并对治疗药物产生抵抗。基质细胞主要通过分泌趋化因子与MM细胞表面相应趋化因子受体结合介导MM细胞黏附、跨血管内皮迁移和归巢[9-10]。因此,趋化因子及其受体成为MM细胞特定“骨髓龛”的关键构件,靶向趋化因子-趋化因子受体轴成为MM潜在治疗途径。
已有研究[11-12]显示,CXC亚家族趋化因子受体CXCR3在MM细胞系和原代细胞均有不同程度表达,而且MM患者肿瘤细胞CXCR3表达水平与其临床分期密切相关。MM细胞系H929、MM1.S、RPMI-8226和OPM-2细胞的Western blot检测结果显示,MM细胞系表达CXCR3,对MM患者原代细胞CXCR3分析研究也在进行中。UCSC Xena在线平台分析结果显示,高表达CXCR3的MM患者生存率较低表达患者显著降低。GEO数据库内数据集GES6477分析显示,冒烟型MM患者浆细胞CXCR3表达水平显著高于意义未明单克隆免疫球蛋白血症患者。这些结果提示CXCR3表达水平与MM疾病预后及进展密切相关。此外,CXC亚家族趋化因子受体(包括CXCR4和CXCR7)介导MM细胞与骨髓基质细胞相互作用,促进MM细胞增殖,CXCR4和CXCR7的拮抗剂NOX-A12能够干扰MM细胞归巢并增加其对治疗药物(包括蛋白酶体抑制剂、免疫调节剂和组蛋白去乙酰化酶抑制剂)的敏感性,目前NOX-A12联合硼替佐米和地塞米松方案已开始Ⅰ/Ⅱ期临床研究[13]。有鉴于此,采用慢病毒转染构建过表达CXCR3的MM细胞株H929-OE和MM1.S-OE,结果发现H929-OE和MM1.S-OE细胞克隆形成率和迁移率均明显提高,提示CXCR3可以促进MM细胞增殖和迁移,可能参与MM细胞特定微环境构成。
研究[14]显示,青藤碱衍生物YL064可以直接靶向MM细胞内关键信号转导分子(如信号转导和转录激活因子-3等)抑制MM细胞增殖并诱导其凋亡,有望应用于MM临床治疗。采用YL064和CXCR3特异性抑制剂AMG487处理H929和MM1.S细胞,结果显示,H929和MM1.S细胞克隆形成率和迁移率均明显下降,提示靶向抑制MM细胞内CXCR3可以干扰细胞增殖和迁移,YL064对CXCR3可能具有抑制或干扰作用。
基于上述研究结果,进一步采用不同浓度YL064处理H929和MM1.S细胞,结果发现,MM细胞内CXCR3基因转录和蛋白表达均显著受抑,同时其下游信号转导通路关键调控分子ERK1/2和p-AKT蛋白表达也显著下调,说明YL064可以抑制MM细胞内CXCR3转录和表达,并干扰CXCR3相关信号转导通路,这些生物学效应与YL064诱导MM细胞凋亡可能密切相关,YL064可以通过靶向MM细胞内CXCR3重构MM细胞与骨髓微环境相互作用而促进其增殖阻滞和凋亡。采用细胞热力学稳定性迁移分析和荧光蛋白共定位实验检测YL064与CXCR3相互作用的初步实验结果显示,YL064可能间接作用于CXCR3,这有待进一步验证。
骨髓基质细胞通过分泌细胞黏附分子和可溶性生长及存活因子介导MM细胞耐药,采用YL064处理过表达CXCR3的H929-OE和MM1.S-OE细胞株,结果发现,过表达CXCR3的MM细胞凋亡率下降,但仍存在凋亡,提示CXCR3可以介导MM细胞对YL064产生部分耐药性,但还不足以“煽动”完全耐药,这与针对趋化因子CXCL12的研究结果相似,单纯趋化因子-趋化因子受体轴活化还不足以充分“保护”MM细胞,耐药还涉及基质细胞与MM细胞直接相互作用[15]。
综上所述,CXCR3可能通过与相应趋化因子相互作用促进MM细胞增殖、归巢和迁移,成为MM治疗潜在靶标。青藤碱衍生物YL064能够下调MM细胞内CXCR3的表达并抑制其下游信号转导通路进而干扰MM细胞增殖和迁移并诱导其凋亡,这为构想复发或难治性MM患者新型联合治疗方案提供了实验及理论基础。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] VAN DE DONK N W C J, PAWLYN C, YONG K L. Multiple myeloma[J]. Lancet, 2021, 397(10272): 410-427.
[2] KOH H M, HYUN C L, JANG B G, et al. CXCR3 expression as a prognostic factor in gastric cancer: a meta-analysis[J]. Transl Cancer Res, 2021, 10(3): 1449-1456.
[3] MA B, KHAZALI A, SHAO H S, et al. Expression of E-cadherin and specific CXCR3 isoforms impact each other in prostate cancer[J]. Cell Commun Signal, 2019, 17(1): 164.
[4] GUDOWSKA-SAWCZUK M, KUDELSKI J, MROCZKO B. The role of chemokine receptor CXCR3 and its ligands in renal cell carcinoma[J]. Int J Mol Sci, 2020, 21(22): 8582.
[5] CHEN X N, HE H, XIAO Y, et al. CXCL10 produced by HPV-positive cervical cancer cells stimulates exosomal PDL1 expression by fibroblasts via CXCR3 and JAK-STAT pathways[J]. Front Oncol, 2021, 11: 629350.
[6] VANDE BROEK I, VANDERKERKEN K, VAN CAMP B, et al. Extravasation and homing mechanisms in multiple myeloma[J]. Clin Exp Metastasis, 2008, 25(4): 325-334.
[7] ULLAH T R. The role of CXCR4 in multiple myeloma: cells’ journey from bone marrow to beyond[J]. J Bone Oncol, 2019, 17: 100253.
[8] WANG Y Y, WU L L, CAI H Y, et al. YL064 directly inhibits STAT3 activity to induce apoptosis of multiple myeloma cells[J]. Cell Death Discov, 2018, 4: 44.
[9] SOLIMANDO A G, MALERBA E, LEONE P, et al. Drug resistance in multiple myeloma: soldiers and weapons in the bone marrow niche[J]. Front Oncol, 2022, 12: 973836.
[10] MAISO P, MOGOLLÓN P, OCIO E M, et al. Bone marrow mesenchymal stromal cells in multiple myeloma: their role as active contributors to myeloma progression[J]. Cancers
(Basel), 2021, 13(11): 2542.
[11] PELLEGRINO A, ANTONACI F, RUSSO F, et al. CXCR3-binding chemokines in multiple myeloma[J]. Cancer Lett, 2004, 207(2): 221-227.
[12] GIULIANI N, BONOMINI S, ROMAGNANI P, et al. CXCR3 and its binding chemokines in myeloma cells: expression of isoforms and potential relationships with myeloma cell proliferation and survival[J]. Haematologica, 2006, 91(11): 1489-1497.
[13] LUDWIG H, WEISEL K, PETRUCCI M T, et al. Olaptesed pegol, an anti-CXCL12/SDF-1 spiegelmer, alone and with bortezomib-dexamethasone in relapsed/refractory multiple myeloma: a phase Ⅱa study[J]. Leukemia, 2017, 31(4): 997-1000.
[14] WANG Y Y, WU L L, CAI H Y, et al. Sinomenine derivative YL064: a novel STAT3 inhibitor with promising anti-myeloma activity[J]. Cell Death Dis, 2018, 9: 1093.
[15] REN Z M, LANTERMANS H, KUIL A, et al. Correction to: the CXCL12gamma chemokine immobilized by heparan sulfate on stromal niche cells controls adhesion and mediates drug resistance in multiple myeloma[J]. J Hematol Oncol, 2021, 14(1): 29.


