《Nat Commun》:揭示蛋白相分离调控神经元NMDA受体膜聚集的机制
时间:2023-01-28 18:02:46 热度:37.1℃ 作者:网络
近日,首都医科大学基础医学院张晨教授团队在国际权威期刊《Nature Communications》上发表题为“Rabphilin-3A undergoes phase separation to regulate GluN2A mobility and surface clustering”的研究论文。该研究揭示Rabphilin-3A作为GluN2A特异性的结合蛋白,能够发生相分离形成局部的蛋白聚集,进而通过与GluN2A的C末端相互作用募集GluN2A,从而维持GluN2A在神经元细胞膜上的聚集和稳定性。首都医科大学基础医学院杨磊博士后、魏梦萍副教授和清华大学生命科学学院王仰真博士为该论文的共同第一作者,张晨教授为通讯作者。

N-甲基-D-天冬氨酸受体(NMDA受体)是中枢神经系统中重要的神经递质受体,对于神经元的兴奋性突触传递和突触可塑性十分重要。NMDA受体的不同亚基组成决定了其生物物理学和药理学性质以及NMDA受体功能。其中GluN2A和GluN2B亚基在神经元可塑性和多种神经疾病,如帕金森病、亨廷顿病、脑卒中中发挥着不同的作用。GluN2A和GluN2B在神经元膜表面具有不同的分布特征,目前为止,不同GluN2亚基组成的NMDA受体的膜表面聚集的调控机制仍不清楚。蛋白质通过液-液相分离在细胞内形成功能性的液滴并调控细胞内生命活动是近年来生物医学领域研究热点。近年来多项研究发现神经元中多种亚细胞结构的形成如突触后致密体(PSD),突触前活性区(active zone)都与蛋白质相分离相关,提示蛋白相分离或在神经元结构和功能的调控中发挥重要的作用。
张晨教授团队发现Rabphilin-3A作为GluN2A特异性的结合蛋白,能够通过其氮末端的精氨酸富集区域发生液-液相分离形成液滴,进而通过与GluN2A的碳末端相互作用募集GluN2A。Rabphilin-3A与GluN2A以及细胞骨架蛋白PSD95的相互作用可以促进Rabphilin-3A的相分离。此外,在神经元中破坏Rabphilin-3A的相分离会显著降低GluN2A突触部位和非突触部位的膜表面聚集,减少GluN2A的突触定位,降低GluN2A的膜表面稳定性和GluN2A依赖的兴奋性突触传递,而对GluN2B在突触部位的聚集和稳定性则没有影响。恢复Rabphilin-3A的相分离特性后则可以挽救上述GluN2A的异常变化。
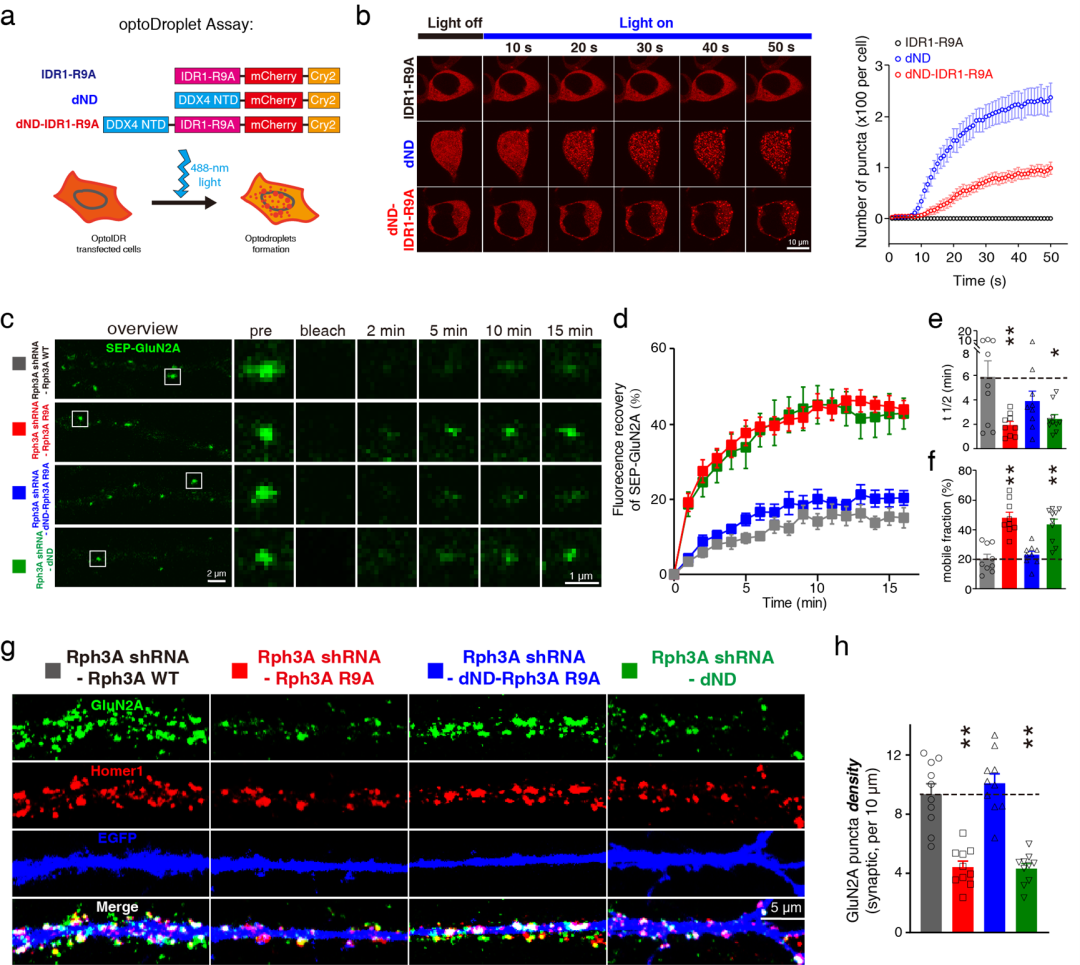
Rabphilin-3A相分离调控NMDA受体GluN2A亚基的膜聚集和稳定性
该研究阐明了蛋白相分离对GluN2A亚基在神经元膜表面的分布和稳定的调控机制,对于NMDA受体亚基特异性调控机制的研究具有重要的意义,对于帕金森病、亨廷顿病、脑卒中等疾病的治疗具有潜在的应用价值。
本研究受国家自然科学基金杰出青年基金(81925011)、重大研究计划项目集成项目(92149304)和面上基金(32170954)、青年基金(32100763)的资助,同时得到北京脑科学与类脑研究中心、转化医学与创新药物国家重点实验室、口腔健康北京实验室等项目的支持。


