JACC: 间充质干细胞疗法临床试验 III 期数据:慢性心衰
时间:2023-03-11 06:00:02 热度:37.1℃ 作者:网络
2023年2月27日,美国德克萨斯心脏研究所主任Emerson C. Perin博士在《美国心脏病学会杂志》(JACC)上公布了一项间充质干细胞治疗慢性心衰的III期临床试验(DREAM-HF试验)的详细数据。
结果表明:单次注射MPCs治疗能够显著减少慢性、高风险、低射血分数(HFrEF)心力衰竭患者的心脏病发作、中风和心肌梗死的发生频率,尤其是体内炎症程度较高的患者。
我们从以下几个知识点来简单介绍这个临床试验III期数据。
-01-干细胞制剂相关信息
干细胞药物:Rexlemestrocel-L
Rexlemestrocel-L(曾被称为MPC-150-IM),主要成分来自成年捐赠者的骨髓间充质祖细胞。Rexlemestrocel-L是从骨髓单个核细胞群中选择性分出相应的stro-3+祖细胞亚群,再通过体外培养扩增获得来,即MPCs(Mesenchymal Precursor Cell,MPCs),其实也就是MSCs亚群或间充质前体细胞。
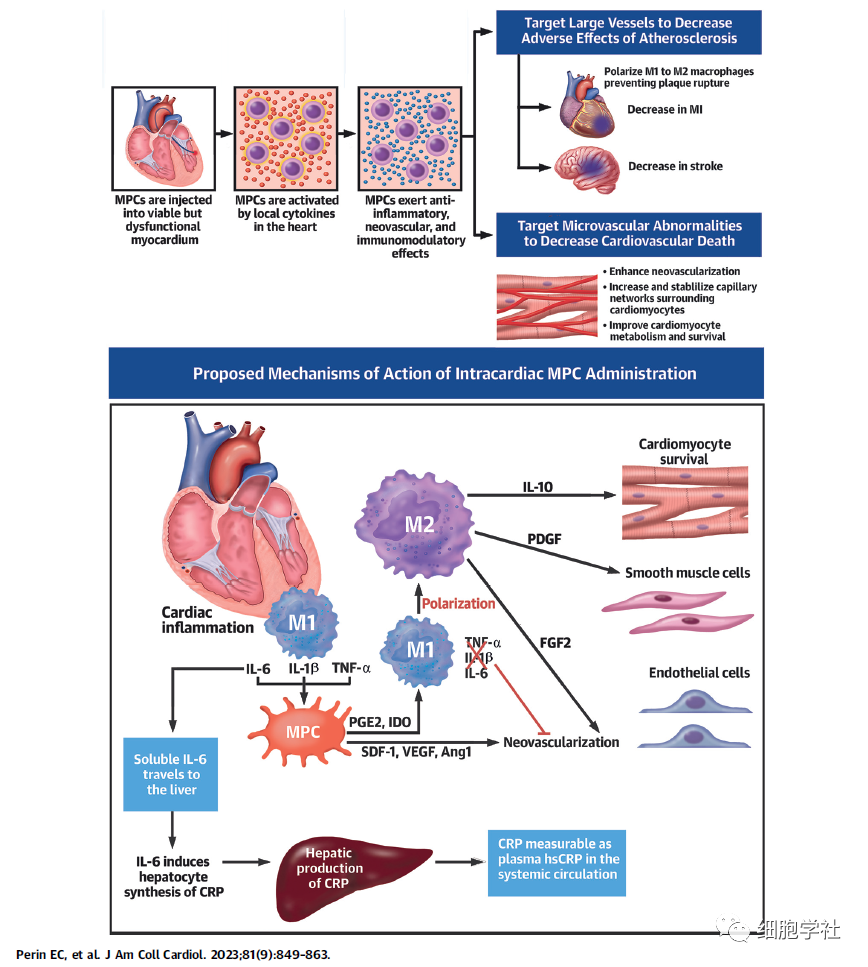
Rexlemestrocel-L单支剂量是由1.5X10*8 个高纯度MPCs细胞组成,通过注射或导管将其直接输送到心脏的左心室。Rexlemestrocel-L通过分泌强有力的活性因子,减轻损伤心肌组织的炎症,刺激血管网络的生长,从而达到增强心脏功能的目的。(注:其主要机理还是通间充质前体细胞旁分泌因子“唤醒”内源性细胞增殖,而非细胞分化为心肌细胞)
适应症:慢性心衰
心力衰竭(heart failure)简称心衰,顾名思义,自然是由于心脏泵血力量不足导致的一种心脏病。具体是指由于心脏收缩和/或舒张功能发生障碍,导致心脏排血量不能满足机体需要,导致呼吸困难、疲乏和心脏循环障碍一系列心脏问题。
大量的研究证实,间充质干细胞可以通过旁分泌效应和免疫调节效应,促使局部炎症反应下调,减轻组织的炎症损伤。针对慢性心衰这个适应症,采用局部给药方式,将1.5X10*8 个高纯度的MPCs细胞通过注射或导管将其直接输送到心脏的左心室,以期实现改善病情的目的。
-02-临床试验结果和分析
临床入组情况
DREAM-HF试验是一项随机、双盲、对照的多中心临床试验。在这项临床研究中,参与入组临床试验的为537名患者(原计划是565名患者入组,但有28人不符合入组资格),入组患者平均年龄63岁,约80%为男性。患者特点是心脏衰竭,射血分数降低,左心室泵血能力明显减弱。
为了探索干细胞治疗慢性心衰效果,参加入组的所有慢性心衰患者随机分为两大组,分别是:
A)261名患者直接用导管向心脏注射1.5亿个MPCs细胞,作为MPCs组。
B)276名患者只实施假手术,没有注射MPCs细胞,作为空白对照组。
临床结果分析
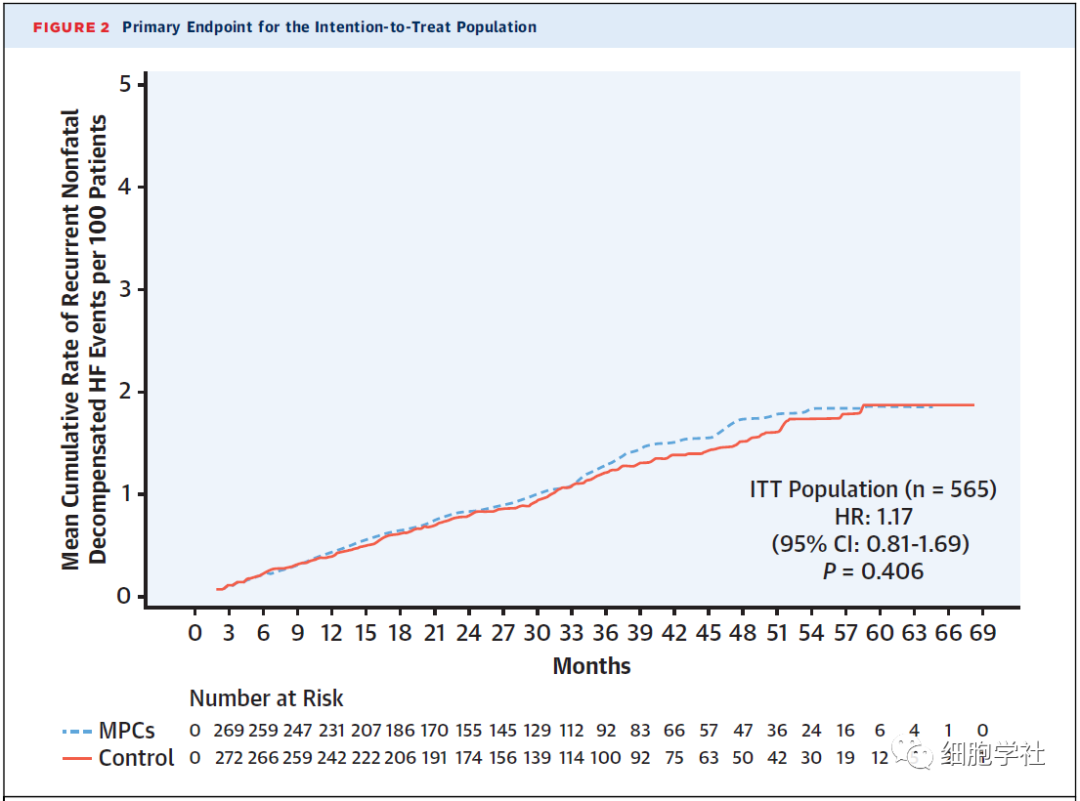
所有参与临床试验的患者在术后第二天出院。接下来,研究人员对这些参与者进行了平均29.9个月的随访。其试验设计主要终点事件是,经干细胞治疗后发生非致死性心力衰竭主要不良事件(包括心血管死亡、非致死性心肌梗死和非致死性卒中)的概率。同时也追踪了患者心脏病发作、中风或死亡情况,并测量患者体内炎症水平指标(即C-反应蛋白水平)。
主要研究结果如下:
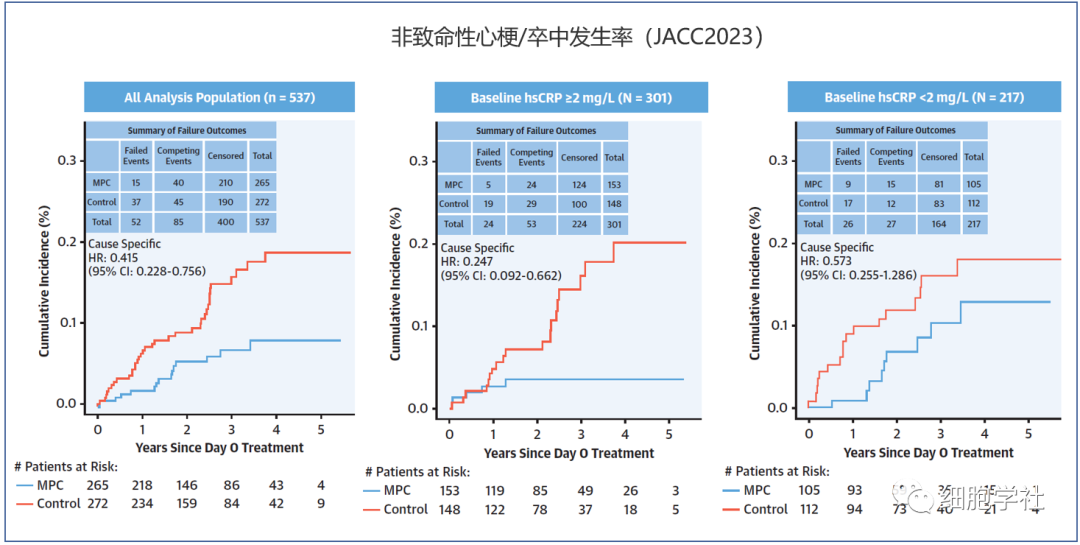
● 接受 MPCs 细胞治疗后,非致命性心脏病和中风事件减少了 58% ;
● 接受 MPCs 细胞治疗后,MPCs单独降低了 67% 的心肌梗死发病率,单独降低了 56% 的中风发病率。
● 接受 MPCs 细胞治疗后,心衰炎症水平高的患者心脏病发作和中风的概率降低 75%;
● 接受 MPCs 细胞治疗后,心衰炎症较低的患者从 MPCs 中获益较小。
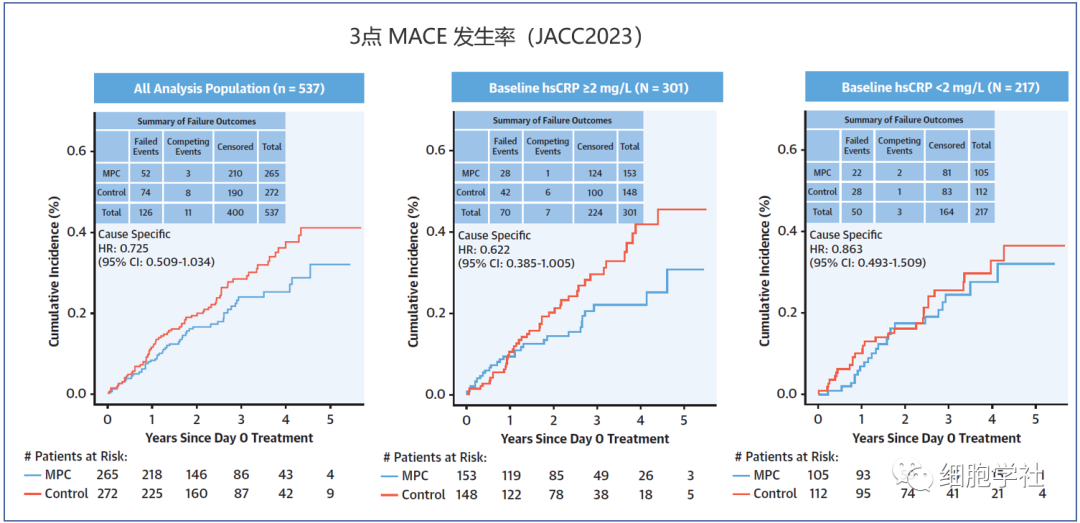
MACE(主要心血管不良事件)
MACE(Major Adverse Cardiovascular Events的缩写),即主要心血管不良事件,其主要包括三个终点事件:包括心血管死亡、非致死性心肌梗死和非致死性卒中。MACE是降糖药物的心血管结局研究主要的终点指标。
与对照组相比,在平均随访29.9个月期间,接受MPCs细胞给药后,患者的3点MACE降低了27%发生率;炎症水平较高的患者中,在平均随访29.9个月期间,接受MPCs细胞给药后,患者的3点MACE降低了38%发生率。
然而,从整体看,使用MPCs细胞治疗后,并没有进一步因患者因心力衰竭患病的住院人数变化增多或减少。
在德克萨斯心脏研究所医学主任 Emerson C. Perin 博士看来,间充质前体细胞(MPCs)通过减少炎症、增加微血管流量和增强心肌来发挥作用。在心脏中,MPCs可以保护心肌细胞免于凋亡,并改善血液流动和能量。而在全身中,MPCs具有全身免疫调节和抗炎作用,通过减少炎症而减少动脉硬化斑块的不稳定性,从而减少了心脏病发作和中风。
在美国FDA看来,3点MACE的降低是慢性心衰患者有临床意义的可接受终点。这是FDA用于批准多种心血管药物经常使用的一个指标。本次III期临床试验结果,将作为Mesoblast向FDA提交正式审查的重要依据。

Mesoblast产品研发管线
Mesoblast 公司是一家总部位于澳大利亚墨尔本的生物技术公司,是同种异体(通用现货型)细胞疗法的全球领导者,致力于开发以细胞为基础的再生治疗产品,用于炎性疾病的治疗。
Mesoblast 公司的细胞产品在多个适应症上都有布局,其主要功能就是用于炎性疾病的治疗。按照全身炎症和局部炎症,可以分为Remestemcel-L 和Rexlemestrocel-L两大类。Remestemcel-L(基于全身炎症)的适应症主要是移植物抗宿主病和急性呼吸窘迫症;Rexlemestrocel-L(基于局部炎症)的适应症主要是慢性心衰和慢性腰痛。
值得一提的是,在2018年,我国天士力公司与Mesoblast达成合作协议,引进两款分别处于FDA临床III期及Ⅱ期试验干细胞产品,适应症就是心力衰竭。
参考资料
[1]http://www.mesoblast.com/
[2]Randomized Trial of Targeted Transendocardial Delivery of Mesenchymal Precursor Cells in High-Risk Chronic Heart Failure Patients With Reduced Ejection Fraction. AHA2021.
[3]https://www.jacc.org/doi/10.1016/j.jacc.2022.11.061


