Science Advances:陆军军医大学刘秋礼/江军/秦骏发现肾透明细胞癌肿瘤生长和脂质沉积的新机制
时间:2023-08-09 19:30:52 热度:37.1℃ 作者:网络
全球每年约有43万人患有癌症,超过17.9万人死于肾癌,在过去几十年中,这一数字一直在增加。以细胞质脂质沉积增加为特征的肾透明细胞癌(ccRCC)占癌症所有亚型的75%以上。众所周知,主要由甘油三酯和胆固醇酯组成的细胞内脂滴在增殖过程中的能量稳态、膜合成和细胞信号传导中发挥着重要作用。
最近的证据表明,ccRCC中的额外脂质沉积不仅与肿瘤的发生和发展有关,还与转移和抗血管生成药物的耐药性有关。对于ccRCC,脂质沉积在其发展、转移和耐药性中起着重要作用。然而,ccRCC中脂质沉积的分子机制在很大程度上仍然未知。
2023年8月2日,陆军军医大学刘秋礼、江军及秦骏共同通讯在Science Advances在线发表了题为“PHF8-GLUL axis in lipid deposition and tumor growth of clear cell renal cell carcinoma”的研究论文,该研究揭示PHF8-GLUL轴在肾透明细胞癌脂质沉积和肿瘤生长中的作用。通过进行无偏见的CRISPR-Cas9筛选,研究者确定表观遗传调节因子植物同源结构域指蛋白8(PHF8)是ccRCC脂质沉积的重要调节因子。此外,PHF8受von Hippel-Lindau(VHL)/缺氧诱导因子(HIF)轴的调节,对VHL缺乏诱导的脂质沉积至关重要。PHF8转录上调谷氨酸氨连接酶(GLUL),促进脂质沉积和ccRCC进展。
从机制上讲,PHF8通过与c-MYC形成复合物,以组蛋白脱甲基依赖的方式上调TEA结构域转录因子1(TEAD1)。随后,TEAD1在转录上上调GLUL。l-甲硫氨酸磺酰亚胺对GLUL的药理学抑制不仅抑制了ccRCC的脂质沉积和肿瘤生长,而且增强了依维莫司的抗癌作用。因此,PHF8-GLUL轴代表了ccRCC治疗的潜在治疗靶点。总之,该研究报道了一个先前未确定的参与ccRCC肿瘤生长和脂质沉积的调控轴。确定PHF8是一种重要的表观遗传学调节因子,参与VHL/HIF介导的肿瘤生长和脂质沉积。

由体细胞突变或启动子甲基化引起的von Hippel–Lindau(VHL)失活发生在约90%的ccRCC中。VHL功能的丧失导致缺氧诱导因子(HIFs)的积累,这是ccRCC发展的主要驱动力。此外,由VHL/HIF介导的伪缺氧驱动的代谢重编程使ccRCC成为一种代谢相关疾病,葡萄糖使用增加(Warburg效应)和额外的脂质沉积证明了这一点。多种证据表明,VHL/HIF轴的异常激活是脂质沉积的主要原因。然而,VHL/HIF介导的ccRCC脂质沉积的潜在机制仍有待揭示。
谷氨酰胺是血液中最丰富的氨基酸,参与多种代谢途径。与非癌细胞相比,癌症细胞中谷氨酰胺积累和代谢的增加可以作为三羧酸(TCA)循环和脂质、谷胱甘肽和非必需氨基酸合成的前体,为维持癌症细胞的快速增殖、进展和转移提供代谢燃料。在包括ccRCC在内的VHL缺陷细胞中,谷氨酰胺是通过还原羧化合成脂质的主要来源。尽管外源性谷氨酰胺有利于脂质沉积和肿瘤细胞生长,但内源性谷氨酰胺在多种代谢途径中发挥着不可或缺的作用。谷氨酸氨连接酶(GLUL),也称为谷氨酰胺合酶,是唯一一种通过将谷氨酸与铵离子(NH4+)连接来负责从头合成谷氨酰胺的酶。先前的研究表明,GLUL介导的谷氨酰胺合成通过调节氨基酸运输和氮代谢(如核苷酸合成和回收过量氨)在肿瘤生长中发挥着至关重要的作用,而GLUL在ccRCC中的作用尚不清楚。
据报道,包括PBRM1、SETD2、BAP1和KDM5C在内的表观遗传学调节因子的功能障碍与ccRCC有关。已知VHL/HIF轴的改变会影响几种含有Jumonji C(JmjC)的表观遗传学调控因子,包括植物同源结构域指蛋白8(PHF8),也称为KDM7B。PHF8通过去甲基化H3K9me2/1、H3K27me2或H4K20me1来转录调节靶基因表达,并参与神经元分化、认知能力发展、细胞粘附和细胞骨架组织。最近的数据表明,上调的PHF8与多种恶性肿瘤相关,包括乳腺癌癌症、癌症、肝细胞癌、急性淋巴细胞白血病和癌症。
该研究证明PHF8促进ccRCC中的脂质沉积和肿瘤生长。从机制上讲,PHF8被c-MYC募集到TEA结构域转录因子1(TEAD1)的启动子区域,以转录上调TEAD1。随后,TEAD1在转录上上调GLUL。此外,研究者已经证明,靶向PHF8-GLUL轴不仅抑制了ccRCC的脂质沉积和肿瘤生长,而且与治疗试剂依维莫司(EVE)协同作用。
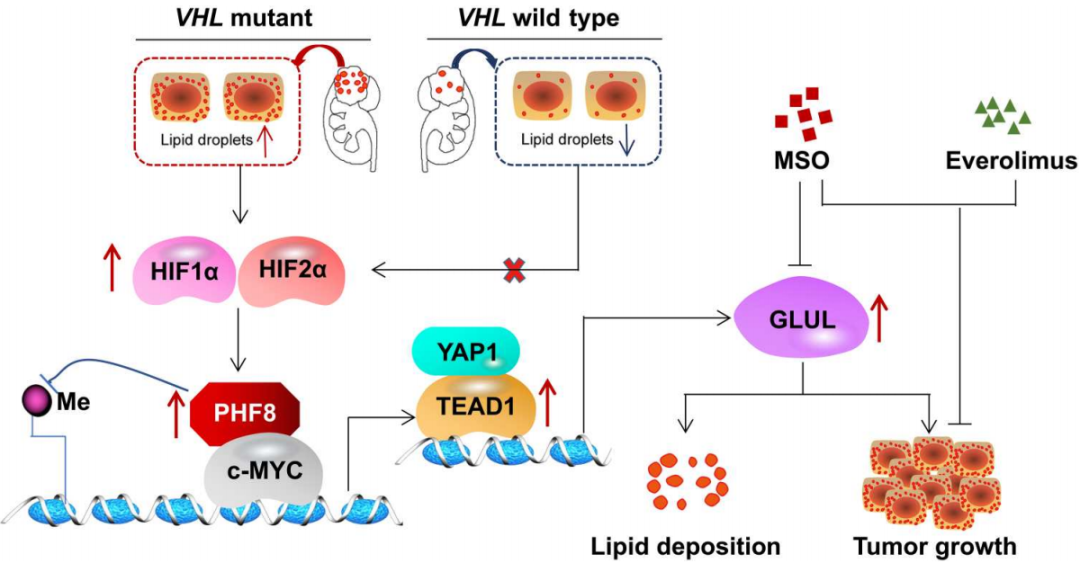
文章模式图(图源自Science Advances)
在这项研究中,从机制上讲,PHF8与c-MYC相互作用,并以脱甲基依赖的方式转录激活TEAD1。上调的TEAD1随后通过直接与其启动子结合来增强GLUL转录,并最终促进肿瘤生长和脂质沉积。激活的PHF8/TEAD1/GLUL轴也与ccRCC患者的Fuhrman分级较高和预后较差有关。在治疗上,GLUL抑制剂MSO可以有效抑制肿瘤生长和脂质沉积,并增强EVE的抗癌作用,这为ccRCC的治疗提供了一条以前未知的途径。
原文链接:
https://www.science.org/doi/full/10.1126/sciadv.adf3566


