Cell Research:阿司匹林能促进DNA双链断裂高保真修复,从而能预防癌症
时间:2023-03-27 06:02:11 热度:37.1℃ 作者:网络
阿司匹林(Aspirin,乙酰水杨酸)是医学史上较为古老的药物之一,自从上市以来已经有超过百年的临床应用,至今仍然是世界上应用最广泛的解热、镇痛和抗炎药物,近年来还被应用于心血管疾病和癌症的预防。
近日,一项最新研究发现,阿司匹林除了具备抗炎作用之外,其还是基于同源重组(HR)的DNA双链断裂(DSB)修复的有效放大器,该项研究结果以“Aspirin protects against genotoxicity by promoting genome repair”为题,发表在Cell Research上。研究表明,阿司匹林具有良好的抗辐射作用,具体说来,阿司匹林通过对组蛋白H4K16的乙酰化,增强了染色质压缩,进而增强DNA损伤部位招募修复因子进行同源重组(HR)修复。

DNA双链断裂是一种较为常见的DNA损伤形式,会导致遗传信息的丧失、突变和癌症等疾病。该项研究中新发现可以为癌症治疗提供一种全新的治疗选择。此外,DNA双链断裂也是炎症出现的主要原因,而炎症是辐射/化疗诱导的组织损伤的关键驱动因素。除了加速DSB的修复之外,阿司匹林还可能通过抑制炎症诱导的DNA损伤间接促进基因组保护。
在癌症的治疗过程中,骨髓衰竭是放疗后患者的主要死因,有基于此,保护骨髓是开发抗辐射的主要目标。考虑到阿司匹林的抗炎作用,在该项研究中,以蒋晖为代表的研究团队探索用阿司匹林来预防辐射带来的伤害。
借助于小鼠试验,研究人员发现阿司匹林可防止辐射诱导的骨髓消融并抑制辐射对炎症基因(包括Ifnb1、Mx1和Tnfa)的诱导。模式识别受体 (PRR),包括 Toll 样受体(TLR)、RIG-I 样受体 (RLR) 和胞质 DNA 传感器 (CDS),是引发炎症和细胞死亡的核心。为了评估阿司匹林对PRR通路的影响,研究团队将野生型(WT)小鼠与PRR信号传导缺陷小鼠进行了对比试验。研究结果表明,骨髓抑制与PRR驱动的炎症无关,阿司匹林的辐射保护作用也与其抗炎作用无关。
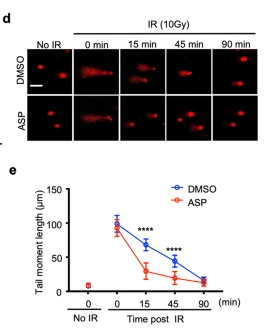
DSB是辐射最有害的结果,其可能会导致微核的形成。HEK293细胞在PRR信号传导方面存在缺陷,并且缺乏前列腺素-内过氧化物合酶,这些也是炎症和疼痛的关键介质,也是阿司匹林最著名的靶标。阿司匹林抑制HEK293细胞中辐射诱导的微核生成,表明这种作用与其抗炎活性无关。当在冰上照射(以防止自发修复),然后从冰转移到37°C以允许DNA修复发生时,阿司匹林预处理的细胞修复DSB 的速度更快,此外阿司匹林还加速了由抗癌药物阿霉素诱导的DSB修复。
基于绿色荧光蛋白报告系统的结果显示,阿司匹林促进HR修复,但并没有促进NHEJ修复,且BRCA1 的缺失显着减弱了阿司匹林对 DSB 修复的加速作用
综上,这项研究表明,除了抗炎作用之外,阿司匹林还是HR介导的DNA修复的有效放大器。阿司匹林抑制炎症通路和通过HR促进DSB修复的能力强调了其在炎症和基因组不稳定驱动的健康问题管理中的潜力。此外,阿司匹林是染色质结构和修复调节剂的发现提供了一种新机制,可以解释其许多广受赞誉的健康益处,包括预防癌症。
责编|木子久
参考资料:


